低聚木糖对低盐胁迫下凡纳滨对虾生长、免疫及肠道菌落的影响
2023-07-22朱启飞贺莹李云刘红
朱启飞 贺莹 李云 刘红


摘要:【目的】探究低鹽胁迫下低聚木糖(XOS)对凡纳滨对虾(Litopenaeus vannamei)生长性能、抗氧化能力、免疫相关基因表达及肠道菌群结构的影响,为凡纳滨对虾淡化养殖饲料的开发提供理论依据。【方法】将450尾凡纳滨对虾按照养殖水体盐度和XOS添加量分为海水对照组HS0(盐度30‰+0 mg/kg XOS)及低盐对照组LS0(盐度3‰+0 mg/kg XOS)、LS250(盐度3‰+250 mg/kg XOS)、LS500(盐度3‰+500 mg/kg XOS)和LS1000(盐度3‰+1000 mg/kg XOS)。饲养8周后计算生长指标,采用试剂盒测定消化酶活性和抗氧化指标,并通过实时荧光定量PCR检测免疫相关基因的表达情况。【结果】与HS0组相比,LS0组凡纳滨对虾的生长指标、消化酶活性、抗氧化能力及免疫相关基因相对表达量均有所下降。与LS0组相比,LS500和LS1000组凡纳滨对虾的增重率、特定生长率、存活率及淀粉酶(AMS)活性均呈显著升高趋势(P<0.05,下同),丙二醛(MDA)含量则呈显著降低趋势;脂肪酶(LPS)、胰蛋白酶(Trp)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性呈上升趋势,但差异不显著(P>0.05)。LS500和LS1000组凡纳滨对虾的酚氧化酶原(proPO)、抗脂多糖因子(ALF)、溶菌酶(LZM)、Toll样受体1(TLR1)、Toll样受体2(TLR2)和Toll样受体3(TLR3)基因的相对表达量均显著高于LS0组凡纳滨对虾。此外,LS1000组凡纳滨对虾的肠道菌群Shannon指数、Chao1指数和ACE指数显著高于LS0组凡纳滨对虾,Simpson指数显著低于LS0组凡纳滨对虾;在门分类水平上,变形菌门和拟杆菌门相对丰度显著降低,而蓝细菌门、厚壁菌门和疣微菌门的相对丰度显著增高;在属分类水平上,弧菌属、黄海绵菌属、斯氏弓型菌属和希瓦氏菌属相对丰度显著降低,而乳酸杆菌属和不动杆菌属相对丰度显著增加。【结论】在基础饲料中添加500~1000 mg/kg XOS,可显著提高凡纳滨对虾生长速率、抗氧化性能、免疫相关基因表达及改善肠道菌群组成结构,有效提高对虾在低盐胁迫下的养殖效果,即XOS可作为凡纳滨对虾淡化养殖饲料添加剂进一步开发应用。
关键词:凡纳滨对虾;低盐胁迫;低聚木糖(XOS);生长;免疫;肠道菌群
中图分类号:S968.229 文献标志码:A 文章编号:2095-1191(2023)02-0618-11
Abstract:【Objective】This study investigated the effects of xylo-oligosaccharide (XOS) on the growth performance, antioxidant capacity, immune-related gene expression and intestinal flora structure of Litopenaeus vannamei under low salinity stress conditions, and provided theoretical basis for the development of desalination culture feeds for L. vannamei. 【Method】According to the salinity of the cultured water and XOS addition, the 450 L. vannamei were divided into seawater control group HS0 (salinity 30‰+0 mg/kg XOS), low salinity control groups LS0 (salinity 3‰+0 mg/kg XOS), LS250 (salinity 3‰+250 mg/kg XOS), LS500 (salinity 3‰+500 mg/kg XOS) and LS1000 (salinity 3‰+1000 mg/kg XOS). Growth indexes were calculated after 8 weeks of feeding, digestive enzyme activities and antioxidant indexes were measured by kits, meanwhile, immune-related gene expression was detected by real-time fluorescence quantitative PCR. 【Result】Compared with the HS0 group, the growth indexes, digestive enzyme activities, antioxidant capacity and the re-lative expression of immune-related genes of L. vannamei in the LS0 group were all decreased. Compared with the LS0 group, the weight gain rate, specific growth rate, survival rate and amylase(AMS) activity of L. vannamei in the LS500 and LS1000 groups showed significant increase trend (P<0.05, the same below), while the malondialdehyde (MDA) content showed a significant decrease trend. Lipase (LPS), trypsin (Trp), superoxide dismutase (SOD) and catalase (CAT) activities also showed an increasing trend, but the difference was not significant (P>0.05). In LS500 and LS1000 groups, the relative expression levels of prophenoloxidase (proPO), anti-lipopolysaccharide factor (ALF), lysozyme (LZM), toll-like receptor 1(TLR1), toll-like receptor 2(TLR2) and toll-like receptor 3(TLR3) genes in LS500 and LS1000 groups were significantly higher than LS0. The intestinal flora Shannon index, Chao1 index, ACE index of LS1000 group L. vannamei were significantly higher than LS0 group,and Simpson index was significantly lower than LS0 group. At the phylum level, the relative abundance of Proteobacteria and Bacteroidetes decreased significantly, while the relative abundance of Cyanobacteria_Chloroplast, Firmicutes and Verrucomicrobia increased significantly. At the genus level, the relative abundance of Vibrio, Spongiimonas, Arcobacter and Shewanella decreased significantly, while the relative abundance of Lactobacillus and Acinetobacter increased significantly. 【Conclusion】Under low salinity stress, the addition of 500-1000 mg/kg XOS to the feed in this study significantly increased the growth rate, antioxidant performance, immune-related gene expression and improved the composition structure of intestinal flora of L. vannamei, effectively improving the culture effect of shrimp under low salitiny stress, so that XOS can be further developed and applied as a feed additive for desalination culture of L. vannamei.
Key words: Litopenaeus vannamei; low salinity stress; xylo-oligosaccharide(XOS); growth performance; immune; intestinal flora
Foundation items: Shanghai Agriculture Applied Technology Development Project(2019-02-08-00-10-F01111)
0 引言
【研究意义】凡纳滨对虾(Litopenaeus vannamei)原产于墨西哥南部至秘鲁的太平洋沿岸,具有适应性广、生长速度快及肉质鲜美等优点,是目前全球最主要的水产养殖品种之一(王兴强等,2004)。为满足日趋增加的市场需求,以及避免沿岸水质恶化导致新的疾病,凡纳滨对虾养殖范围已由沿岸水域逐渐扩展到内陆低盐度水域(Li et al.,2017),但在长期低盐胁迫下凡纳滨对虾免疫力低下(Xu et al.,2017)、存活率下降(Pinheiro et al.,2019)、生长缓慢(汤上上等,2022)等系列问题已成为制约其淡化养殖发展的重要因素。因此,亟待寻找一种科学有效的方法以缓解这些不良反应,确保凡纳滨对虾淡化养殖业的持续健康发展。【前人研究进展】低聚木糖(Xylo-oligosaccharides,XOS)是由2~7个木糖分子以β-1,4糖苷键结合而成的功能性聚合糖,其有效成分以木二糖和木三糖为主。XOS作为新型的动物饲料添加剂具有一些独特性能,包括耐酸耐热、有效摄入剂量低、不易被肠道消化酶分解、具有良好配伍性等优点,且能在玉米芯、甘蔗渣等纤维原料中提取获得(袁钟宇等,2008)。此外,XOS能通过改善宿主肠道菌群结构,刺激肠道消化酶活性,增强机体的抗氧化性能、免疫力和抗逆性,进而维持其健康水平(胡毅,2007;胡晓伟等,2018;Zhang et al.,2020)。至今,有关XOS对鱼类影响的研究已有较多报道。熊沈学(2005)以含XOS的饲料饲喂异育银鲫(Carassius auratus gibelio)45 d,结果发现添加0.01% XOS能显著提高增重率及其肠道和肝胰腺的消化酶活性,但超过该水平后各项指标呈下降趋势。强俊等(2009)研究表明,在饲料中添加0.03% XOS能显著提高奥尼罗非鱼(Oreochromis niloticus×O. aureus)的特定生长率,肝胰脏蛋白酶和肠蛋白酶活力则呈先上升后下降的变化趋势。庞丽姣(2011)研究证实,以含XOS(添加量在2~4 g/kg)的饲料饲喂草鱼(Ctenopharyngodon idellus)56 d后,IL-1β、IFN、TNFα等免疫相关基因在草鱼肝脏、肾脏和脾脏中的相对表达量显著上调。齐志涛等(2011)以含XOS的饲料饲喂斑点叉尾鮰(Ictalurus punctatus)50 d,结果发现添加量在0.05%~0.10%时斑点叉尾鮰血清中的谷丙转氨酶(ALT)和谷草转氨酶(AST)活力显著提高。张荣斌等(2011)研究报道,饲喂奥尼罗非鱼含XOS的饲料56 d后,添加量在600~710 mg/kg的奥尼罗非鱼血清超氧化物歧化酶(SOD)活力显著升高,且随养殖时间的推移,SOD活力呈先升高后降低的变化趋势。但近10年来有关XOS对甲壳类动物影响的研究报道较少。王国霞等(2010)研究发现添加400 mg/kg XOS能显著提高凡纳滨对虾幼虾肝胰腺脂肪酶(LPS)和胃蛋白酶活力,且肠道绒毛的长度和厚度显著增加,肠道双歧杆菌数量显著增加,而弧菌数量显著下降。陈晓瑛等(2014,2018)研究发现,在基础饲料中添加200 mg/kg XOS能显著提高凡纳滨对虾特定生长率、增重率和肝体脂数等各项生长指标,饲料系数显著降低;添加400 mg/kg XOS能显著提高凡纳滨对虾血清溶菌酶(LZM)和酚氧化酶活力,有效降低肝胰腺丙二醛(MDA)含量,且肠道中的双歧杆菌、乳酸菌等益生菌相对丰度显著增加,弧菌和葡萄球菌相对丰度显著下降。【本研究切入点】肠道既是甲壳类动物主要的消化器官,在面对环境胁迫时也是重要的能量来源场所。XOS作为饲料添加剂有利于肠道益生菌生长增殖,提高机体对营养物质的消化吸收能力,进而提高其应对环境胁迫的能力,因此探究XOS是否能有效提高凡纳滨对虾在低盐环境中的适应能力,对确保对虾养殖业健康发展具有重要意义。【拟解决的关键问题】在低盐胁迫条件下,探究基础饲料中添加XOS对凡纳滨对虾生长性能、抗氧化能力、免疫相关基因表达及肠道菌群结构的影响,为凡纳滨对虾淡化养殖饲料的研发提供理论依据。
1 材料与方法
1. 1 试验饲料制备
以鱼粉、豆粕、花生粕、小麦粉、乌贼膏、虾壳粉、大豆卵磷脂、鱼油及预混料配制的基础饲料购自广东恒兴饲料科技有限公司,饲料具体配方见表1。XOS(纯度99%,浙江一诺生物科技有限公司)先溶于水,再加入基础饲料搅拌均匀,制成含25、500和1000 mg/kg XOS的3种试验饲料,置于烘箱中55 ℃烘干24 h后过筛制成1.5~1.8 mm颗粒饲料。试验饲料含水率低于10%,密封保存備用。
1. 2 凡纳滨对虾饲养管理
供试凡纳滨对虾由上海海洋大学洋山港良种选育基地提供,共设5个处理,每处理设3个平行,每个平行为1个350 L的养殖桶。按照养殖水体盐度和饲料中的XOS含量,分为海水对照组HS0(盐度30‰+0 mg/kg XOS)及低盐胁迫组LS0(盐度3‰+0 mg/kg XOS)、LS250(盐度3‰+250 mg/kg XOS)、LS500(盐度3‰+500 mg/kg XOS)和LS1000(盐度3‰+1000 mg/kg XOS)。挑选450尾规格均匀、活力强、体重相近(0.30±0.01 g)的幼虾随机分到养殖桶中,每桶30尾,饲养8周。每天投喂4次(8:00、12:00、18:00和23:00),饱食投喂,1 h后收集残饵和粪便。日换水量为总水体的30%,水温维持在26~28 ℃,pH 7.5~8.0,溶解氧≥5 mg/L,总氨<0.05 mg/L。每天观察凡纳滨对虾的健康状况并记录死亡情况。
1. 3 样品采集及生长指标计算
提前24 h禁食再取样,记录各养殖桶中的凡纳滨对虾数量及测量每尾对虾的体长和体重。每个平行选取15尾对虾并在冰盘上快速解剖,采集肝胰腺、肠道和鳃组织放入无菌冻存管中。所有组织样品采集后立即置于液氮中速冻,再转移至-80 ℃冰箱保存备用。生长指标计算参照陈俭等(2022)的方法:
增重率(WGR,%)=(终末体重-初始体重)/初始体重×100
特定生长率(SGR,%/d)=(ln终末体重-ln初始体重)/试验天数×100
肥满度(CF,%)=终末体重/终末体长3×100
肝体指数(HSI,%)=终末肝胰腺重/终末体重×100
存活率(SR,%)=终末尾数/初始尾数×100
1. 4 指标测定
1. 4. 1 消化酶活性和抗氧化指标测定 每个重复选取6尾凡纳滨对虾的肝胰腺和肠道组织样品,按照南京建成生物工程研究所生产的试剂盒说明制备10%组织匀浆液,取出上清液分装后置于-80 ℃冰箱保存备用。肠道上清液用于测定消化酶[淀粉酶(AMS)、胰蛋白酶(Trp)和LPS]活性,肝胰腺上清液用于测定抗氧化指标[SOD、过氧化氢酶(CAT)和丙二醛(MDA)]。所有样品测定总蛋白浓度,具体步骤按试剂盒说明进行操作。
1. 4. 2 免疫相关基因表达量测定 每个重复选取6尾凡纳滨对虾的鳃组织样品,按照TaKaRa RNAiso Plus试剂盒说明提取总RNA。根据FastQuant RT Kit试剂盒说明将总RNA反转录合成cDNA,设计特异性引物(表2),以18S为内参基因,通过TaKaRa相对荧光定量试剂盒检测免疫相关基因表达情况,每个样品3次重复,并以2-ΔΔCt法换算且的基因相对表达量。
1. 5 消化道细菌高通量测序分析
凡纳滨对虾肠道样品送至生工生物工程(上海)股份有限公司进行肠道微生物分析。提取肠道细菌总DNA,并针对细菌16S rRNA序列V3~V4区设计含Barcode的特异性引物515F(5'-GTGCCAGCMG CCGCGGTAA-3')和806R(5'-GGACTACHVGGGTW TCTAAT-3'),进行PCR扩增。通过Illumina Miseq?/HiseqTM测序得到的原始图像数据文件经碱基识别(Base calling)分析转化为原始序列(Raw date),结果以FASTQ文件格式存储(舒迎霜等,2020;郝贺等,2021)。Raw date经质量分析,去除测序接头、低质量读段及N比例大于10%的序列及长度过短序列后得到有效序列(Clean date),再利用Uparse v7.0.1001(http://www.drive5.com/uparse/)对Clean date进行OTUs聚类分析;同时选取OTUs代表序列进行物种注释,通过BLASTn比对筛选出最佳比对结果并过滤(阈值范围0.9~1.0),不满足条件的序列则归为Unclassified。利用QIIME v1.9.1计算凡纳滨对虾肠道菌群Alpha多样性指数(ACE、Chao1、Simpson和Shannon)(陈俭等,2022),使用GraphPad Prism 8.0对比多个样本在不同分类水平上的群落结构,并将相对丰度大于1%的物种归为优势物种。
1. 6 统计分析
利用SPSS 20.0对试验数据进行独立样本T检验、单因素方差分析(One-way ANOVA)及Duncans多重比较。
2 结果与分析
2. 1 XOS对凡纳滨对虾生长性能的影响
在不同XOS添加量和低盐胁迫条件下,凡纳滨对虾的生长性能指标见图1。其中,HS0组凡纳滨对虾的各项指标均显著高于LS0组(P<0.05,下同),各低盐胁迫组凡纳滨对虾的增重率、特定生长率、肥满度、肝体指数和存活率均随饲料中XOS添加量的增加呈上升趋势。相对于LS0组,LS1000组凡纳滨对虾的各项生长指标均显著升高,LS500组凡纳滨对虾的增重率、特定生长率和存活率呈显著升高趋势,而LS250组凡纳滨对虾的各项指标无显著变化(P>0.05,下同)。
2. 2 XOS对凡纳滨对虾消化酶和抗氧化指标的影响
在不同XOS添加量和低盐胁迫条件下,凡纳滨对虾的肠道消化酶活性和肝胰腺抗氧化指标见图2。与HS0组相比,LS0组凡纳滨对虾的AMS活性和MDA含量显著升高,而Trp和LPS活性显著降低。各低盐胁迫组凡纳滨对虾的消化酶活性及抗氧化性能均随饲料中XOS添加量的增加而逐渐提高,其中,LS500和LS1000组凡纳滨对虾的AMS活性显著高于LS0组,LS500组凡纳滨对虾的CAT活性显著高于LS0组,MDA含量则表现为LS500和LS1000组凡纳滨对虾显著低于LS0组。
2. 3 XOS对凡纳滨对虾免疫相关基因表达量的影响
在不同XOS添加量和低盐胁迫条件下,凡纳滨对虾鳃组织中免疫相关基因的表达情况见图3。与HS0组相比,LS0组凡纳滨对虾鳃组织中的酚氧化酶原(proPO)、抗脂多糖因子(ALF)、溶菌酶(LZM)、Toll样受体1(TLR1)、Toll样受体2(TLR2)和Toll样受体3(TLR3)基因的相对表达量均有所下降,但差异不显著。各低盐胁迫组凡纳滨对虾鳃组织中免疫相关基因相对表达量均随饲料中XOS添加量的增加呈上升趋势,其中,LS500和LS1000组凡纳滨对虾免疫相关基因的相对表达量均显著高于LS0组,而LS250组凡纳滨对虾的ALF、LZM、TLR1、TLR2和TLR3基因相对表达量与LS0组无显著差异。
2. 4 XOS对凡纳滨对虾肠道菌群结构组成及多样性的影响
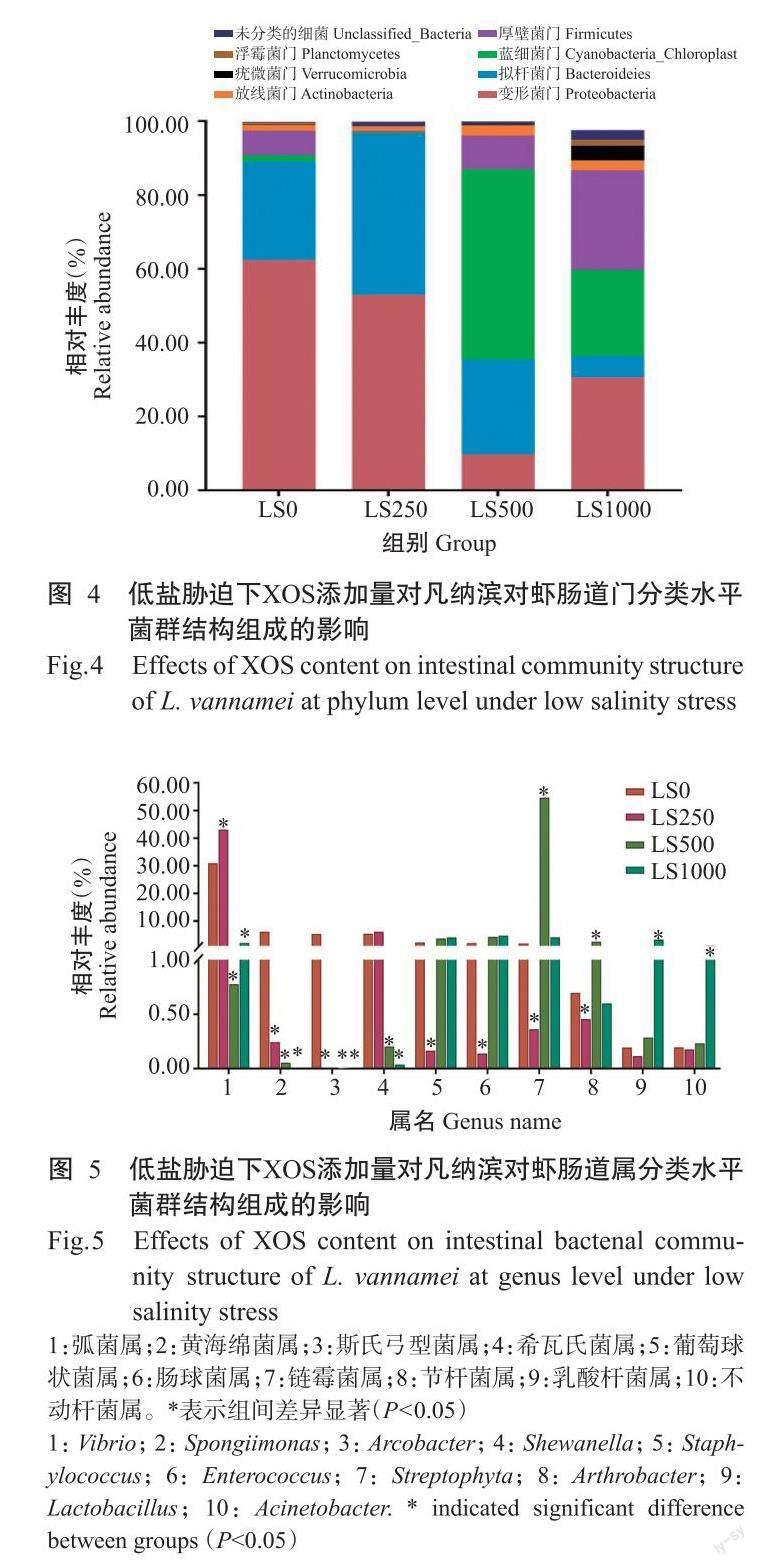
高通量测序分析结果显示,每个样本序列平均长度为420.66 bp。由表3可知,LS1000组凡纳滨对虾肠道菌群的Shannon指数、Chao1指数和ACE指数均显著高于LS0组凡纳滨对虾,Simpson指数显著低于LS0组凡纳滨对虾,而LS250和LS500组凡纳滨对虾的肠道菌群物种多样性及丰富度与LS0组凡纳滨对虾无显著差异。对比各低盐胁迫组的凡纳滨对虾肠道样品发现,在门分类水平下凡纳滨对虾肠道中的优势菌群依次为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidota)、蓝细菌门(Cyanobacteria_Chloroplast)、厚壁菌门(Firmicutes)、放線菌门(Actinobacteriota)、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)。与LS0组相比,LS500和LS1000组凡纳滨对虾肠道变形菌门和拟杆菌门的相对丰度显著降低,LS1000组凡纳滨对虾肠道蓝细菌门、厚壁菌门和疣微菌门的相对丰度显著增高,LS500组凡纳滨对虾肠道蓝细菌门和放线菌门的相对丰度也显著增高(图4)。在属分类水平上,凡纳滨对虾肠道菌群中排名前10的优势菌群分别为弧菌属(Vibrio,占30.92%)、黄海绵菌属(Spongiimonas,占6.04%)、斯氏弓型菌属(Arcobacter,占5.23%)、希瓦氏菌属(Shewanella,占5.21%)、葡萄球状菌属(Staphylococcus,占2.14%)、肠球菌属(Enterococcus,占1.87%)、链霉菌属(Streptophyta,占1.69%)、节杆菌属(Arthrobacter,占0.65%)、乳酸杆菌属(Lactobacillus,占0.17%)和不动杆菌属(Acinetobacter,占0.17%)。与LS0组相比,LS1000组凡纳滨对虾肠道弧菌属、黄海绵菌属、斯氏弓型菌属、希瓦氏菌属的相对丰度显著降低,乳酸杆菌属和不动杆菌属的相对丰度则显著增加(图5)。
3 讨论
3. 1 XOS对凡纳滨对虾生长性能和消化酶的影响
甲壳动物通过食物获取的能量主要用于自身生长、繁殖和基础代谢。据报道,淡化养殖的凡纳滨对虾增重率和存活率较低(Li et al.,2007),可能是由于机体需要更多能量用于调节自身渗透压平衡,而导致其生长速率降低。肠道作为机体的重要消化器官,其分泌的消化酶对各种营养物质的消化、吸收和转化起决定性作用,即消化酶活性反映着机体的消化水平,与机体的生长指数呈正相关(Ziaei-Nejad et al.,2006)。已有研究表明,在饲料中添加XOS,异育银鲫(熊沈学,2005)、凡纳滨对虾(陈晓瑛等,2014)、刺参(Apostichopus japonicas Selenka)(梁超,2011)、草鱼(Zhang et al.,2020)和奥尼罗非鱼(Poolsawat et al.,2021)等生物的生长性能及消化酶活性均有所提高。本研究通过在基础饲料中添加XOS,经过56 d的饲养试验,结果发现凡纳滨对虾的生长性能指标随着XOS添加量的增加而逐渐提高,其中LS1000组凡纳滨对虾的增重率、特定生长率、肥满度、肝体指数及存活率均显著高于LS0组凡纳滨对虾,接近于海水对照组(HS0)凡纳滨对虾。此外,LS1000组凡纳滨对虾肠道AMS活性显著高于LS0组凡纳滨对虾,Trp和LPS活性也随XOS添加量的增加呈上升趋势,说明XOS能有效提高低鹽胁迫下凡纳滨对虾的生长性能。
3. 2 XOS对凡纳滨对虾抗氧化性能和免疫相关基因表达量的影响
低盐胁迫可诱导对虾机体氧化应激而产生过量活性氧(ROS)及免疫力下降等问题(Claus et al.,2016),过量的ROS易导致细胞遗传物质和机体功能损伤(Soleimani et al.,2012)。SOD是生物体内的一种抗氧化金属酶,能分解ROS生成O2和H2O2,避免ROS对机体造成损伤(Fletcher,1986);CAT能促进H2O2分解成H2和自由氧,维持体内活性氧的动态平衡(Viarengo et al.,1991);H2O2易导致机体形成脂质过氧化物而进一步分解生成MDA,因此MDA含量可反映细胞受损及脂质过氧化程度(Zheng et al.,2020)。本研究结果表明,低盐胁迫显著降低了凡纳滨对虾的抗氧化性能,通过在饲料中添加XOS,凡纳滨对虾的抗氧化性能逐渐升高,其中LS500和LS1000组凡纳滨对虾的CAT活性显著高于LS0组凡纳滨对虾,而MDA含量显著低于LS0组凡纳滨对虾。陈晓瑛等(2014)研究发现,在正常盐度条件下,饲料中添加400或600 mg/kg XOS可显著降低凡纳滨幼虾血清MDA含量,有效提高肝胰腺中的抗超氧阴离子自由基(Anti-O2-·)活力。在类似结论还有报道,饲料中添加XOS同样能有效提高异育银鲫(熊沈学,2005)和奥尼罗非鱼(张荣斌等,2011)的抗氧化能力。可见,饲料中添加500或1000 mg/kg XOS能有效提高凡纳滨幼虾在低盐胁迫中应对氧化应激的能力,缓解低盐胁迫导致肝胰腺脂质过氧化造成的机体细胞损伤。
无脊椎动物无特异性免疫系统,先天免疫系统是其防止外源致病菌入侵的重要防线(Li and Xiang,2013)。酚氧化酶系统是无脊椎动物先天免疫防御中的重要组成部分,而proPO基因是酚氧化酶系统中的上游关键基因,活化的proPO最终导致黑色素及有毒活性中间体产生,其中中间体参与无脊椎动物的先天免疫防御(Cerenius et al.,2008;Amparyup et al.,2013;Charoensapsri et al.,2014)。ALF作为抗菌肽在凡纳滨对虾的先天免疫中发挥重要作用,不仅可抵御外来病原体的入侵,还能排解自身的代谢产物(Nam et al.,2018;Zhou et al.,2019)。LZM同样在无脊椎动物免疫防御系统中扮演着重要角色,通过溶解致病菌细胞壁的不溶性黏多糖而促进致病菌分解(Sotelo-mundo et al.,2003)。Toll样受体(TLR)是先天免疫系统中主要的模式识别受体(PRR)之一(Akira et al.,2006),可帮助细胞识别外源或内源遗传物质,从而启动机体的免疫反应,调控下游干扰素分泌,促进促炎细胞因子产生,抵抗细菌或病毒的侵染(Takeshita and Ishii,2008)。本研究结果表明,低盐胁迫降低了凡纳滨对虾的免疫能力,通过在饲料中添加XOS,其免疫相关基因的相对表达量逐渐提高,其中LS1000组凡纳滨对虾鳃组织proPO、ALF、LZM、TLR1、TLR2和TLR3基因的相对表达量显著高于海水对照组(HS0)。有研究表明,饲料中添加8.0或10.0 mg/g低聚果糖(Fructo oligosaccharide,FOS)可提高克氏原鳌虾(Procambarus clarkii)的proPO基因相对表达量(Dong and Wang,2013);饲料中添加5 mg/g菊粉和甘露寡糖(Mannan oligosaccharide,MOS)可显著提高凡纳滨对虾的proPO、ALF和Toll基因相对表达量(Li et al.,2018)。此外,Cabrera-Stevens等(2022)通过高通量测序发现,在饲料中添加0.02 g/kg姜黄和玛咖也可提高凡纳滨对虾Toll基因相对表达量。可见,在饲料中添加1000 mg/kg XOS能有效提高凡纳滨对虾在低盐胁迫下的免疫能力,降低病原体侵染风险,最终维持对虾在低盐胁迫下的健康状态。
3. 3 XOS对凡纳滨对虾肠道菌群多样性及组成结构的影响
宿主肠道菌群多样性易受周围环境条件、健康状况及食物种类等因素的影响,而肠道菌群结构又影响宿主的能量代谢和免疫应答等功能(Claus et al.,2016;Hou et al.,2018;王飞飞等,2022)。由于凡纳滨对虾缺乏特异性免疫,拥有较高的Alpha多样性说明机体具有对外界病原菌的高免疫能力及环境变化的高适应性(Xiong et al.,2018)。在本研究中,LS1000组凡纳滨对虾肠道菌群Alpha多样性显著高于LS0组凡纳滨对虾,即在饲料中添加1000 mg/kg XOS能有效提高凡纳滨对虾肠道菌群物种多样性及丰富度,在异育银鲫(谢芳等,2020)的相关研究中也得出相似结论。低盐胁迫后凡纳滨对虾肠道菌群结构发生显著变化,LS500和LS1000组凡纳滨对虾肠道中的变形菌门相对丰度显著低于LS0组凡纳滨对虾,而厚壁菌门和疣微菌门相对丰度显著高于LS0组凡纳滨对虾。已有研究表明,变形菌门相对丰度的增加通常出现在生长缓慢和染病的凡纳滨对虾肠道中,而疣微菌门和厚壁菌门能降解肠道中不易消化的多糖并提高肠道结合力(黄晓飞和陆颖理,2014)。在水产养殖行业中,弧菌属的部分细菌是造成疾病的致病菌,而乳酸杆菌属可促进虾蟹新陈代谢,为机体提供必需氨基酸及各种维生素,改善消化酶活性,进而促进其生长(王国霞等,2010);乳酸杆菌还具有免疫调节作用,包括促进细胞分裂、促进抗体产生及活化巨噬细胞等功能(章文明等,2012)。本研究结果显示,随着XOS添加量的增加,凡纳滨对虾肠道益生菌的相对丰度逐渐升高,而致病菌相对丰度显著降低,其中LS1000组凡纳滨对虾肠道的乳酸杆菌属相对丰度显著升高、弧菌属相对丰度显著下降,与胡晓伟等(2018)的研究结果相似。陈晓瑛(2012)研究发现,在饲料中添加600 mg/kg XOS,凡纳滨对虾肠道细菌种类总数和双歧杆菌数量显著高于对照组,弧菌数量则显著降低。综上所述,XOS可抑制凡纳滨对虾淡化养殖过程中致病菌的生长,同时刺激益生菌生长,进而提高宿主免疫能力。
4 结论
低盐胁迫下在基础饲料中添加500~1000 mg/kg XOS,可显著提高凡纳滨对虾生长速率、抗氧化性能、免疫相關基因表达及改善肠道菌群组成结构,有效提高对虾在低盐胁迫下的养殖效果,即XOS可作为凡纳滨对虾淡化养殖饲料添加剂进一步开发应用。
参考文献:
陈俭,代冰涛,王红明,宋守钢,谭北平,章双. 2022. 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼生长性能、免疫指标、转录组及肠道菌群的影响[J]. 南方农业学报,53(5):1434-1447. [Chen J,Dai B T,Wang H M,Song S G,Tan B P,Zhang S. 2022. Effects of adding β-glucan to feed on the growth performance, immune indexes, transcriptome and intestinal flora of Epinephelus fuscoguttatus ♀×Epinephelus lanceolatus [♂][J]. Journal of Southern Agriculture,53(5):1434-1447.] doi:10.3969/j.issn.2095-1191.2022. 05.026.
陈晓瑛,曹俊明,黄燕华,王国霞,莫文艳,陈冰,赵红霞,付晶晶. 2014. 饲料中添加低聚木糖对凡纳滨对虾幼虾生长性能、非特异性免疫力、抗氧化功能及抗对虾白斑综合征病毒能力的影响[J]. 动物营养学报,26(8):2379-2407. [Chen X Y,Cao J M,Huang Y H,Wang G X,Mo W Y,Chen B,Zhao H X,Fu J J. 2014. Xylo-oligosaccharides supplementation affects growth performance, non-specific immunity, antioxidant function and anti-white spot syndrome virus capacity of juvenile Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition,26(8):2379-2407.] doi:10.3969/j.issn.1006-267x.2014.08.047.
陈晓瑛,王国霞,孙育平,陈冰,莫文艳,赵红霞,曹俊明,黄燕华. 2018. 饲料中添加低聚木糖对凡纳滨对虾幼虾消化酶活力、肠道形态及细菌数量的影响[J]. 动物营养学报,30(4):1522-1529. [Chen X Y,Wang G X,Sun Y P,Chen B,Mo W Y,Zhao H X,Cao J M,Huang Y H. 2018. Effects of dietary xylo-oligosaccharides on digestive enzymes activities,intestinal morphology and bacteria numbers of juvenile Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition,30(4):1522-1529.] doi:10. 3969/j.issn.1006-267x.2018.04.037.
陈晓瑛. 2012. 低聚木糖对凡纳滨对虾(Litopenaeus vannamei)生长、免疫功能和肠道菌群的影响[D]. 广州:华南农业大学. [Chen X Y. 2012. Effects of xylose oligosaccharides on growth, immune function and intestinal microbiota of Litopenaeus vannamei[D]. Guangzhou:South China Agricultural University.] doi:10.7666/d.Y2246243.
郝贺,钟翠红,李欣泽,王海英,武亚南,王风申,刘冠慧,石玉祥,张永英. 2021. 发酵中药对热应激肉鸡肠道菌群结构的影响[J]. 河南农业科学,50(9):135-142. [Hao H,Zhong C H,Li X Z,Wang H Y,Wu Y N,Wang F S,Liu G H,Shi Y X, Zhang Y Y. 2021. Effect of fermented traditional Chinese medicine on intestinal flora structure of broilers under heat stress[J]. Journal of Henan Agricultural Sciences,50(9):135-142.] doi:10.15933/j.cnki. 1004-3268.2021.09.016.
胡晓伟,上官静波,黎中宝,杨敏,徐安乐. 2018. 低聚木糖对花鲈幼鱼生长性能,血清生化和免疫指标及肠道菌群组成的影响[J]. 动物营养学报,30(2):734-742. [Hu X W,Shangguan J B,Li Z B,Yang M,Xu A L. 2018. Effects of xylooligosaccharide on growth performance,serum biochemical and immune indices and intestinal microflora composition of juvenile Japanese seabass (Lateolabrax maculatus)[J]. Chinese Journal of Animal Nutrition,30(2):734-742.] doi:10.3969/j.issn.1006-267x.2018.02.039.
胡毅. 2007. 凡纳滨对虾饲料配方优化及几种饲料添加剂的应用[D]. 青岛:中国海洋大学. [Hu Y. 2007. Optimum feed formula selection and some feed additive application on juvenile Litopenaeus vannamei[D]. Qingdao:Ocean University of China.] doi:10.7666/d.y1112245.
黄晓飞,陆颖理. 2014. 肠道菌群与肥胖关系的研究进展[J]. 医学综述,20(1):82-84. [Huang X F,Lu Y L. 2014. Research progress of the relationship between gut microbiota and obesity[J]. Medical Recapitulate,20(1):82-84.] doi:10.3969/j.issn.1006-2084.2014.01.029.
梁超. 2011. 饲料中添加二甲酸钾、低聚木糖和菊粉對刺参的生长、免疫和抗灿烂弧菌感染能力的影响[D]. 青岛:中国海洋大学. [Liang C. 2011. Effects of dietary potassium diformate, xylo-oligosaccharides and inulin on growth, immune responses and resistance against V. splendidus of Sea Cucumber Apostichopus japonicas Selenka[D]. Qingdao:Ocean University of China.] doi:10.7666/d.y1926685.
庞丽姣. 2011. 低聚木糖对草鱼非特异性免疫功能及免疫相关基因表达的影响[D]. 武汉:华中农业大学. [Pang L J. 2011. Effects of xylooligosaccharide on the non-specific immunity function and the expression of immune related genes on Ctenopharyngodon idellus[D]. Wuhan:Huazhong Agricultural University.] doi:10.7666/d.y2004171.
齐志涛,张启焕,仇明,封功能,吕富,王爱民. 2011. 低聚木糖对斑点叉尾鮰生长及血液指标的影响[J]. 水产科学,30(12):785-788. [Qi Z T,Zhang Q H,Qiu M,Feng G N,Lü F,Wang A M. 2011. Effect of xylooligosaccharides on growth performance and blood parameters in Ictalu-rus punctatus[J]. Fisheries Science,30(12):785-788.] doi:10.3969/j.issn.1003-1111.2011.12.014.
强俊,王辉,李瑞伟,彭俊. 2009. 低聚木糖对奥尼罗非鱼幼鱼生长、体成分和消化酶活力的影响[J]. 淡水渔业,39(6):63-68. [Qiang J,Wang H,Li R W,Peng J. 2009. Effects of xylo-oligosaccharides on growth,body composition and digestive enzyme activities of juvenile tilapia (Oreochromis niloticus×O. aureus)[J]. Freshwater Fishe-ries,39(6):63-68.] doi:10.3969/j.issn.1000-6907.2009. 06.011.
舒迎霜,贺濛初,桂雪儿,夏晓冬,冯士彬,李玉,王希春,吴金节. 2020. 黄芪多糖对犬盲肠菌群的影响[J]. 甘肃农业大学学报,55(2):1-8. [Shu Y S,He M C,Gui X E,Xia X D,Feng S B,Li Y,Wang X C,Wu J J. 2020. Effect of Astragalus polysaccharide on cecal flora in canines[J]. Journal of Gansu Agricultural University,55(2):1-8.] doi:10.13432/j.cnki.jgsau.2020.02.001.
汤上上,韩凤禄,周利,刘世誉,徐畅,陈立侨,李二超. 2021. 甘露寡糖对低盐胁迫下凡纳滨对虾生长、健康及肠道菌群的影响[J]. 水产学报,45(12):2044-2060. [Tang S S,Han F L,Zhou L,Liu S Y,Xu C,Chen L Q,Li E C. 2021. Effects of dietary mannan oligosaccharide supplementation on growth,health and intestinal microbiota of Pacific white shrimp Litopenaeus vannamei at low salinity[J]. Journal of Fisheries of China,45(12):2044-2060.] doi:10.11964/jfc.20210312698.
王飞飞,王夏雯,金倩,张智慧,王泽平,田胜营,王信海. 2022. 温度对克氏原螯虾肠道菌群结构的影响[J]. 江苏农业学报,38(1):157-164. [Wang F F,Wang X W,Jin Q,Zhang Z H,Wang Z P,Tian S Y,Wang X H. 2022. Effects of temperature on gut microbiota structure of Procambarus clarkii[J]. Jiangsu Journal of Agricultural Scien-ces,38(1):157-164.] doi:10.3969/j.issn.1000-4440.2022. 01.019.
王国霞,黄燕华,周晔,董尚智,黄文庆,严琴. 2010. 乳酸菌对凡纳滨对虾幼虾生长性能、消化酶活性和非特异性免疫的影响[J]. 动物营养学报,22(1):228-234. [Wang G X,Huang Y H,Zhou Y,Dong S Z,Huang W Q,Yan Q. 2010. Effects of lactobacillus on growth performance,digestive enzyme activities and non-specific immunity of Litopenaeus vannamei[J]. Chinese Journal of Animal Nutrition,22(1):228-234.] doi:10.3969/j.issn.1006-267x. 2010.01.035.
王兴强,马甡,董双林. 2004. 凡纳滨对虾生物学及养殖生态学研究进展[J]. 海洋湖沼通报,(4):94-100. [Wang X Q,Ma S,Dong S L. 2004. Studies on the biology and cultural ecology of Litopenaeus vannamei: A review[J]. Transaction of Oceanology and Limnology,(4):94-100.] doi:10.3969/j.issn.1003-6482.2004.04.016.
謝芳,张海波,幸清凤,黎力之,关玮琨,郭冬生,刘小高. 2020. 低聚木糖对动物肠道屏障的影响及其在动物生产中应用的研究进展[J]. 中国畜牧杂志,56(10):7-12. [Xie F,Zhang H B,Xing Q F,Li L Z,Guan W K,Guo D S,Liu X G. 2020. Advances in effect of xylo-oligosaccharide mediated intestinal flora and its metabolites on animal intestinal barrier[J]. Chinese Journal of Animal Science,56(10):7-12.] doi:10.19556/j.0258-7033.2020 0516-06.
熊沈学. 2005. 饲料中添加低聚木糖对异育银鲫增重率、消化酶活性及免疫性能的影响[D]. 南京:南京农业大学. [Xiong S X. 2005. Effects of xylo-oligosaccharides in diets on the weight gain ratio,digestive enzyme activity and immune performance of Allogynogenetic crucian carp[D]. Nanjing: Nanjing Agricultural University.] doi:10. 7666/d.Y748884.
袁钟宇,张石蕊,张建社. 2008. 寡糖在水产养殖中的应用[J]. 饲料研究,(8):65-68. [Yuan Z Y,Zhang S R,Zhang J S. 2008. Application of oligosaccharides in aquaculture[J]. Feed Research,(8):65-68.] doi:10.13557/j.cnki.issn1002-2813.2008.08.022.
张荣斌,曹俊明,黄燕华,王国霞,陈晓瑛,严晶,周婷婷,孙智武. 2011. 饲料中添加低聚木糖对奥尼罗非鱼生长性能和血清生化指标的影响[J]. 动物营养学报,23(11):2000-2008. [Zhang R B,Cao J M,Huang Y H,Wang G X,Chen X Y,Yan J,Zhou T T,Sun Z W. 2011. Effects of dietary xylooligosaccharides on growth performance and serum biochemical indices of tilapia (Oreochromis niloticus×O. aureus)[J]. Chinese Journal of Animal Nutrition,23(11):2000-2008.] doi:10.3969/j.issn.1006-267x. 2011.11.022.
章文明,汪海峰,刘建新. 2012. 乳酸杆菌益生作用机制的研究进展[J]. 动物营养学报,24(3):389-396. [Zhang W M,Wang H F, Liu J X. 2012. Mechanism of action of probiotic function of Lactobacilli[J]. Chinese Journal of Animal Nutrition,24(3):389-396.] doi:10.3969/j.issn. 1006-267x.2012.03.001.
Akira S,Uematsu S,Takeuchi O. 2006. Pathogen recognition and innate immunity[J]. Cell,124(4):783-801. doi:10. 1016/j.cell.2006.02.015.
Amparyup P,Charoensapsri W,Tassanakajon A. 2013. Prophenoloxidase system and its role in shrimp immune responses against major pathogens[J]. Fish & Shellfish Immunology,34(4):990-1001. doi:10.1016/j.fsi.2012. 08.019.
Cabrera-Stevens M J,Sánchez-Paz A,Mendoza-Cano F,Es-cobedo-Fregoso C,Encinas-García T,Elizondo-González R,Pe?a-Rodríguez A. 2022. Transcriptome analysis reveals differential gene expression associated with white spot syndrome virus resistance in the shrimp Litopenaeus vannamei fed on functional diets[J]. Aquaculture,547:737434. doi:10.1016/j.aquaculture.2021.737434.
Cerenius L,Lee B L,S?derhall K. 2008. The proPO-system:Pros and cons for its role in invertebrate immunity[J]. Trends in Immunology,29(6):263-271. doi:10.1016/j.it. 2008.02.009.
Charoensapsri W,Amparyup P,Suriyachan C,Tassanakajon A. 2014. Melanization reaction products of shrimp display antimicrobial properties against their major bacterial and fungal pathogens[J]. Developmental & Comparative Immunology,47(1):150-159. doi:10.1016/j.dci.2014.07.010.
Claus S P,Guillou H,Ellero-Simatos S. 2016. Erratum:The gut microbiota:A major player in the toxicity of environmental pollutants?[J]. NPJ Biofilms and Microbiomes,(2):16003. doi:10.1038/npjbiofilms.2017.1.
Dong C H,Wang J. 2013. Immunostimulatory effects of dietary fructooligosaccharides on red swamp crayfish,Procambarus clarkii (Girard)[J]. Aquaculture Research,44(9):1416-1424. doi:10.1111/j.1365-2109.2012.03146.x.
Fletcher T C. 1986. Modulation of nonspecific host defenses in fish[J]. Veterinary Immunology and Immunopathology,12(1-4):59-67. doi:10.1016/0165-2427(86)90110-8.
Hou D W,Huang Z J,Zeng S Z,Liu J,Wei D D,Deng X S,Weng S P,Yan Q Y,He J G. 2018. Intestinal bacterial signatures of white feces syndrome in shrimp[J]. Applied Microbiology and Biotechnology,102(8):3701-3709. doi:10.1007/s00253-018-8855-2.
Li E C,Chen L Q,Zeng C,Chen X M,Yu N,Lai Q M,Qin J G. 2007. Growth,body composition, respiration and ambient ammonia nitrogen tolerance of the juvenile white shrimp,Litopenaeus vannamei,at different salinities[J]. Aquaculture,265(1-4):385-390. doi:10.1016/j.aquaculture.2007.02.018.
Li E C,Wang X D,Chen K,Xu C,Qin J G,Chen L Q. 2017. Physiological change and nutritional requirement of Pacific white shrimp Litopenaeus vannamei at low salinity[J]. Reviews in Aquaculture,9(1):57-75. doi:10.1111/raq.12104.
Li F H,Xiang J H. 2013. Signaling pathways regulating innate immune responses in shrimp[J]. Fish & Shellfish Immunology,34(4):973-980. doi:10.1016/j.fsi.2012. 08.023.
Li Y,Liu H,Dai X L,Li J J,Ding F J. 2018. Effects of die-tary inulin and mannan oligosaccharide on immune rela-ted genes expression and disease resistance of Pacific white shrimp,Litopenaeus vannamei[J]. Fish & Shellfish Immunology,76:78-92. doi:10.1016/j.fsi.2018.02.034.
Nam B H,Park E H,Shin E H,Kim Y O,Kim D G,Kong H J,Park J Y,Seo J K. 2018. Development of novel antimicrobial peptides derived from anti-lipopolysaccharide factor of the swimming crab,Portunus trituberculatus[J]. Fish & Shellfish Immunology,84:664-672. doi:10.1016/j.fsi.2018.10.031.
Pinheiro I,Carneiro R F S,do Nascimento Vieira F,Gonzaga L V,Fett R,de Oliveira Costa A C,Magallón-Barajas F J,Seiffert W Q. 2019. Aquaponic production of Sarcocornia ambigua and Pacific white shrimp in biofloc system at different salinities[J]. Aquaculture,519:734918. doi:10. 1016/j.aquaculture.2019.734918.
Poolsawat L,Li X Q,Xu X Y,Rahman M M,Boonpeng N,Leng X J. 2021. Dietary xylo-oligosaccharide improved growth, nutrient utilization,gut microbiota and disease resistance of tilapia (Oreochromis niloticus×O. aureus)[J]. Animal Feed Science and Technology,275(1):114872. doi:10.1016/j.anifeedsci.2021.114872.
Soleimani N,Hoseinifar S H,Merrifield D L,Barati M,Abadi Z H. 2012. Dietary supplementation of fructooligosaccharide (FOS) improves the innate immune response,stress resistance,digestive enzyme activities and growth performance of Caspian roach (Rutilus rutilus) fry[J]. Fish & Shellfish Immunology,32(2):316-321. doi:10.1016/j.fsi. 2011.11.023.
Sotelo-Mundo R R,Islas-Osuna M A,de-la-Re-Vega E,Hernández-López J,Vargas-Albores F,Yepiz-Plascencia G. 2003. cDNA cloning of the lysozyme of the white shrimp Penaeus vannamei[J]. Fish & Shellfish Immuno-logy,15(4):325-331. doi:10.1016/s1050-4648(02)00176-6.
Takeshita F,Ishii K J. 2008. Intracellular DNA sensors in immunity[J]. Current Opinion in Immunology,20(4):383-388. doi:10.1016/j.coi.2008.05.009.
Viarengo A,Canesi L,Pertica M,Livingstone D R. 1991. Seasonal variations in the antioxidant defence systems and lipid peroxidation of the digestive gland of mussels[J]. Comparative Biochemistry and Physiology. Part C:Comparative Pharmacology,100(1-2):187-190. doi:10.1016/0742-8413(91)90151-i.
Xiong J B,Dai W F,Qiu Q F,Zhu J Y,Yang W,Li C H. 2018. Response of host-bacterial colonization in shrimp to developmental stage, environment and disease[J]. Molecular Ecology,27(18):3686-3699. doi:10.1111/mec. 14822.
Xu C,Li E C,Liu Y,Wang X D,Qin J G,Chen L Q. 2017. Comparative proteome analysis of the hepatopancreas from the Pacific white shrimp Litopenaeus vannamei under long-term low salinity stress[J]. Journal of Proteomics,162:1-10. doi:10.1016/j.jprot.2017.04.013.
Zhang Z H,Chen M,Xie S W,Chen X Q,Liu Y J,Tian L X,Niu J. 2020. Effects of dietary xylo-oligosaccharide on growth performance,enzyme activity and immunity of juvenile grass carp,Ctenopharyngodon idellus[J]. Aquaculture Reports,18:100519. doi:10.1016/j.aqrep.2020. 100519.
Zheng L,Xie S W,Zhuang Z X,Liu Y J,Tian L X,Niu J. 2020. Effects of yeast and yeast extract on growth performance, antioxidant ability and intestinal microbiota of juvenile Pacific white shrimp (Litopenaeus vannamei)[J]. Aquaculture,530:735941. doi:10.1016/j.aquaculture.2020. 735941.
Zhou L,Li G Q,Jiao Y,Huang D Q,Li A G,Chen H R,Liu Y,Li S M,Li H,Wang C G. 2019. Molecular and antimicrobial characterization of a group G anti-lipopolysaccharide factor (ALF) from Penaeus monodon[J]. Fish & Shellfish Immunology,94:149-156. doi:10.1016/j.fsi. 2019.08.066.
Ziaei-Nejad S,Rezaei M H,Takami G A,Lovett D L,Mirvaghefi A R,Shakouri M. 2006. The effect of Bacillus spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus[J]. Aquaculture,252(2-4):516-524. doi:10.1016/j.aquaculture.2005.07.021.
(責任编辑 兰宗宝)
