GDM孕妇孕期胰岛功能相关指标与产后糖耐量异常的相关性*
2023-07-21怀莹莹
怀莹莹,褚 茜
(江苏大学附属昆山市第一人民医院妇产科,昆山 215300)
妊娠期糖尿病(gestational diabetes mellitus,GDM)使得3%~13%的妊娠复杂化,属于高危妊娠之一,是孕妇妊娠期高血压疾病及新生儿并发症的主要危险因素[1],增加了远期心血管疾病的风险[2]。约有1/3的GDM孕妇在产后15年内被诊断为2型糖尿病(diabetes mellitus type 2,T2DM)[3],而亚洲GDM女性产后T2DM发病率最高,达46‰/年[4]。GDM女性罹患T2DM的可能性是非GDM妊娠女性的7~10倍[5],GDM是未来糖尿病发生的重要预测因素之一[6]。识别有产后糖代谢受损风险的女性对于早期启动有效的干预策略至关重要,如增加体力活动、健康的营养建议、减轻体重、坚持母乳喂养,这可延缓或防止产后从GDM发展为T2DM或其他代谢紊乱[7]。本研究通过对GDM孕妇进行产后糖耐量检查,探讨产后糖尿病前期的危险因素,为临床早期预测产后糖尿病的发生并采取有效干预措施提供依据。
1 资料与方法
1.1 研究对象 回顾分析2020年1月至2020年12月于昆山市第一人民医院定期产检并分娩的单胎妊娠GDM孕妇210例。入选标准:均于孕24~28周进行75g 糖耐量试验(oral glucose tolerance test,OGTT)试验诊断为GDM;既往无基础疾病及内分泌代谢疾病史;无恶性肿瘤病史;无吸烟、嗜酒等不良嗜好;分娩孕周为≥28周且<42周;近期无任何药物服用史。
1.2 研究方法 详细记录纳入对象的妊娠年龄、孕前体质量指数(body mass index,BMI)、孕产次、辅助生殖技术助孕情况、孕期胰岛素使用情况、分娩方式、妊娠并发症、分娩结局等一般资料,以及妊娠24~28周的75g OGTT试验、糖化血红蛋白(glycosylated hemoglobin type A1c,HbA1c)、空腹胰岛素(fasting insulin,FINS)检测结果。使用稳态模型法计算胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)和胰岛β细胞功能指数(HOMA-β)。患者均于产后6~12周门诊进行2h糖耐量试验。
1.3 诊断标准 依据2011年美国糖尿病协会(ADA)的GDM诊断指南:孕24~28周行OGTT试验,分别抽取空腹、服糖后1h、服糖后2h的静脉血送检,正常值上限分别为5.1、10.0、8.5mmol/L。其中1项达到或超过正常值上限即诊断为GDM。根据产后血糖情况分为糖耐量正常组和糖耐量异常组,其中糖耐量异常组包括空腹血糖受损(空腹血糖>6.1mmol/L且餐后2h血糖<7.8mmol/L)、糖耐量减低(空腹血糖<6.1mmol/L且餐后2h血糖>7.8mmol/L、<11.1mmol/L)及糖尿病(空腹血糖≥7.0mmol/L或(和)餐后2h血糖≥11.1mmol/L)。HOMA-β=20*FINS(mU/L)/[FPG(mmol/L)-3.5];HOMA-IR=FINS(mIU/L)*FPG(mmol/L)/22.5。HOMA-β主要用于反映机体的胰岛β细胞功能,HOMA-IR常用于评价机体胰岛素抵抗水平。

2 结 果
2.1 两组妊娠资料比较 210例GDM孕妇中,155例(73.81%)产后糖耐量正常,55例(26.19%)糖耐量异常,其中糖尿病8例(3.81%),糖尿病前期(包括空腹血糖受损和糖耐量减低)47例(22.38%)。两组的妊娠年龄、产次比较,差异无统计学意义(P>0.05)。糖耐量异常组的孕前BMI、辅助生殖技术助孕、孕期胰岛素使用率、孕中期OGTT异常数、孕中期HOMA-IR、孕中期HOMA-β及孕中期HbA1c均显著高于糖耐量正常组,差异有统计学意义(P<0.05),见表1。
2.2 两组妊娠结局比较 糖耐量异常组的巨大儿、妊娠期高血压疾病发生率均显著高于糖耐量正常组,差异有统计学意义(P<0.05)。两组的胎膜早破、羊水量异常、产后出血、早产发生率及剖宫产率比较,差异无统计学意义(P>0.05),见表2。
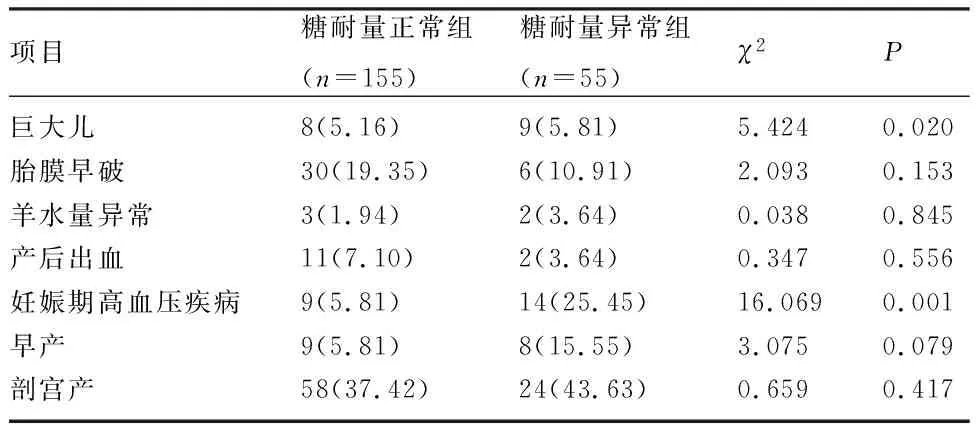
表2 两组妊娠结局比较[n(%)]
2.3 产后糖耐量异常高危因素的logistic回归分析 多因素logistic回归分析显示,辅助生殖技术助孕、妊娠期期间发生妊娠期高血压疾病、OGTT异常数量多、HOMA-IR、HOMA-β均是GDM孕妇产后糖耐量异常的独立危险因素。见表3。
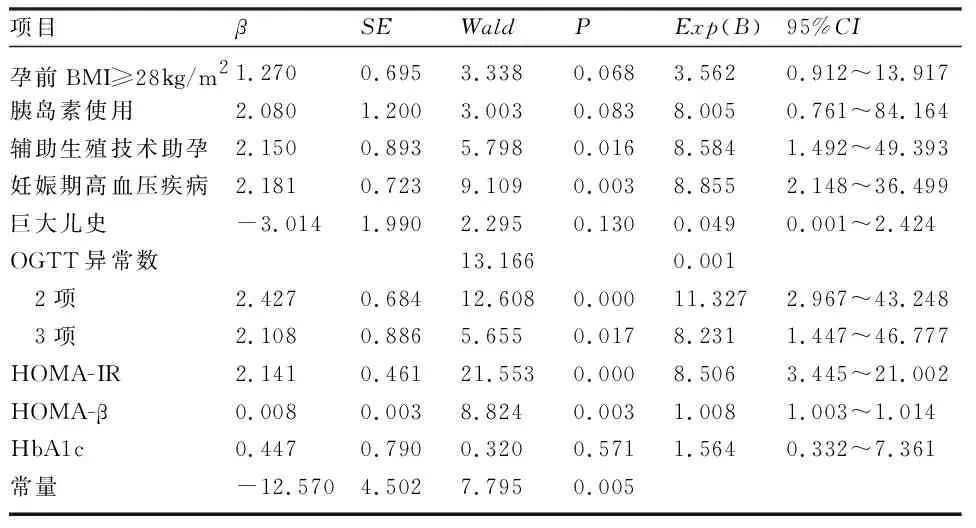
表3 GDM孕妇产后糖耐量异常危险因素的logistic回归分析
2.4 HOMA-IR、HOMA-β及两者联合预测GDM孕妇产后糖耐量异常的ROC曲线 HOMA-IR、HOMA-β及两者联合预测GDM孕妇产后糖耐量异常的ROC曲线下面积分别为0.892、0.724和0.914。见图1、表4。
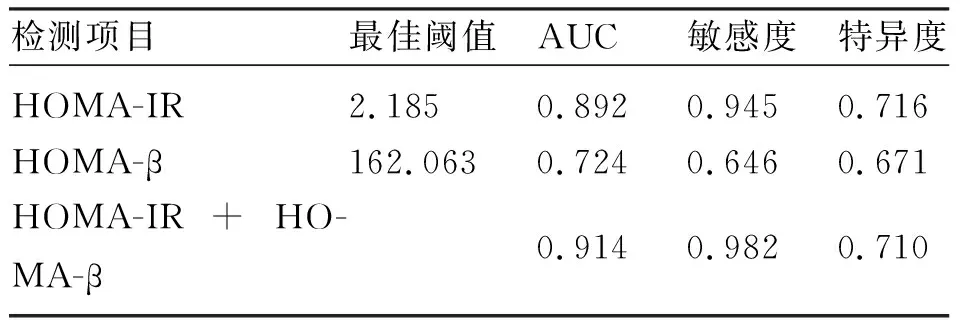
表4 HOMA-IR、HOMA-β及两者联合预测GDM孕妇产后糖尿病前期的曲线下面积
3 讨 论
GDM是指妊娠前糖代谢正常而在妊娠期出现的糖代谢紊乱,产后糖代谢通常会恢复正常,胰岛素抵抗(insulin resistance,IR)和胰岛β细胞功能下降是其发病机制。机体对胰岛素的敏感性下降,对胰岛素产生分解、拮抗作用,使得胰岛素活性下降。研究指出[8],GDM患者在妊娠中晚期需通过增加胰岛素的分泌来代偿IR对胰岛β细胞的压力,加速胰岛功能进一步受损,可导致产后糖尿病发生。本研究发现,210例GDM孕妇产后糖耐量异常55例,占26.19%,其中诊断为糖尿病者8例,占3.81%。
先前使用非IADPSG标准的研究报告,与产后糖尿病前期和(或)糖尿病显著相关的危险因素包括糖尿病家族史、GDM诊断时孕龄、糖化血红蛋白值、是否初产、高血压、妊娠期胰岛素使用和孕前BMI[9-10]。本研究中,产后糖耐量正常组和糖耐量异常组的妊娠期胰岛素使用、孕前BMI、孕中期HbA1c、合并妊娠期高血压疾病,以及辅助生殖技术助孕、孕期OGTT异常数及孕中期HOMA-IR、HOMA-β比较,差异均有统计意义,但年龄和产次无显著差异。很多学者认为[11-12],OGTT餐后血糖在预测GDM孕妇发生产后糖代谢紊乱的效能上具有更高的OR值。本研究结果显示,OGTT异常数达2项时,预测GDM孕妇发生产后糖耐量异常的OR值为11.327,OGTT异常数达3项时,OR值为8.231。表明GDM孕妇孕期OGTT的异常数量与其产后发生糖耐量异常明确相关。
研究指出[13],GDM所产生的IR和胰岛β细胞受损可能在产后一段时间内持续存在。本研究结果显示,孕中期HOMA-IR及HOMA-β均是GDM孕妇发生产后糖耐量异常的独立危险因素,孕中期HOMA-IR、HOMA-β单独应用时,AUC分别为0.892、0.724,两者联合诊断时,AUC达到0.914,敏感度为98.2%,特异度为71.0%,提示两者联合预测的价值更高。
研究指出[14],产后平均随访3.53年时,既往患有GDM女性患糖尿病的风险是未患GDM女性的76.1倍,患糖尿病前期的风险是未患GDM女性的25.4倍;平均随访时间延长至4.40年时,有GDM病史妇女患糖尿病的风险是无GDM病史女性的13.0倍,患糖尿病前期的风险是无GDM病史女性的2.15倍。目前研究表明[15],与未患GDM女性相比,患有GDM的妇女在产后前3~4年患产后糖尿病的风险最高。这与最近一项荟萃分析得出的趋势相似,即患有GDM女性的产后糖尿病风险在前3~6年达到峰值。目前,美国糖尿病协会和美国妇产科医师协会[16]建议,所有GDM妇女进行产后血糖筛查试验(PGST),即产后4~12周进行OGTT来筛查糖尿病前期和糖尿病,但该试验的执行率不太理想。T2DM的发病年龄正在降低,因此及早识别高危人群很重要,其中一个重要高风险群体就是GDM孕妇[17]。本文在孕中期OGTT试验时,增加了空腹胰岛素检测,从而进一步计算HOMA-IR及HOMA-β,通过这些指标预测孕妇远期发生糖耐量异常的风险,具有一定的临床意义。产后阶段是实施干预措施的关键时期,空腹血糖受损和糖耐量减低通常被认为是存在于正常糖耐量和显性糖尿病之间的糖代谢紊乱的中间状态,可通过采取有效干预,包括增加母乳喂养的频率和强度,控制产后体重及适当运动,给予饮食、营养的指导,让GDM这部分人群远期远离糖尿病成为可能。
综上所述,GDM孕妇的一些临床特征及孕期相关指标对其产后发生糖耐量异常具有一定的预测价值,通过这些指标,有助于临床医生识别产后糖耐量异常的高危人群,并积极给予科学饮食的指导和生活方式的干预,减少远期糖耐量异常的发生。
