ATP10a甲基化检测对高危型HPV感染患者的分流作用*
2023-07-21陈思思姜晓丹金海红宗梦麟王慧芳孙咏梅
陈思思,姜晓丹,金海红**,宗梦麟,王慧芳,孙咏梅,龚 姗,韩 琨
(1.秦皇岛市第一医院,秦皇岛 066000;2.河北北方学院,张家口 075000;3.河北医科大学,石家庄 050000)
高危型人乳头瘤病毒(high risk human papilloma virus,HR-HPV)持续感染是宫颈鳞状上皮内病变(squamous intraepithelial lesion,SIL)、宫颈癌发生的明确病因。采取规范的筛查策略可发现大部分的SIL,对SIL及时进行干预处理可阻断其进一步发展为宫颈癌。现阶段广泛应用于临床的初筛手段包括HR-HPV检测、细胞学检查或二者联合。研究表明,HR-HPV检测在检出HSIL及以上病变中有较高的敏感性和阴性预测值,可能比细胞学检测更适合作为初筛手段[1]。然而值得注意的是,HR-HPV检测虽然可检出不少HR-HPV阳性患者,但其中仅有一部分被诊断SIL甚至宫颈癌,这与该方法存在一定的局限性有关[2]:(1)一次特定HPV基因型检测不能区分患者为暂时性感染还是持续性感染;(2)HR-HPV检测阳性提示宫颈癌发生风险增加,不提示是否发生病变。为了减少因HR-HPV检测方法自身局限性所带来的过度诊疗,常需对初筛阳性患者进一步分流,国内外专家共识首推细胞学检查和HPV16/18分型检测,其中HPV16/18分型检测不适用于HR-HPV(除HP16/18分型)阳性患者分流,而细胞学检查敏感性较低且对病理水平要求高、可重复性差,难以大范围普及。近年来随着对HR-HPV感染引起的宫颈癌相关机制研究的深入,许多新兴分流手段逐渐涌出,如HR-HPV载量检测、p16/Ki67细胞学双染、DNA甲基化检测、微小RNA(miRNA)检测、免疫微环境评估。其中DNA甲基化检测具有很好的应用前景,可用于宫颈癌初筛异常的分流、治疗后随访以及远期预后监测[3-5]。最近一项纳入全基因组甲基化测序的研究发现,ATP10a甲基化水平与宫颈疾病进展显著相关[6]。本研究旨在评估ATP10a甲基化检测在HR-HPV感染患者中检出子宫颈高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)及宫颈鳞癌(squamous cell carcinoma,SCC)的效能。
1 资料与方法
1.1 资料来源 收集2022年2月2022年9日于秦皇岛市第一医院妇科门诊行宫颈癌筛查且HR-HPV检测提示阳性(包括HPV16、18,其他高危型)女性的宫颈脱落细胞标本,并于4℃冰箱内储存直至DNA提取用于甲基化检测。同时收集患者资料:年龄、TCT结果、阴道镜检查所见及活检病理结果。纳入标准:有性生活,未怀孕;子宫完整且无宫颈疾病治疗史;无其他癌症治疗史;有阴道镜活检病理结果。排除标准:既往或正在接种HPV疫苗;既往患生殖器疣;处于免疫低下或抑制状态。本研究经医院医学伦理学委员会批准,患者知情同意。
1.2 实验方法
1.2.1 DNA提取及亚硫酸氢盐修饰 按DNA提取试剂盒(北京天根生物有限公司产)说明书操作提取宫颈脱落细胞学标本中的DNA。提取的DNA标本使用QuawellQ5000紫外分光光度仪测定其纯度、浓度,将合格样品的纯度定于1.8~2.0之间,浓度不小于20ng/μL,置-20℃保存。按EZ DNA Methlation-GoldTMKit(美国Zymo Research公司产)试剂盒说明书操作对DNA标本进行亚硫酸氢盐修饰,修饰的DNA(BS-DNA)置-20℃保存。
1.2.2 甲基化特异性PCR(MSP)法检测宫颈脱落细胞中ATP10a甲基化状态 在UCSC网站(http://genome.ucsc.edu/)查找ATP10a基因序列,根据引物设计软件Methyl Primer Express V1.0设计MSP引物,包括甲基化引物(M引物)和非甲基化引物(U引物),引物由上海生工公司合成,序列见表1。MSP总反应体系20μL:AmpliTaq Gold 360 Master Mix(美国Zymo Research公司产)10μL,360 GC Enhancer 1μL,10μmol/L上下游引物各0.4μL,BS-DNA 2μL,ddH2O 6.2μL。循环参数:95℃ 10min;95℃ 30s,55℃ 30s,72℃ 1min,共40个循环;72℃ 7min;4℃保持至使用。MSP产物在2%浓度的琼脂糖凝胶(1∶10000加入核酸染料)中,以电压150V电泳30min,用UV凝胶电泳成像及图像分析系统进行图像分析。选取ddH2O做为空白对照,EpiTect®PCR Control DNA(德国Qiagen公司产)的M标准品(经亚硫酸氢盐修饰的完全甲基化的DNA)、U标准品(经亚硫酸氢盐修饰的完全未甲基化的DNA)分别作为M引物体系及U引物体系的阳性对照。

表1 ATP10a基因的MSP引物序列
1.2.3 甲基化结果评定标准 结合MSP产物电泳结果:(1)完全甲基化:M引物扩增出目的条带,而U引物未扩增出目的条带;(2)非甲基化:U引物扩增出目的条带,而M引物未扩增出目的条带;(3)不完全甲基化:M引物和U引物均扩增出目的条带,统计时将不完全甲基化归入甲基化。为进行MSP检测的质量控制,随机选取10%的标本进行重复实验。
1.2.4 阴道镜检查及宫颈活检病理 结合中国优生科学协会阴道镜和宫颈病理学分会(CSCCP)制定的阴道镜转诊指征,由专门妇科阴道镜室医师进行阴道镜检查并对可疑病变部位进行活检,活检病理由2位高年资病理医师独立阅片。将活检病理为炎症、子宫颈低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)统称为LSIL-组,HSIL、SCC统称为HSIL+组。
1.3 统计学处理 使用MedCalc、SPSS 26.0进行统计学分析。将活检病理HSIL+作为金标准,比较TCT、HPV16/18分型、ATP10a基因甲基化检测的灵敏度、特异度、阳性预测值(positive predictive value,PPV)、阴性预测值(negative predictive value,NPV)及受试者工作特征曲线下面积(area under the curve,AUC)。采用ROC曲线分析TCT、ATP10a基因甲基化检测在HR-HPV(除HPV 16/18)阳性患者中诊断HSIL+的效能。计数资料比较使用χ2检验,计量资料采用Kruskal-Wallis分析。P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料 共纳入145例患者,SCC 15例,HSIL 52例,LSIL 41例,炎症37例,其中HSIL+组(HSIL+SCC)67例,LSIL-组(炎症+LSIL)78例。HPV16/18分型阳性,TCT结果异常(≥ASCUS)、ATP10a甲基化阳性率分别为40.69%(59/145)、59.31%(86/145)、42.07%(61/145)。总人群平均年龄(44.21±12.72)岁,其中HISL+组(46.60±13.69)岁、LSIL-组(42.15±11.52)岁,HPV16/18分型阳性者(46.07±13.27)岁、HR-HPV(除HPV16/18)阳性者(42.93±12.24)岁,TCT结果异常者(44.45±12.08)岁、TCT结果正常者(43.85±13.69)岁,ATP10a甲基化阳性者(46.48±13.70)岁、阴性者(42.56±11.77)岁,差异均无统计学意义(P分别为0.060、0.165、0.730、0.070)。
2.2 ATP10a甲基化状态、TCT结果异常、HPV16/18分型阳性与宫颈病变严重程度关系 以活检病理为金标准,炎症组、LSIL组、HSIL组、SCC组的ATP10a甲基化阳性率分别为13.51%(5/37)、24.39%(10/41)、65.38%(34/52)、80%(12/15);LSIL-组(炎症+LSIL)ATP10a阳性率[19.23%(15/78)]显著低于HSIL+组(HSIL+SCC)[68.66%(46/67)](P<0.05),见表2、图1。HPV16/18分型阳性在炎症组、LSIL组、HSIL组、SCC组的占比分别为29.73%(11/37)、26.83%(11/41)、53.85%(28/52)、60.00%(9/15);LSIL-组(炎症+LSIL)HPV16/18阳性比例占28.21%(22/78)显著低于HSIL+组(HSIL+SCC)55.22%(37/67)(P<0.05)。TCT结果异常在炎症组、LSIL组、HSIL组、SCC组的占比分别为40.54%(15/37)、51.22%(21/41)、71.15%(37/52)、86.67%(13/15);LSIL-组(炎症+LSIL)TCT结果异常比例[46.15%(36/78)]显著低于HSIL+组(HSIL+SCC)[74.63%(50/67)](P<0.05),见表2。
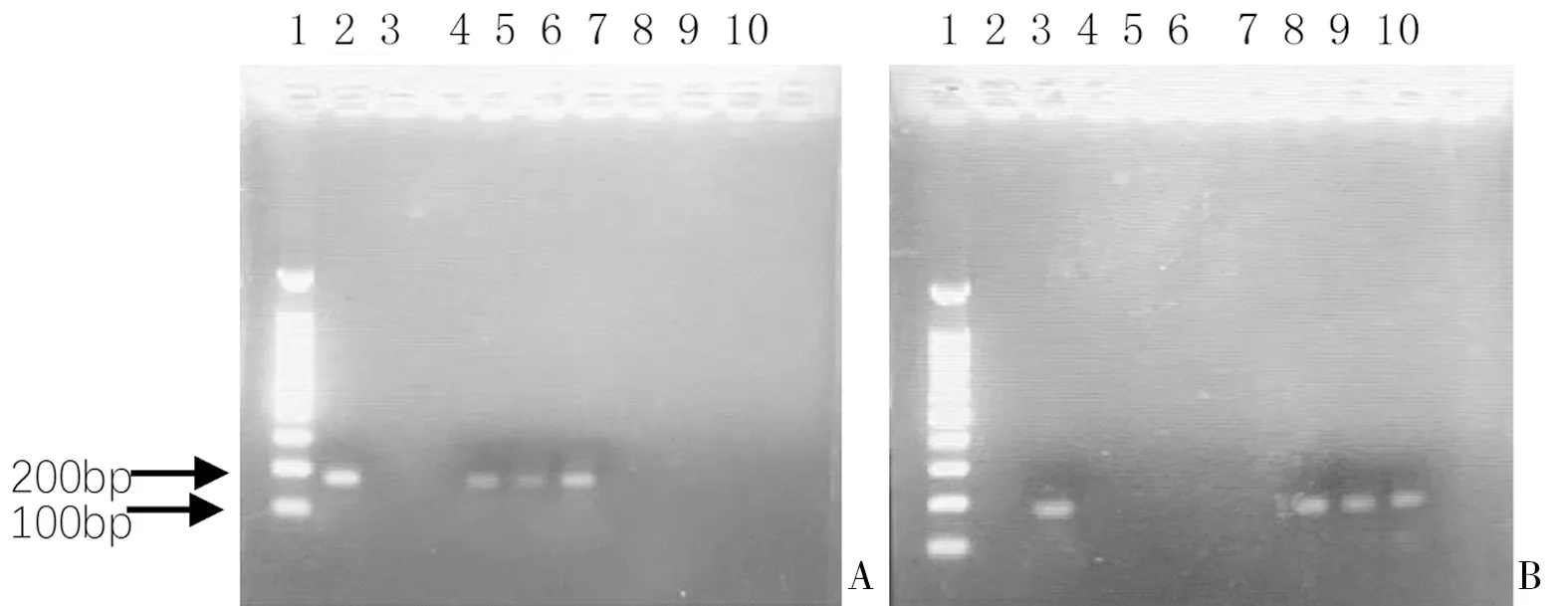
图1 典型标本的甲基化状态示意图A:M引物体系;B:U引物体系;1:1500bp DNA Marker;2:M标准品;3:U标准品;4:ddH2O;5~7:HSIL+组MSP产物;8~10:LSIL组MSP产物
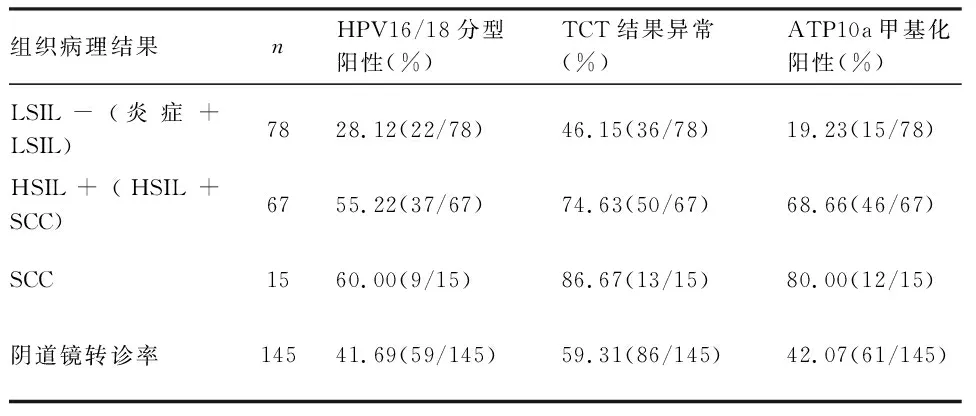
表2 HPV16/18阳性、TCT结果异常和ATP10a甲基化阳性率对比
2.3 ATP10a甲基化检测、TCT在HR-HPV感染患者中诊断HSIL+的比较 HR-HPV感染患者中,42.07%(61/145)ATP10a甲基化阳性,59.31%(86/145)TCT结果异常。ATP10a甲基化诊断HSIL+的特异性、PPV、AUC(80.77%、75.41%、0.747)均高于TCT(53.85%、58.14%、0.642),差异有统计学意义(P均<0.05);敏感性、NPV(68.66%、75.00%)与TCT(74.63%、71.19%)相比,差异无统计学意义(P均>0.05),见表3、图2。对于HR-HPV阳性患者采取ATP10a甲基化检测代替TCT进行分流,阴道镜转诊率降低17.24%,但两种分流方式均有漏诊SCC可能,见表2。
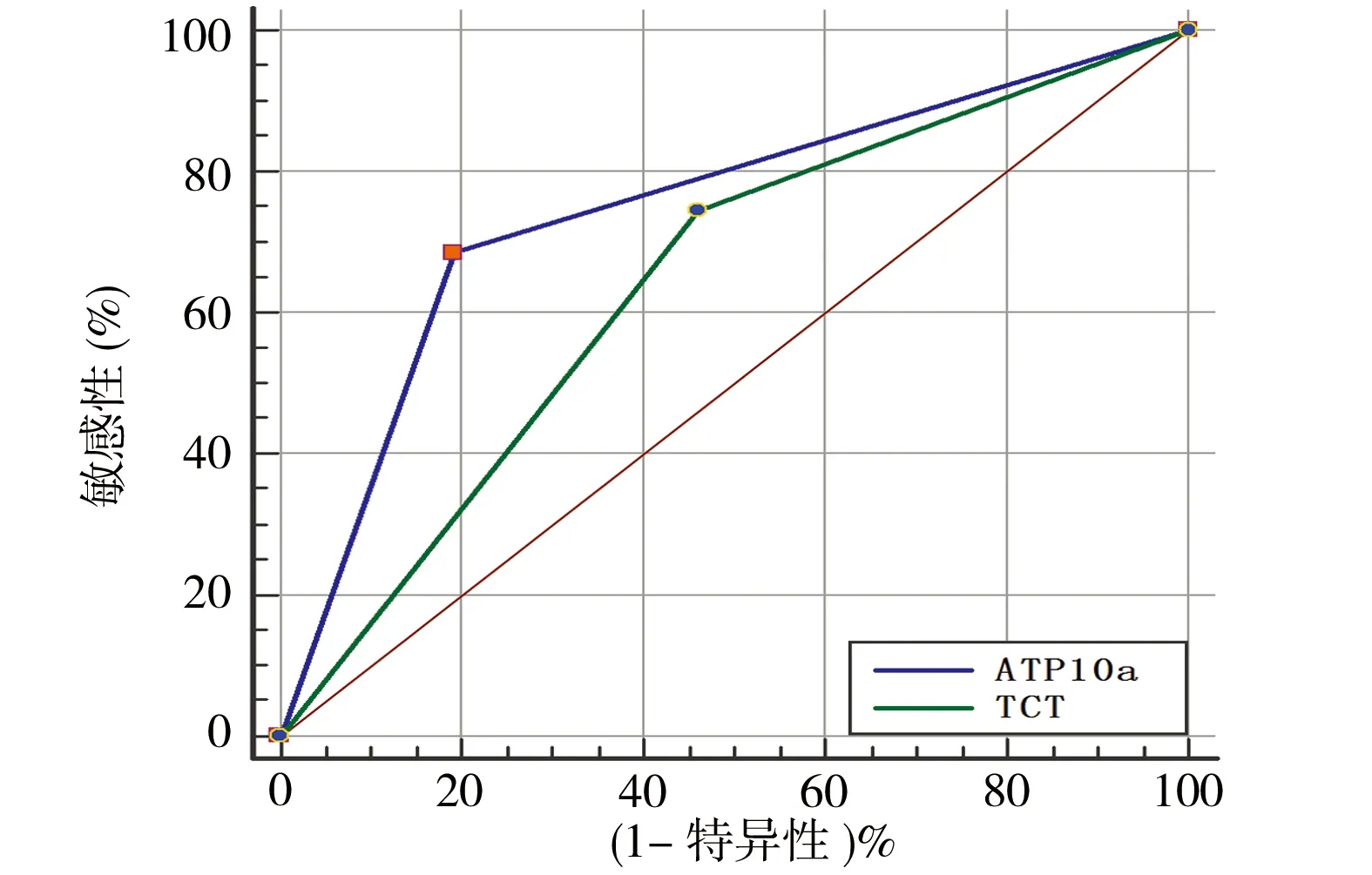
图2 ATP10a及TCT诊断HSIL+ROC对比

表3 TCT、ATP10a甲基化检测诊断HSIL+指标对比
2.4 ATP10a甲基化检测、HPV16/18分型在HR-HPV感染患者中诊断HSIL+的比较 HR-HPV感染患者中,40.69%(59/145)HPV16/18分型阳性,42.07%(61/145)ATP10a甲基化阳性。ATP10a甲基化诊断HSIL+的AUC显著高于HPV16/18分型检测(0.747、0.635)(P=0.033),见表4、图3。ATP10a甲基化检测的敏感性、特异性、PPV、NPV(68.88%、80.77%、75.41%、75.00%)均高于HPV16/18分型检测(55.22%、71.79%、62.71%、65.12%),但差异均无统计学意义(P均>0.05)。对于HR-HPV阳性患者采取ATP10a甲基化、HPV16/18分型进行分流,阴道镜转诊率分别为42.76%、41.69%,而HPV16/18分型检测漏诊SCC的概率为40%(6/15)。
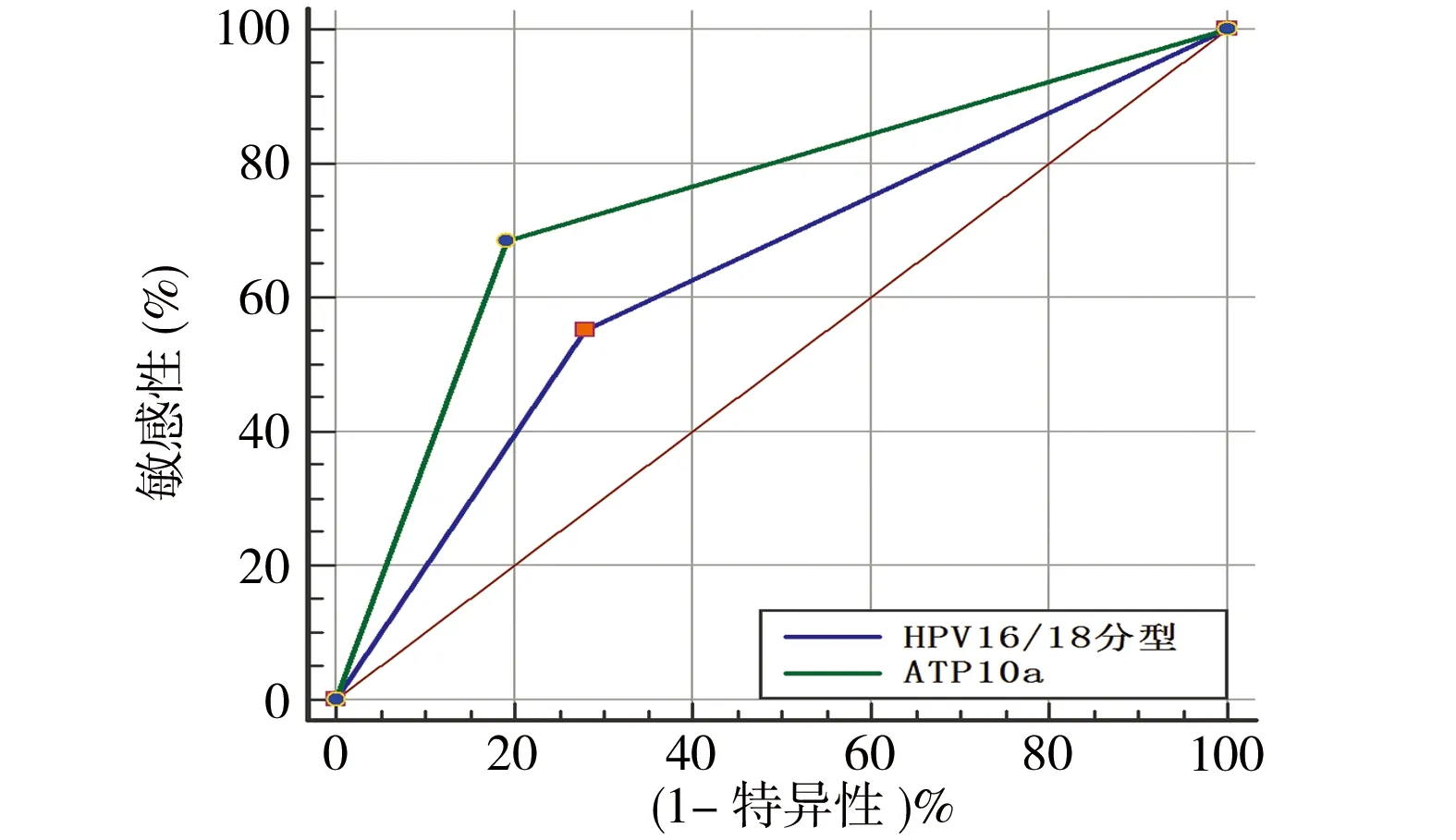
图3 ATP10a及HPV16/18分型诊断HSIL+ROC对比
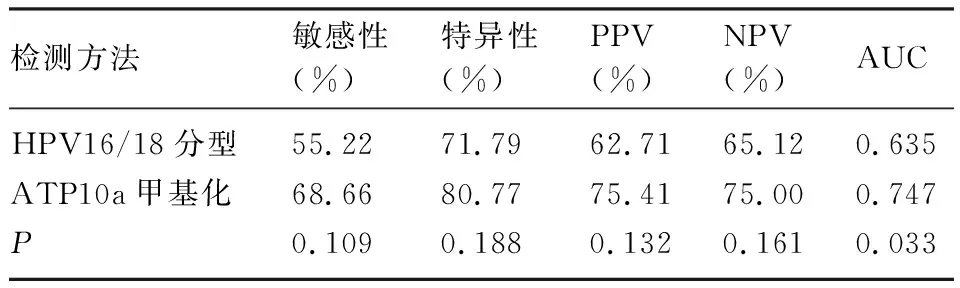
表4 HPV16/18分型、ATP10a甲基化检测诊断HSIL+指标对比
2.5 ATP10a甲基化检测、TCT在HR-HPV(除HPV16/18)感染中诊断HSIL+的比较 在HR-HPV感染患者中,59.31%(86/145)患者存在HR-HPV(除HPV16/18)感染。这类患者中,ATP10a甲基化诊断HSIL+的特异性(80.36%)明显高于TCT(48.21%),差异有统计学意义(P<0.05)。ATP10a甲基化的敏感性、PPV、NPV、AUC分别为63.33%、63.66%、80.36%、0.718,TCT分别为73.33%、43.13%、77.14%、0.608,对比各项指标差异均无统计学意义(P均>0.05),见表5及图4。
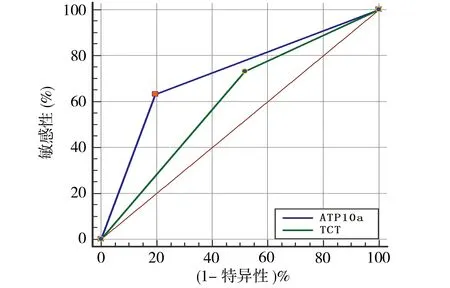
图4 其余HR-HPV感染中ATP10及TCT诊断HSIL+ROC对比
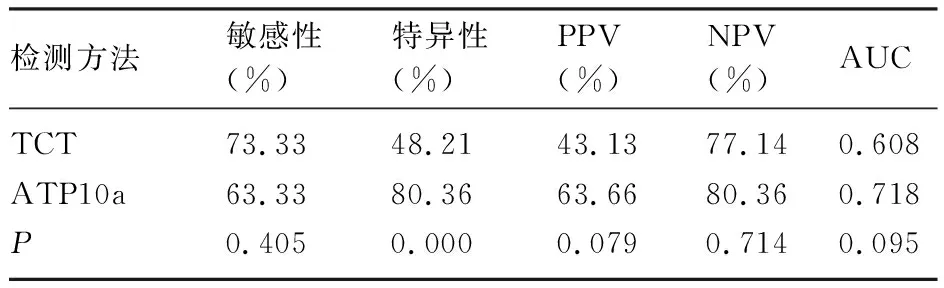
表5 HR-HPV(除HPV16/18)感染中TCT、ATP10a甲基化检测诊断HSIL+指标对比
3 讨 论
3.1 DNA甲基化检测在宫颈癌筛查中的应用 HR-HPV持续感染宿主细胞会引起遗传学和表观遗传学改变,诱导宫颈癌的发生。表观遗传学因改变多早于基因组学层面且存在可逆性,已成为肿瘤精准研究的重要方向之一[7]。DNA甲基化是表观遗传学的主要修饰方式,甲基化的累加效应在由宫颈正常组织到癌前病变到宫颈癌的发展过程中有着重要的意义。有关基因甲基化在宫颈癌筛查及管理中应用的研究逐年增加。台湾一项研究[8]纳入429例hrHPV+女性,分析PAX1甲基化、细胞学检测、HPV16/18分型检分流CIN3+的能力,发现PAX1甲基化检测的准确性和特异性(分别为91.6%和92.5%)优于HPV16/18(分别为76.9%和76.8%)。多个甲基化指标联合应用在宫颈癌早期筛查中具有良好的应用前景,有数据表明[9-10],CADM1/MAL甲基化在hrHPV感染女性中鉴别CIN3+的敏感性为68.4%~70%,特异性为71.2%~78%。3个甲基化组(C13ORF18/EBP41L3/JAM3,C13ORF18/ANKRD18CP/JAM3和ZSCAN1/SOX1)在中国HR-HPV阳性女性队列中鉴别CIN3+病变的敏感性分别为93%、90%和89%,特异性分别为58%、63%和65%[3]。Mariam等[6]研究发现,ATP10a、HAS1甲基化水平随着宫颈病变严重程度的增加而升高,其中ATP10a联合HAS1双基因检出SCC的敏感性及特异性均为100%。ATP10a位于人类染色体15q11-q13,属于蛋白编码基因,编码的蛋白质属于P型阳离子转运ATP酶家族以及氨基磷脂转运ATP酶亚家族。虽然此前ATP10a与宫颈癌的关系没有被描述过,但已有研究发现ATP10a与白血病等肿瘤发生发展密切相关[11-12]。
3.2 ATP10a甲基化对HR-HPV感染患者分流的作用 本研究采用MSP技术对HR-HPV感染的不同级别宫颈上皮内病变的宫颈脱落细胞中ATP10a甲基化状态进行定性检测,数据显示炎性组、LISL组、HSIL组、SCC组中ATP10a甲基化阳性率分别为13.51%、24.39%、65.38%、80%,其中LSIL-组(炎症+LSIL)阳性率19.23%,显著低于HSIL+组(HSIL+SCC)(68.66%),ATP10a甲基化阳性率随着宫颈上皮内病变严重程度的加重而逐步升高,这与Mariam等[6]研究结果一致,提示ATP10a甲基化状态可能与宫颈癌的发生发展相关。通过ROC曲线评估ATP10a甲基化在HR-HPV感染患者中诊断HISL+的效价,分别与TCT及HPV16/18分型进行对比,发现ATP10a甲基化检测的特异性、PPV、AUC(80.77%、75.41%、0.747)均高于TCT(53.85%、58.14%、0.642),差异均有统计学意义。ATP10a甲基化检测敏感性稍低于TCT(68.66%、74.63%),NPV高于TCT(75.00%,71.19%),但差异均无统计学意义。ATP10a甲基化诊断HSIL+的AUC显著高于HPV16/18分型检测(0.747、0.635,P=0.033)。ATP10a甲基化检测的敏感性、特异性、PPV、NPV(68.88%、80.77%、75.41%、75.00%)均高于HPV16/18分型检测(55.22%、71.79%、62.71%、65.12%),但差异均无统计学意义(P均>0.05)。分析ATP10a甲基化检测HSIL+的AUC高于TCT、HPV16/18分型可能原因如下:(1)因受取材方式、人工阅片等主观性影响TCT检测结果容易出现偏差;(2)HR-HPV感染常为一过性感染,并不能直接反映宫颈上皮细胞的分子状态,而由此产生的表观遗传效应差异是导致不同程度宫颈病变发生的直接原因[13]。推测ATP10a甲基化参与了表观遗传学变化的进程,某种程度上介导了宫颈疾病的发生与发展,因此检测HSIL+病变的效能高于TCT、HPV16/18分型检测,但有关ATP10a影响宫颈病变发生发展的具体分子机制还需更深入研究。
本研究比较了ATP10a甲基化、TCT在HR-HPV(除HPV16/18)阳性患者中的分流价值。结果显示,ATP10a甲基化鉴别HSIL+的特异性(80.36%)显著高于TCT(48.21%),而敏感性、PPV、NPV、AUC(63.33%、63.66%、80.36%、0.718)与TCT(73.33%、43.13%、77.14%、0.608)无明显差异。以上分析结果与总体人群并不完全一致,可能与样本量少有关,后续需进一步扩大样本量验证,但结合目前数据,ATP10a甲基化在HR-HPV感染患者分流效能并不劣于TCT、HPV16/18分型检测。与TCT相比,采取ATP10a甲基化对HR-HPV阳性患者进行分流时,阴道镜转诊率减少17.24%。Mariam等[6]研究报道的ATP10a联合HAS1双基因检出SCC的敏感性及特异性均为100%。本研究显示TCT、ATP10a甲基化检出SCC的概率分别为86.67%、80.00%,二者均有漏诊SCC的可能,这可能与本研究既未联合HAS1甲基化,又采取精准度低于高通量测序的MSP定性检测甲基化水平有关。细胞学检查对细胞病理水平要求高且主观性强,即使是高质量的细胞学检查仍会漏诊30%以上的HSIL+病变[14]。而HPV16/18分型检测不适合用于HR-HPV(除HPV16/18)阳性患者的分流。与细胞学及HPV16/18分型检测相比,甲基化检测操作方便、自动化、重复性高、准确性高,还可自采样获取,具有广阔的应用前景[3]。
本研究初步验证了ATP10a甲基化检测在HR-HPV感染患者中分流的价值,但仍有几点不足之处:(1)选择MSP方法对ATP10a甲基化状态进行定性检测,如后续能对ATP10a甲基化进行更为精确的定量检测,可能会提高该指标的诊断效能;(2)研究中所有宫颈组织病理结果均基于宫颈活检,可能与最终病理结果存在差异,可能影响研究结果的准确性;(3)纳入样本量少且并未涵盖除SCC以外的其余类型宫颈癌以及HIV等免疫力低下人群。
综上,ATP10a甲基化检测对HR-HPV感染患者的分流有一定应用价值,其诊断HSIL+的效能不劣于TCT、HPV16/18分型检测。但ATP10a甲基化检测能否作为早期诊断宫颈癌的手段,还需大规模、前瞻性、全面且更为精准的临床研究进一步评估。
