从酵母细胞中提取超氧化物歧化酶的工艺研究
2023-07-21吴文辉梁保红杨辰懿张喜李鹏飞
吴文辉 梁保红 杨辰懿 张喜 李鹏飞

【摘要】超氧化物歧化酶(Superoxide Dimutese,SOD)是一种以金属元素为辅基的蛋白酶,主要功能是清除生物体内由正常代谢产生的有害自由基。本课题SOD的提取来源为酵母,由于酵母细胞不存在被污染的情况,因此将酵母细胞作为SOD的提取源,相较于从牲畜血液中提取有着更方便、高效、安全的优点。本文主要对从酵母细胞中提取超氧化物歧化酶(SOD)的工艺进行研究,在实验过程中寻找更易提取SOD的方法以及如何提取出活性更强的SOD。
【关键词】超氧化物歧化酶;酵母菌;发酵法;超声波细胞破碎提取
【DOI编码】10.3969/j.issn.1674-4977.2023.02.033
Study on Extraction of Superoxide Dismutase From Yeast Cells
WU Wenhui,LIANG Baohong,YANG Chenyi,ZHANG Xi,LI Pengfei
(Taiyuan Institute of Technology,Taiyuan 030008,China)
Abstract:Superoxide dismutase(SOD)is a kind of protease with metal elements as the cofactor,whose main function is to remove harmful free radicals produced by normal metabolism in the organism. The source of SOD extraction in this project is yeast. Since yeast cells are not contaminated,it is convenient,efficient and safe to use yeast cells as the source of SOD extraction compared with the extraction from livestock blood. In this paper,the technology of extracting superoxide dismutase(SOD)from yeast cells was studied,and the method of extracting SOD more easily and how to extract SOD with stronger activity were found in the experiment process.
Key words:superoxide dismutase;saccharomycetes;zymotechnics;ultrasonic cell crushing extraction
1绪论
1.1酵母和YEPD培养基
酵母泛指能发酵糖类的各种单细胞真菌,主要生长在偏酸性环境当中,对水分和含糖量有一定的要求,是一种典型的异养兼性厌氧微生物,在有氧和无氧条件下都能够生存,分布范围广。
酵母菌的适宜pH值范围为3.1~7.4,最适pH值为4.6~ 5.1,最适生长温度一般在30℃左右。在有氧情况下,酵母菌可以把糖分解成CO2和H2O,同时在该情况下生长繁殖速度较快;在缺氧情况下,其生长繁殖速度受到限制,在该情况下可以把糖分解成乙醇和CO2。
酵母作为兼性厌氧微生物,其在生长代谢过程中会产生大量的超氧化物歧化酶,能够催化代谢过程中产生的各种自由基,将其歧化生成水和氧气,来减轻对细胞造成的损害[1]。同时酵母分布广泛,容易生长,相较于从血液中提取SOD,将酵母细胞作为提取源具有显著的优势。
酵母浸出粉胨葡萄糖培养基(Yeast Extract Peptone Dextrose Medium,YEPD培养基)是专门用于培养酵母菌的培养基,其配方为:1%酵母膏,2%蛋白胨,2%葡萄糖,若制备固体培养基,需加入2%琼脂粉[2]。
葡萄糖在高温条件下易产生焦糖,会对酵母细胞的生长产生抑制作用,因此将葡萄糖和其他成分分开配制,在不同条件条件下灭菌,最后混合得到YEPD培养基。
具体配制方法:用适量水溶解规定量的酵母浸粉和蛋白胨,在0.1 MPa、121℃的條件下高压蒸汽灭菌15 min,然后用适量水溶解规定量的葡萄糖,在0.1 MPa、115℃条件下高压蒸汽灭菌15 min。最后将两种灭菌完成的溶液混合,得到YEPD培养基。
1.2超声波细胞破碎提取技术
本实验采取超声波细胞破碎技术将酵母细胞破碎,从中提取SOD。所用仪器为超声波细胞破碎仪,其原理是利用超声波作用产生的能量使细胞等物质破碎[3]。
该细胞破碎方法具有操作简便、变量容易控制的特点,通过破碎时间和破碎功率影响最终SOD的活性,也是该实验主要探究的影响因素。
1.3邻苯三酚自氧化法检测SOD活性
自有活性的SOD以来,产生了许多测定SOD活性的方法,其中以化学法最为常用。邻苯三酚法是一种通过吸光度值的变化速率来间接测定SOD活性的简便方法,在国内外得以广泛应用。与其他方法相比,邻苯三酚自氧化法具有操作简便、高效、经济、准确等优点。基本原理是,邻苯三酚在弱碱性环境中会发生氧化反应,产生的超氧阴离子自由基生成有色的中间产物,导致吸光度值增加,吸光度值与反应时间两者呈线性关系。加入SOD后,催化超氧阴离子自由基生成过氧化氢,使有色中间产物的生成减少,导致吸光值下降,邻苯三酚自氧化的速率降低,则可以通过样品SOD抑制邻苯三酚自氧化速率的程度来间接得到样品SOD的活性[4]。
1.4正交试验设计和正交表
当实验理论需要进行实验次数太多时,通过有效的手段减少试验次数变得尤为重要,不仅可以减少工作量,也可以提高试验的效率。选择一部分有代表性的水平组合进行试验,由此出现了正交试验设计。
正交试验设计(Orthogonal experimental design)是在研究多因素多水平实验的时候,为了提高效率,设计出的一种实验方法。它是根据一定的数据特性,从原有试验中挑选出部分有代表性的组合进行实验。正交试验设计作为一种高效、实用的实验设计方法被广泛应用于科学研究领域。
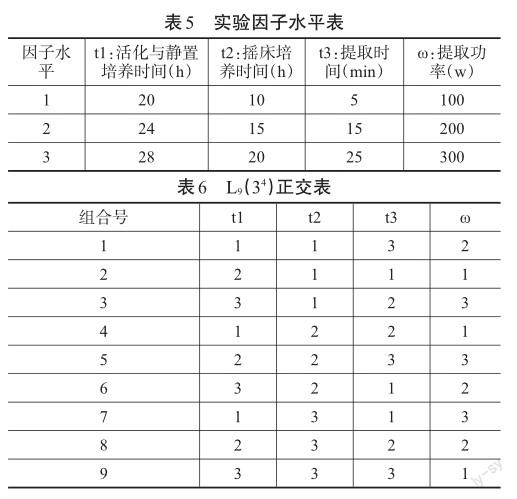
根据正交试验选择的水平,相互组合成表格,称为正交表。通常用LA(BC)的形式表示,A为试验次数,B为因子的水平数,C为因子的个数。比如该实验中采用的正交表形式为L9(34),即有4个实验因子,每个因子有3个水平,总共进行9次实验[5]。
2实验部分
2.1实验所用试剂和仪器设备
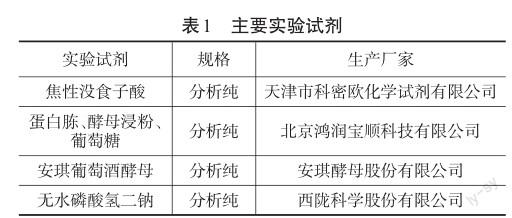
2.1.1主要实验试剂(见表1)

2.1.2主要实验仪器设备(见表2)

除此之外还有电子天平、高压蒸汽灭菌锅、pH计等仪器。
2.2YEPD培养基的制备
1)称取ZnSO4·7H2O 0.3 g,CuSO4·5H2O 0.25 g分别配制成100 mL的溶液。2)用适量水完全溶解8 g酵母浸粉,16 g蛋白胨,然后分别加入1 mL步骤1的两种溶液,最后用水定容至720 mL,移入四个三角烧瓶内(培养基量分别为180 mL、180 mL、180 mL、90 mL)。外包报纸,便于透气同时防止杂菌污染,并用皮筋扎好。3)适量水完全溶解20 g葡萄糖,然后用水定容至100 mL。4)将步骤2)培养基0.1 MPa、121℃高壓蒸汽灭菌15 min(同时灭菌一根试管),将步骤3)培养基0.1 MPa、115℃高压蒸汽灭菌15 min。5)将灭菌后的步骤3)培养基分四次(分别为20 mL、20 mL、20 mL、10 mL)平均加入四个步骤2)的三角烧瓶培养基内并混合,得到YEPD培养基。
2.3酵母细胞的培养和收集
1)将一定量酵母接种在YEPD培养基上,在30℃温室中静置培养。每次吸取2 mL左右培养液加入新培养基中,继续于培养箱中培养,活化3代。2)将1 mL菌液接于YEPD培养基试管中(5 mL),在30℃温室中静置培养,之后转接至100 mL发酵培养基三角烧瓶中,30℃摇床(140 r/min)培养。3)5000 r/min离心5 min,弃去上清液,用水反复清洗沉淀,再次离心,收集细胞[6]。
2.4SOD的提取
2.4.1试剂配制
磷酸缓冲溶液(含0.1 mol/L的EDTA),A液:取Na2HPO4 35.9 g,加水溶解,并稀释至500 mL。B液:取NaH2PO4 2.76 g,加水溶解,并稀释至1000 mL。
取A液91.5 mL,B液8.5 mL,再加入2.9 g EDTA,混合即得pH值为7.8的磷酸缓冲溶液。
2.4.2提取方法
用30 mL磷酸缓冲溶液溶解酵母细胞,利用超声波细胞破碎机,设定功率和提取时间,工作2秒,休息8秒,进行细胞破碎。最后,5000 r/min离心25 min,收集上清液后进行过滤,得到SOD粗提液。
2.5SOD活性检测
2.5.1试剂配制
1)邻苯三酚溶液:称取邻苯三酚0.57 g,用10 mmol/L的盐酸溶液(0.2 mol/L的HCl 5 mL稀释至100 mL)配制成100 mL溶液。2)Tris-HCI-EDTA缓冲液(pH值为8.2,内含2 mmol/L EDTA):称取2.4 g Tris和0.12 g EDTA配制成100 mL溶液,与44.76 mL 0.2 mol/L的盐酸溶液(12 mol/L的HCl 16.6mL稀释至1L)混合,加蒸馏水至200 mL,调pH值为8.2。
2.5.2测定操作
1)邻苯三酚自氧化速率测定
按表3中试剂用量加入,Tris-HCI-EDTA缓冲液和蒸馏水25℃保温20 min,然后与相同条件保温的邻苯三酚溶液混合(空白对照以相同条件保温)混匀后迅速置于比色杯中,在420 nm波长下测定光密度值,每隔30 s测一次光密度值,共测4 min[4]。

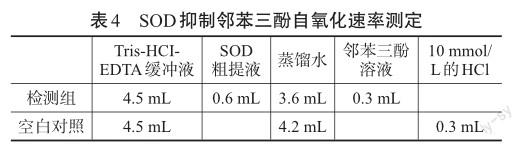
2)SOD抑制邻苯三酚自氧化速率测定
按表4中试剂用量加入,Tris-HCI-EDTA缓冲液、SOD粗提液和蒸馏水25℃保温20 min,其余操作同上。
2.5.3活性计算


2.6正交试验设计和正交表(见表5,表6)
3结果与分析
经多次测定,最终取平均值可得邻苯三酚自氧化速率ODA=0.036。最终实验结果如下表7。
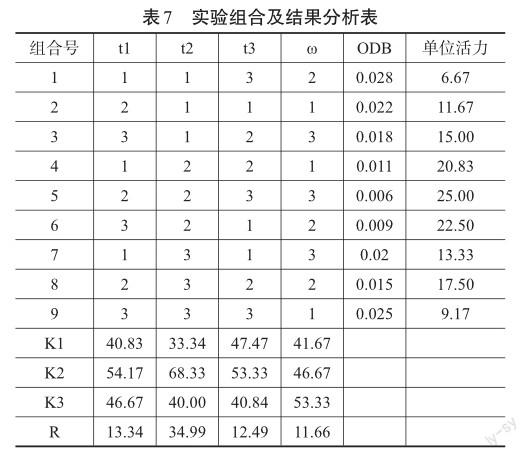
从表中可以看出:从K值来看,最优的组合为t1 24 h、t2 15 h、t3 15 min和ω300 w,但这并未在实验体现。从实验结果来看,最优组合是第五组,即t1 24 h、t2 15 h、t3 25 min和ω300 w。因此,進一步实验可以验证这两个组合的优劣。从R值来看,其值越大代表该因素越重要。因此,从本实验结果可以得知,在此四种因素当中,最重要的因素是t2(摇床培养的时间),其次是t1(活化与静置培养时间)、t3(提取时间)和ω(提取功率),且后面三种因素的重要程度差别不大。再从K值的角度分析,t2的最适时间为15 h,适当提高ω和t3有助于产物SOD单位活力的增加,同时t1过高会降低产物SOD的单位活力,应该维持在24 h左右。
4结论
1)理论最优实验组合为t1(活化与静置培养时间)24 h、t2(摇床培养的时间)15 h、t3(提取时间)15 min和ω(提取功率)300 w。2)在此四种因素当中,最重要的因素是t2(摇床培养的时间),其次是t1(活化与静置培养时间)、t3(提取时间)和ω(提取功率),且后面三种因素的重要程度差别不大。3)最重要的因素,即t2的最适时间为15 h,适当提高ω和t3有助于产物SOD单位活力的增加。4)应该注意t1过高会降低产物 SOD的单位活力,应该维持在24 h左右。
【参考文献】
[1]周德庆.微生物学教程[M].北京:高等教育出版社,2011.
[2]罗跃中,李忠英,李继睿,等.高效酒精酵母菌选育及其特性研究[J].中国酿造,2013,32(8):71-74.
[3]孙彦.生物分离工程[M].北京:化学工业出版社,2005.
[4]许雅娟,赵艳景,胡虹.邻苯三酚自氧化法测定超氧化物歧化酶活性的研究[J].西南民族大学学报(自然科学版),2006(6):1207-1209+1212.
[5]刘瑞江,张业旺,闻崇炜,等.正交试验设计和分析方法研究[J].实验技术与管理,2010,27(9):52-55.
[6]谭天伟,马润宇,杨元忠,等.从酵母菌中分离纯化超氧化物岐化酶[J].微生物学报,1997(1):68-71.
【作者简介】
吴文辉,男,2001年出生,本科在读,专业方向为环境与安全工程系生物工程专业。
(编辑:侯睿琪)
