肝生化指标联合MRI同反相位对非酒精性脂肪肝脂肪定量的预测价值
2023-07-21彭晓林龚秀茹国亚新朱婷婷张闽光舒政
彭晓林 龚秀茹 国亚新 朱婷婷 张闽光 舒政
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是全世界范围内越来越流行的慢性肝病,其定义为除酒精和明确损肝因素外所致的肝脏超过5%的脂肪甘油三酯沉积。其如果在早期脂肪变性阶段得不到改善,可进一步发展为非酒精性脂肪性肝炎,甚至肝硬化、肝纤维化,终末期肝细胞癌的5年累计发生率可达到2%~20%[1-3]。此外,NAFLD也与全身性代谢紊乱有着密切联系,是糖尿病、心脏血管疾病及慢性肾病等疾病非常重要的病理过程[4]。肝活检目前仍是脂肪肝分级的金标准,但因其侵入性可导致感染,甚至可能引起死亡,因此限制了它的广泛应用[5-6]。本研究以肝/脾CT密度之比为参照标准,探讨影像学与血清学对于NAFLD分级的关系,并构建了多元线性回归预测模型。
资料与方法
一、研究人口与纳入排除标准
收集2015年1月—2020年12月在上海中医药大学附属市中医医院放射科同时行CT和MRI上腹部扫描的患者220例,其中正常对照组86例,脂肪肝组轻度87例,中度26例,重度21例,平均年龄(57.13±11.74)岁(见表1),影像学图如图1所示。
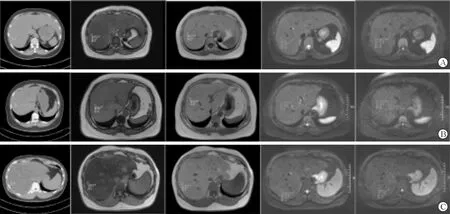
注: a 轻度脂肪肝,b 中度脂肪肝,c 重度脂肪肝;从左往右依次为CT图像,MRI反相位、同相位图像和弥散加权b50、b600 mm2/s图像图1 不同程度脂肪肝影像学图像
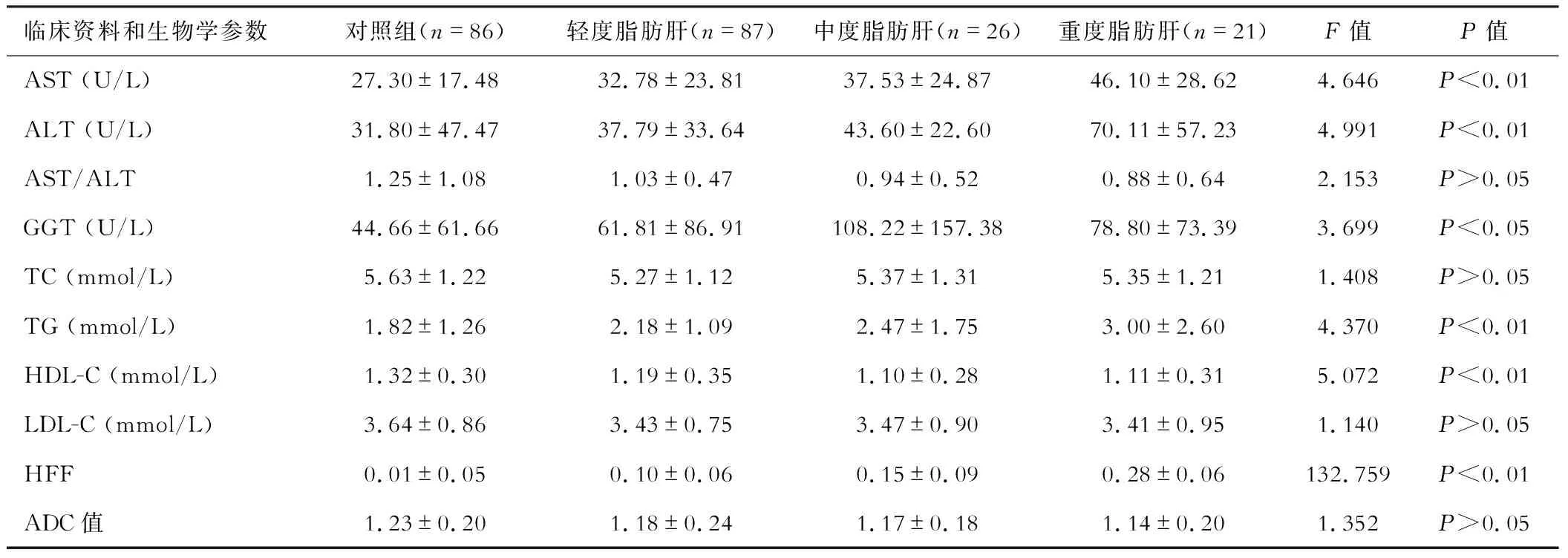
表1 临床资料的血清学和影像学指标
纳入标准包括:①上腹部MRI检查与上腹部CT检查间隔时间不超过两周者;②上腹部MRI检查序列包括OP-IP相位序列和弥散加权成像序列(b值为50 mm2/s 和600 mm2/s)者;③临床及实验室检查资料完整者,临床资料包括年龄、性别、饮酒史等,实验室检查结果包括血生化数据和血脂数据。
排除标准包括:①有酗酒史者(饮酒按乙醇量计,男性>140 g/周,女性>70 g/周);②有肝脏肿瘤、乙型肝炎、肝硬化、疑似血色素沉着病、自身免疫性肝病等其他弥漫性肝脏病变及原发性硬化性胆管炎等胆道疾病者;③有急性肝损伤、急性胰腺炎等引起肝脏CT密度值降低疾病者;④脾切除者;⑤由于呼吸或者机器原因导致图像伪影过重者。
本研究获得了上海中医药大学附属市中医医院伦理委员会的人体研究批准,并获得了每位参与者的书面知情同意。
二、临床资料和血清学数据
从纳入参与者提取的临床资料包括检查日期,年龄、性别,患病史;肝生化指标于患者当天空腹静脉血采集所得,包括丙氨酸氨基转移酶(ALT),天冬氨酸氨基转移酶(AST),γ-谷氨酰胺转肽酶(γ-GT)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。
三、影像学检查
MRI所有检查均在1.5T超导磁共振扫描仪(Magnetom Avanto; Siemens Healthcare, Erlangen, Germany)上进行,扫描时采用32通道身体阵列线圈。
检查序列为:①T2WI脂肪抑制序列;②同反相位序列:TR 245 ms,TE 1.15、2.3 ms,采集时间为18 s;③扩散加权成像:采用自旋平面回波序列,具体扫描参数如下:TR/TE: 4000 ms/78 ms,层厚5 mm,FOV 300 mm×380 mm,b值分别为50和600 s/mm2。
四、图像获取及后处理
从放射科后处理工作站上获取符合纳入标准的临床患者的上腹部CT和MR图像数据,由两位医生选取图像肝门最大层面及分别向上下各一层,每层选取三个感兴趣区(region of interest,ROI)进行测量,面积约为50 mm2,注意避开肝门部血管,并与肝脏边缘保持一定距离。
CT后处理:从CT图像上分别测量肝、脾密度CT值。CT诊断NAFLD的主要依据为肝/脾CT比值小于1.0,其中肝/脾CT值大于0.7且小于1.0者判断为轻度脂肪肝,肝/脾CT值小于0.7且大于0.5者判断为中度脂肪肝,肝/脾CT值小于0.5者判断为重度脂肪肝。
MRI后处理:同反相位序列可得到同相位和反相位两幅图像,通过同反相位信号值计算得出同反相位信号差,肝脏脂肪分数(HFF)= (SIin-SIout) /2SIin计算得出(SIin和SIout分别代表同相位和反相位图像上的肝脏信号强度)。DWI图像的ADC值可通过两组b值的MRI信号值根据公式S(b1)/S(b2) = exp(b2-b1)*ADC计算得出[其中 S(b1)、S(b2)为相应b值扩散梯度场下的信号强度]。
五、统计学分析
使用SPSS 21.0软件进行数据的统计分析。计量资料以均数±标准差表示。用Kolmogorov-Smirnov检验进行正态性检验,若符合正态性检验采用单因素方差分析,用LSD检验进行两两比较,若不满足则采用Kruskal-Wallis检验,当比较的结果差异有统计学意义时,进一步采用Bonferroni法进行两两比较。采用受试者工作特征曲线下面积(ROC)分析CT和同反相位之差的绝对值诊断脂肪肝的敏感性、特异性,计算阈值。CT与同反相位诊断NAFLD之间的相关性采用相关性分析,若满足双变量正态分布和方差齐性,应用Pearson相关分析,若不满足,则使用Spearman秩相关分析。所有数据均采用双侧检验,P<0.05为差异有统计学意义。
结 果
一、肝生化指标比较
血清学分析中,脂肪肝组AST、ALT和TG均与脂肪浸润程度呈正相关,γ-GT显著升高,组间差异均有统计学意义(P<0.05);HDL-C则与脂肪浸润程度呈负相关,组间差异有统计学意义(P<0.05),而脂肪肝组TC、HDL-C低于对照组,组间差异无统计学意义(P>0.05)。
二、MRI检查结果比较
MRI成像分析中,HFF随脂肪肝程度加深而逐渐增大,而ADC值则相反。其中HFF与肝/脾CT值之比均存在较高的负相关性(r=-0.819,P<0.01),其在诊断不同程度脂肪肝时的阈值分别为0.04,0.11,0.18,AUROC分别为0.911,0.880,0.978(见表2)。在最终的血清学结果分析中,AST、ALT均随脂肪肝程度的加深而升高,AST/ALT反之,其分别与肝/脾CT值之比有着一定程度的相关性。HFF与不同程度脂肪肝肝/脾CT值之比的相关性散点图如图2所示(R2=0.670)。

图2 HFF与不同程度脂肪肝肝/脾CT值之比的相关性散点图(R2=0.670)

表2 影像学方法对不同级别NAFLD的诊断性能汇总
最终构建的多元线性回归分析显示,血清学中的AST以及磁共振成像技术的HFF对肝/脾CT值之比有预测价值(见表3)。所构建的多元线性回归方程为:肝/脾密度之比=1.202-0.002AST-2.215HFF (R2=0.690)。

表3 血清学和影像学最终构建的多元线性回归方程参数
讨 论
目前单一的血清学指标或者肝功能指标并不能判定脂肪肝的形成,需要血清学与肝功能双阳性的检验结果联合进行诊断[7-8]。郭霜、邓钦木等[9-10]的研究结果显示,脂肪肝患者血清AST、ALT、γ-GT、TC、TG、HDL-C和LDL-C指标均升高。施素英、张杨等[11-12]比较了正常对照组和脂肪肝组得出结论,AST、ALT、GGT、TC、TG和LDL-C均有不同程度的升高,而HDL-C有所降低,这与我们的研究结果较为一致。另外,在我们的研究中,TC和HDL-C随脂肪程度升高有降低的趋势,这与前人的研究不同,可能由于我们的研究未使用肝活检作为金标准,且不排除其他肝病的影响。
截至目前,同反相位序列在腹部磁共振扫描中都有着较为广泛的应用。杨逸铭等[13]的研究得出结论,HFF在不同程度脂肪肝的值均有明显升高,在诊断轻度脂肪肝的AUC为0.874,中重度为0.913,这与我们的研究结论较为一致。目前,利用两个扩散梯度因子(b值)的单指数DWI分析是定量肝脏病变最常用的数据采集和处理方法之一,经研究证明,腹部最佳b值选择为≥600 mm2/s[14]。既往有研究证明,ADC值随着 NAFLD 严重程度的增加而降低(r=-0.529),AUC = 0.727[15-16],而我们的研究显示出较弱的相关性,可能是因为该研究使用了肝脏病理作为金标准。另一项对120例NAFLD患者进行的前瞻性研究证实,随着脂肪程度的加深, ADC与HFF呈反比关系,其中HFF>5%的患者 ADC 显著降低[17]。而我们的研究同样显示在HFF>4%时,ADC值有较为明显的降低,而在HFF>18%时,也较为显著。综上所述,我们对于影像学的研究结论基本与前人的研究一致。
本研究对220例NAFLD患者进行了血清学和影像学的数据采集分析,最终建立精准模型。样本数量较大,实验结果较为可靠,可为NAFLD脂肪定量提供一定的价值。但本研究同时存在几项局限性。首先,肝脏病变的病理过程一般较为复杂,不同程度的炎症、纤维化、胆汁淤积等多种因素混杂在一起导致各种影像方法诊断脂肪病变的相关性受到削减。其次,在磁共振同反相位成像中,肝脏的铁超负荷会使局部磁场不均匀,质子快速去相位,造成信号缺失,从而对图像质量产生一定的影响。
综上所述,本研究用NAFLD作为模型,用血清学方法结合磁共振成像来表征肝/脾密度之比,为提供肝脏脂肪定量提供参考。这表明联合血清学方法和磁共振同反相位序列具有替代肝/脾CT值之比的潜力,从而为临床上定量NAFLD脂肪含量提供新思路。
利益冲突声明:所有作者均声明不存在利益冲突。
