铁死亡通路关键基因在肝癌中的表达及临床意义
2023-07-21王晓张凌云
王晓 张凌云
原发性肝癌是世界范围内癌症相关的主要致死病因之一[1]。目前手术是早期肝癌的有效治疗手段,但大部分患者确诊时已经是中晚期[2]。虽然凋亡相关的治疗方法取得一定的效果,但是仍然达不到临床期望疗效[3]。铁死亡是新近发现的一种铁离子依赖的程序性细胞死亡方式。癌细胞表现出的代谢特点和对铁的依赖性使铁死亡诱导剂治疗肿瘤成为可能,促进铁死亡的发生可有效干预肿瘤进展[4-6]。铁死亡过程中伴随着细胞内大量铁离子的累积、谷胱甘肽消耗、脂质过氧化及脂质活性氧的产生。铁离子、氨基酸代谢及脂质过氧化等相关的信号通路影响铁死亡的发生[7, 8]。谷胱甘肽过氧化物酶 4(glutathione peroxidase 4,GPX4)、 溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)、线粒体相关凋亡诱导因子2(apoptosis-inducing factor mitochondria-associated 2,AIFM2)、长链脂酰辅酶A合成酶4(acyl-CoA synthetase long-chain family member 4,ACSL4)、核因子红细胞2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是铁死亡通路的关键调控基因[4, 6, 9]。本研究运用生物信息学分析铁死亡通路关键基因在肝癌中的表达,以及其与临床预后、免疫调控的关系,为进一步优化肝癌的治疗方案及铁死亡的临床应用提供理论依据。
资料与方法
一、基因表达水平分析
运用在线数据库(http://gepia.cancer-pku.cn)对铁死亡通路关键基因在人肝癌组织及正常肝组织中的mRNA表达水平进行对比分析。P<0.05为差异有统计学意义。
二、基因改变频率分析
采用cBioPortal数据库(http://www.cbioportal.org)分析肝癌患者铁死亡通路关键基因改变的情况。
三、预后分析
采用在线工具Kaplan-Meier生存曲线(http://www.kmplot.com)和GEPIA数据库评估铁死亡通路关键基因表达水平的预后价值。
四、免疫浸润细胞分析
TIMER(https://cistrome.shinyapps.io/timer/)在线数据库分析肝癌患者铁死亡通路关键基因与免疫细胞数量的相关性。
五、细胞毒性T淋巴细胞相关性分析
TIDE(http://tide.dfci.harvard.edu/contact/)在线数据库分析铁死亡通路关键基因与细胞毒性T淋巴细胞的相关性。
结 果
一、铁死亡通路关键基因在肝癌中的表达
采用GEPIA在线数据库分析铁死亡通路5个关键基因(GPX4、SLC7A11、AIFM2、ACSL4、Nrf2)在肝癌组织中的mRNA表达水平。5个关键基因在肿瘤组织中的mRNA表达量均高于正常组织。但是与正常组织相比,GPX4、SLC7A11、AIFM2、Nrf2这4个基因在肿瘤组织中的mRNA表达量升高差异无统计学意义(P>0.05)。肝癌组织中ACSL4的mRNA表达量高于正常组织,差异有统计学意义(P<0.05),见图1。
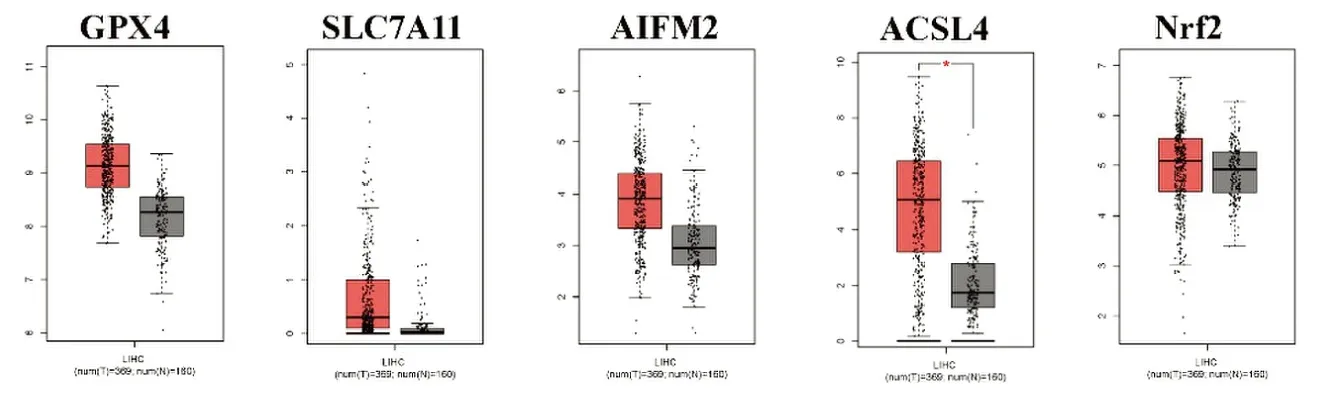
图1 铁死亡通路关键基因在GEPIA数据库中的表达
二、铁死亡通路关键基因的基因突变
常见的基因突变有基因扩增、缺失突变、插入突变、移码突变、点突变、框内突变等。运用在线数据库cBioPortal分析铁死亡通路关键基因(GPX4、SLC7A11、AIFM2、ACSL4、Nrf2)的改变。结果显示以上基因改变主要包括基因扩增、缺失突变、点突变(错义突变)、框内突变。GPX4及SLC7A11均存在0.8%的缺失突变。AIFM2、ACSL4、Nrf2均存在扩增突变,其中Nrf2扩增突变频率最高且突变类型最为丰富,包括基因扩增、框内突变、点突变(错义突变)、缺失突变四种类型,见图2。

图2 铁死亡通路关键基因表达在肝癌中的改变
三、铁死亡通路关键基因在肝癌中的预后价值
Kaplan-Meier生存分析显示,GPX4高表达时肝癌患者的无进展生存期明显升高,预示着肝癌患者有较好的预后(HR=0.68,P=0.014 );而SLC7A11 高表达时肝癌患者的总生存期短(HR=2.41,P=5.3e-07),且与无进展生存期呈负相关(HR=1.79,P=0.00043),在Stage Ⅰ-Ⅲ的肝癌患者中,随着肿瘤分期的升高,SLC7A11的表达量逐渐升高,以上结果均提示高表达SLC7A11与肝癌患者的不良预后相关,见图3。
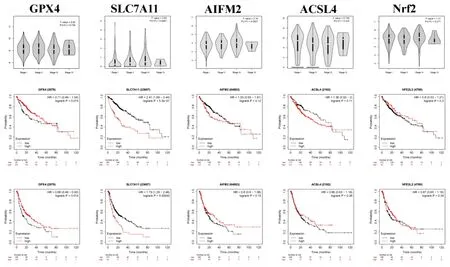
图3 铁死亡通路关键基因表达与肝癌患者临床资料的相关性分析
四、铁死亡通路关键基因与机体免疫系统的关系
通过TIMER数据库分析铁死亡通路关键基因与机体免疫系统的关系。SLC7A11在肝癌中的表达与B细胞(Cor=0.185,P=5.68e-04)、CD8+T淋巴细胞(Cor=0.136,P=1.18e-02)、CD4+T淋巴细胞(Cor=0.128,P=1.73e-02)、巨噬细胞(Cor=0.21,P=9.62e-05)、中性粒细胞(Cor=0.293,P=2.89e-08)和树突状细胞(Cor=0.244,P=5.51e-06)的浸润呈正相关;Nrf2的高表达与B细胞(Cor=0.153,P=4.34e-03)、CD8+T淋巴细胞(Cor=0.138,P=1.04e-02)、CD4+T淋巴细胞(Cor=0.297,P=1.92e-08)、巨噬细胞(Cor=0.244,P=5.06e-06)、中性粒细胞(Cor=0.389,P=6.55e-14)和树突状细胞(Cor=0.261,P=1.02e-06)的浸润也呈正相关(P<0.05)。未发现其他铁死亡通路关键基因与机体免疫浸润细胞之间的相关性,见图4。

图4 铁死亡通路关键基因表达与免疫细胞浸润的相关性的分析
五、铁死亡通路关键基因与细胞毒性T淋巴细胞相关性分析
TIDE在线数据库分析显示无论AIFM2的表达水平如何变化,CTL水平对患者预后影响不变,提示AIFM2与CTL数量没有显著相关性,见图5。

图5 铁死亡通路关键基因表达与CTL相关性分析
讨 论
诱导铁死亡可产生显著的抗肿瘤作用,尤其对具有耐药特性及对传统治疗反应性低的肿瘤具有良好的治疗作用,目前已经成为肿瘤治疗的潜在有效方法之一[6, 10]。铁死亡本质上是由于铁过载造成的细胞内脂质活性氧累积而引起的细胞死亡,它与细胞内的氧化还原稳态失衡相关,目前已知多个关键基因对铁死亡的调控有着决定性的作用[9, 10]。
GPX4主要是通过消耗谷胱甘肽清除脂质活性氧抑制铁死亡,多数铁死亡诱导剂通过抑制GPX4活性直接导致铁死亡的发生,因此GPX4表达在铁死亡中发挥着极为关键的作用[11]。本研究发现GPX4在肝癌中存在着低频率的缺失突变,进一步通过生物信息学分析发现,高表达GPX4后,肝癌的无进展生存期升高,暗示了GPX4在肝癌的发生发展中发挥负调控作用。相关研究显示GPX4在包括肝癌在内的多种实体瘤中表达均升高,可能发挥着促癌的作用[10]。
谷胱甘肽是GPX4参与抗氧化的必要底物,而其合成依赖于氨基酸的转运[12]。研究表明SLC7A11是胱氨酸转运体的重要组成部分,在多种恶性肿瘤中过表达,能够抑制铁死亡、促进肿瘤发展[13],与本研究的结果一致。本研究发现SLC7A11在肝癌组织中表达量高于癌旁组织,但差异无统计学意义;高表达SLC7A11的患者总生存期及无病生存期明显低于低表达SLC7A11的患者,此外SLC7A11与多种免疫细胞浸润存在显著相关性,如T细胞、B 细胞、巨噬细胞等,说明SLC7A11与肝癌患者的免疫微环境调控相关,以上结果提示SLC7A11参与肝癌的进展,可能是肝癌治疗中有效的靶点及预后因子。
AIFM2是一个被新发现的铁死亡抑制基因,通过还原细胞膜上的辅酶Q10阻止脂质过氧化代偿GPX4缺失引起的铁死亡,也称为铁死亡抑制蛋白1(ferroptosis suppressor protein 1, FSP1)[14]。本研究发现AIFM2在肝癌中的突变主要是扩增突变,且随着肿瘤分期的升高,AIFM2表达量逐渐升高,但差异无统计学意义,相关性分析显示AIFM2不影响体内CTL水平,其表达与肝癌免疫治疗无明显的相关性。以上结果提示AIFM2可能参与肝癌的发生发展,其基因扩增有可能参与肝癌的恶性生物学行为,但是在生存预后分析及免疫相关分析中未见明显阳性结果,需要扩大样本量进一步验证。
ACSL4正常生理状态下分布于生成类固醇的组织和器官,如肾上腺和卵巢,参与磷脂酰乙醇胺或磷脂酰肌醇等易氧化膜磷脂的合成,促进多不饱和脂肪酸发生脂质过氧化,从而促进铁死亡发生[15, 16]。本研究发现ACSL4在肝癌中表达明显升高,存在低频率的基因扩增,但ACSL4的表达没有预测价值。
Nrf2是调控细胞氧化应激的核心转录因子, 通过与抗氧化反应元件结合,激活下游调节铁和脂质活性氧代谢相关基因从而抑制铁死亡[17, 18]。本研究分析结果提示Nrf2的基因扩增频率较高,另外Nrf2与T细胞、B细胞、巨噬细胞等多种免疫细胞浸润存在显著正相关,以上结果提示Nrf2可能参与到肝癌患者的免疫微环境调控相关,也说明铁死亡代谢通路在一定程度上参与到机体免疫系统的调控中。此外,Nrf2高表达的患者总生存期较长,但差异无统计学意义,其预后价值还需要在更多的标本进行分析。
综上所述,铁死亡通路的关键基因除了调控肿瘤铁死亡,还能够在肝癌的发生发展过程中发挥着重要的作用,具有一定的预测价值,此外肝癌患者中部分铁死亡通路关键基因的改变能够影响人体的免疫微环境,提示其可以应用到瘤免疫治疗或铁死亡联合疗法中。本研究结果丰富了铁死亡通路关键基因的潜在应用价值,为优化铁死亡治疗策略及肿瘤联合治疗方法的研发提供新的依据。
利益冲突声明:所有作者均声明不存在利益冲突。
