肝静脉压力梯度对失代偿性肝硬化患者预后的预测作用
2023-07-21魏峰王剑施健魏珏
魏峰 王剑 施健 魏珏
失代偿性肝硬化是以腹水、静脉曲张破裂出血、肝性脑病为临床特征的慢性肝病,是终末期肝病患者的重要死亡因素之一[1-2]。Child-Turcotte-Pugh(CTP)和终末期肝病模型(MELD)评分目前均已在临床中用来评估肝硬化患者的预后[3]。MELD评分相较于CTP评分可以更准确地预测肝硬化患者的生存及严重程度,但是它不能完全反映腹水、肝性脑病或静脉曲张破裂出血等并发症对患者的预后影响。门静脉压力的增加与肝硬化患者静脉曲张出血、腹水和死亡密切相关[4]。肝静脉压力梯度(HVPG)的测量是评估肝硬化严重程度和预后评价的有效工具[5-6]。然而,HVPG在预测失代偿性肝硬化患者长期死亡率方面的作用存在争议[7-8]。本研究旨在探讨 HVPG 对失代偿性肝硬化患者预后评估的作用。
资料与方法
一、研究对象
选取2016年9月至 2020年12月就诊于上海长征医院消化内科的非重症失代偿性肝硬化患者。所有患者既往有肝硬化的组织学证据或根据临床表现、实验室检查诊断为肝硬化。排除标准为使用血管活性药物、确诊或疑似为原发性肝癌、继发性肝癌等恶性肝占位性病变者、胆红素水平高于10 mg/dL、代偿性肝硬化,以及28 d内失访。患者不配合而HVPG 测量失败或测量不准确的患者也被排除在本研究之外。最终,所有患者随访持续至2022年10月30日。本研究方案经由上海市同仁医院伦理委员会批准通过,所有患者均被告知本研究的目的、HVPG 检查的风险并签署知情同意书。
二、临床资料
一般资料:记录患者姓名、性别、年龄、住院号、联系方式及疾病病因、诊断信息。实验室检查:患者入院初次血清学指标,包括胆红素、凝血时间、血肌酐、白细胞、血小板、白蛋白、转氨酶、血钠。在失代偿性肝硬化患者中,临床上3期或4期的分期依据为是否存在腹水或门静脉高压性消化道出血。临床3期定义为出现腹水伴或不伴有门静脉高压性消化道出血病史,第4期定义为伴有或不伴有腹水的门静脉高压性消化道出血。腹水组包括腹水患者,即临床3期(腹水)和部分4期(门静脉高压性消化道出血和腹水)患者。 在HVPG测量当天计算每位患者的MELD评分。
三、HVPG的测量
HVPG 测量由上海长征医院介入科完成。在透视引导下,一根6-Fr球囊尖端导管通过放置在右颈内静脉中的7-Fr护套插入并进入右肝静脉。使用内置于患者监测设备中的电子气压计分别测量球囊收缩和膨胀期间的游离和楔入肝静脉压力。测量是在距离右肝静脉和下腔静脉交界处不到5 cm的位置进行的。所有测量结果为3次测量的平均值。 HVPG 通过从肝静脉闭塞压中减去肝静脉自由压来确定。
四、统计学分析
采用SPSS 24.0 进行统计分析。首先对本研究纳入的患者的一般流行病学、临床和实验室特征进行描述性统计。使用 Shapiro-Wilk检验对定量变量分布的正态性进行评估。正态分布的变量表示为均值和标准差,定性变量以数量和百分比(%)表示。根据临床或亚临床阶段,使用独立的t检验或方差检验比较连续变量的组间差异。根据随访时间长短,采用接受者操作特征曲线下面积(AUROC)的方法分析MELD评分和HVPG预测预后的准确性。使用X-tile软件分析得出连续性变量的最佳截止值,Kaplan-Meier方法与对数秩检验一起用于计算生存率[5]。在Cox回归模型中使用评分和 HVPG变量评估性别、年龄、肝硬化病因、静脉曲张出血史、腹水、血小板计数、白蛋白、胆红素、凝血酶原时间国际标准化比值(INR)、肌酐、钠、MELD等预后预测因子与长期死亡率的相关性,并获得每个独立预测因素的风险比(HR)。使用单因素分析中差异有统计学意义的变量进行分析,得出多变量模型。P<0.05为差异具有统计学意义。
结 果
一、基本资料
共纳入患者51例,平均年龄为(55.88±10.65)岁,男性稍多(53.8%)。病因分别为酒精(17.3%)、乙型肝炎(36.5%)、丙型肝炎(3.8%)、其他(40.4%)。其中17例(32.7%)为临床3期,34 例(65.4%)为临床4期;24例无腹水,10例有腹水。根据CTP评分,19例为 A 级,29例为B级,3例为C级。MELD 评分为9.82±3.67,HVPG测量平均值为(20.68±9.02)mmHg。实验室检查结果为:胆红素(1.61±1.20)mg/dL、INR(1.33±0.20)、肌酐(0.74±0.20)mg/dL、白细胞(3.5±2.06)×109/L、血小板(92±72.65)×109/L、白蛋白(32.62±6.24)g/L、ALT(44.25±82.40)U/L、AST(50.72±62.90)U/L、γGT(67.2±109.22)U/L、Na(139.73±3.81)mmol/L。
二、HVPG和MELD预测患者的总体死亡率
中位随访期间为 51(1~103)个月,51例患者中有16例 (31.4%) 死亡。 死亡原因为肝肾综合征(n=8)、食管胃底静脉曲张出血(n=4)、肝性脑病(n=2)、缺血性肠病(n=1)和脑出血(n=1)。 HVPG 预测总体死亡率的 AUROC 为 0.729 (图1); 而 MELD 评分预测总死亡率的 AUROC为 0.687。 HVPG 预测所有 DC 患者长期总体死亡率的最佳临界值为19 mmHg。根据 HVPG 水平进行分层生存分析中,失代偿性肝硬化患者的总体死亡率差异有统计学意义:HVPG ≤ 19 mmHg 的患者死亡率显著低于HVPG >19 mmHg者(P=0.005,见图2)。

图1 HVPG及MELD评分预测失代偿性肝硬化患者预后的ROC曲线

图2 X-tile方法估计HVPG水平与患者生存率之间的相关性
三、失代偿期肝硬化死亡率的预测因素分析
在死亡的失代偿期硬化患者的单因素COX变量分析中,胆红素 (HR:1.928; 95%CI:1.381~2.692;P<0.001)、ALT (HR:0.907; 95%CI:0.833~0.986;P=0.022)、CTP评分 (HR:1.485; 95%CI:1.068~2.066;P=0.019)、HVPG (HR:1.051;95%CI:1.093~1.112;P=0.026) 和 MELD 评分 (HR:1.131;95%CI:1.08~1.306;P=0.032) 与长期死亡率显著相关。在使用多因素Cox回归模型分析中,只有 HVPG (HR:1.079; 95%CI:1.009~1.15;P=0.027) 和 胆红素(HR:2.348;95%CI:1.336~4.127;P=0.003)显著相关(表1)。
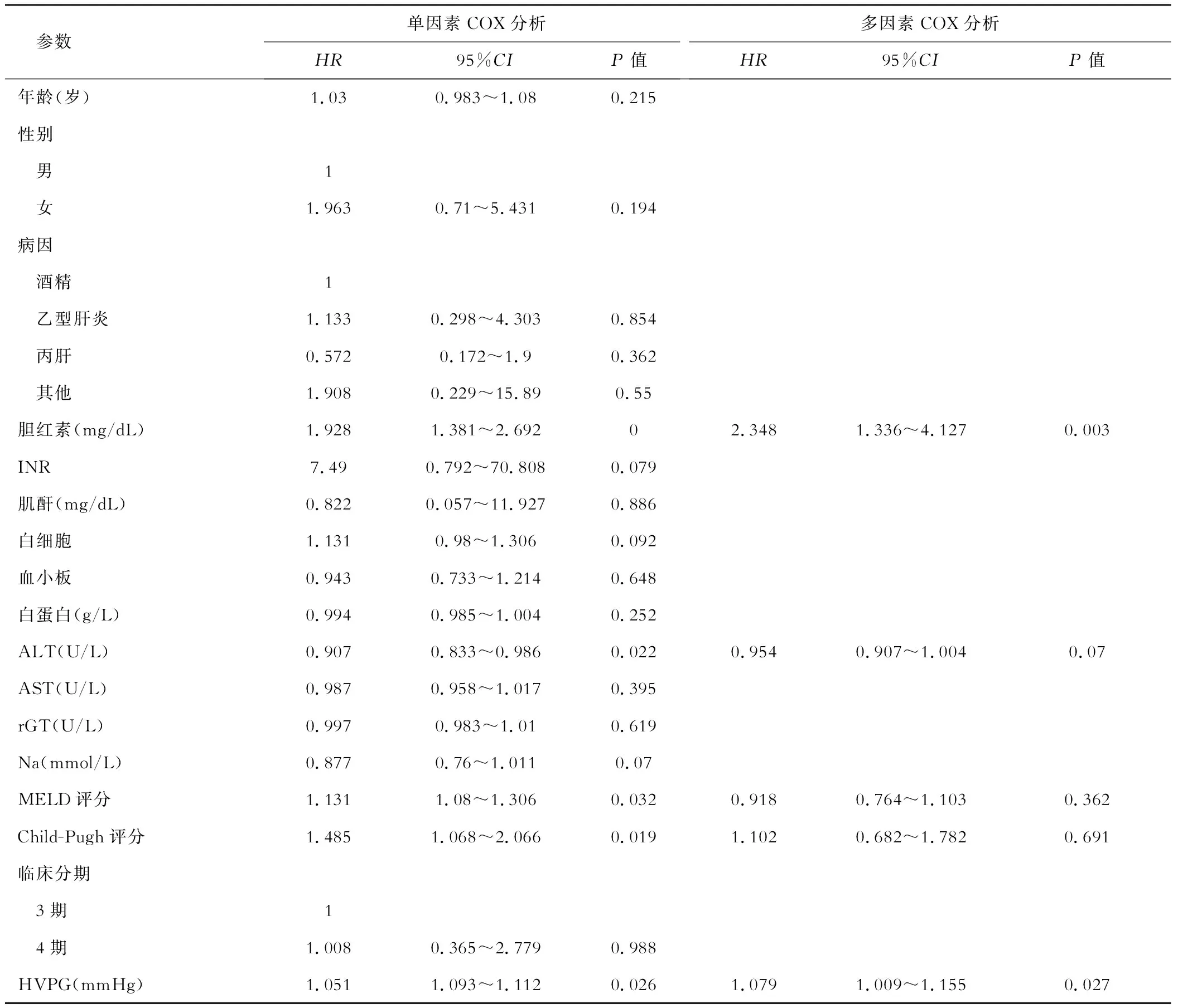
表1 失代偿性肝硬化患者的单因素及多因素COX分析
讨 论
在临床上,失代偿性肝硬化定义为肝组织严重受损,患者出现肝功能减退和门静脉高压两类主要的临床表现的阶段[9]。在本研究中,HVPG 值与长期死亡率密切相关(AUROC=0.729),可以预测失代偿性肝硬化患者的总体死亡率。荟萃分析结果显示,将 HVPG从基线降低至少20%或降至≤12 mmHg,可以减少静脉曲张出血和并发症(如腹水和自发性细菌性腹膜炎)的发生,并且还与死亡率降低相关[9-10]。然而,HVPG 在失代偿性肝硬化患者中的作用仍存在争议。本研究的这些结果表明,即使在失代偿性肝硬化患者中,HVPG 的测量对于预测肝硬化患者的长期死亡率很有效。然而,这些发现不一定适用于危重型的失代偿性肝硬化患者,因为本研究中仅纳入了非危重失代偿性肝硬化患者。
在临床实践中,MELD评分被广泛用于评估肝硬化患者的预后,而HVPG的使用报道较少。此外,失代偿性肝硬化患者的HVPG和MELD评分之间的比较研究表明,其在预测长期死亡率的能力方面存在不同结果[5,11]。Suk等[12]研究表明,HVPG 在预测死亡率方面可能比MELD更有用,而其他研究表明,HVPG对MELD评分没有额外影响[13-14]。我们的研究表明,HVPG预测总体死亡率的能力较MELD评分更高。研究发现,较高的HVPG是失代偿性肝硬化患者生存的独立危险因素,HVPG每增加1 mmHg会导致患者死亡风险增加3%[15]。多项研究发现,高于16 mmHg或18 mmHg的HVPG值是一个重要的肝硬化腹水患者不良预后的预测因子[16-17]。在这些研究中,HVPG的预后价值在失代偿性肝硬化患者较为明确[18]。同样,我们发现19 mmHg是作为HVPG预测失代偿性肝硬化患者长期死亡风险的最佳区分临界值。
本研究还是有一定的局限性。首先,本研究是在单中心进行的,患者人数相对较少,在入组时病情并不危重。此外,随访时间不长,肝硬化的原因各不相同,大多数病例是由肝炎、酒精引起的,从而限制了在其他少见病因上的应用。另一个局限性是该研究仅考虑了HVPG在全因死亡率中的作用,并未考虑其他主要并发症对预后的影响。今后需要通过长期前瞻性多中心研究进一步验证。
利益冲突声明:所有作者均声明不存在利益冲突。
