一例HP-PRRSV 与NADC30-like 毒株混合感染的实验室诊断
2023-07-20王祝荣熊连文敏华
王祝荣,熊连,文敏华
(1.湖南省长沙市雨花区农业农村局,湖南 长沙 410013;2.浏阳市农业农村局,湖南 浏阳 410300)
猪繁殖障碍综合征病毒(PRRSV)感染可导致猪繁殖与呼吸综合征(PRRS),该病又称为猪蓝耳病,该病的流行对全世界养猪业的健康发展造成巨大的威胁。PRRSV 感染主要导致高热和呼吸困难(仔猪)、繁殖障碍(妊娠母猪)、呼吸道症状和生长迟缓(育肥猪)等。此外,该病可导致猪群免疫抑制,不但影响疫苗免疫效果,同时使猪群对其他病原更加易感,继而导致更严重的临床症状和病死率[1-2]。
2006 年,国内南方各省部分猪场相继暴发猪高热病(伴随高病死率),进一步分析发现其病原为PRRSV 变异株(HP-PRRSV),与2006 年之前流行的PRRSV 经典株相比,变异株Nsp2 基因存在特征性氨基酸序列缺失[3]。2013 年,国内部分猪场开始流行类NADC30 株,该毒株Nsp2 基因序列存在131 个不连续氨基酸缺失,且目前该毒株在我国广泛流行[4]。2017 年,我国东北部分猪场开始流行类NADC34 株,该毒株Nsp2 基因存在100 个氨基酸缺失[5]。多种基因型PRRSV 在我国广泛流行,导致部分猪场同时流行多种基因型PRRSV 十分常见,进而使得该病的防控与净化更加困难。
2022 年10 月中旬,湖南长沙某规模化猪场暴发疑似PRRS 疫情,经实验室诊断确定该病由HP-PRRSV 和类NADC30 株混合感染引起,该诊断结果为猪场PRRS 的防治提供了科学依据。
1 发病猪场情况
湖南长沙某规模化猪场存栏母猪千余头,2022年10 月初,该场部分妊娠母猪出现疑似繁殖与呼吸综合征,由于该场长期使用PRRSV 弱毒疫苗防控PRRS,猪场负责人认为妊娠母猪流产可能是猪群免疫弱毒疫苗所致。10 月中旬,该场仔猪和保育猪陆续开始发病,主要临床症状包括高热、咳嗽和呼吸困难等,病死率近40%。为确诊病因,剖检发病仔猪,采集部分脏器(肺脏、肾脏和淋巴结)和流产胎儿送至我处进行病原检测。
2 实验室诊断
2.1 细菌分离鉴定结果
超净工作台下,用灭菌手术刀切取少量肺脏、肺脏和淋巴结组织样品于研钵内,加入少量灭菌生理盐水后,研磨后用灭菌纱布过滤研磨液,将滤液置于洁净离心管内。用灭菌接种环蘸取少量滤液,分别在普通固体营养琼脂培养基和鲜血固体琼脂培养基平板划线,其后将平板倒扣在37℃恒温箱内,16 h 后检测两种培养基表面是否存在疑似菌落。结果发现,两种培养基表面均未出现疑似菌落,提示猪群发病并非细菌性病原感染引起。
2.2 病毒性病原检测结果
为探究该场暴发疫病是否由病毒性病原感染引起,采用商业化核酸提取试剂盒(南京诺唯赞生物科技股份有限公司产品)提取组织上清DNA 和RNA 基因组。应用商业化病原检测试剂盒(湖南冠牧生物科技有限公司产品),采用qPCR 法分别检测样品DNA 基因组中是否存在猪圆环病毒Ⅱ型、猪圆环病毒Ⅲ型和猪伪狂犬病毒核酸;采用RT-qPCR 法分别检测样品RNA 基因组中是否存在猪瘟病毒、猪细小病毒、不同基因型PRRSV(经典株、HP-PRRSV 和类NADC30 株)等常见RNA 病毒核酸。病原检测步骤和结果判定标准均严格按照试剂盒说明书进行。最后结果显示,病料样品为HP-PRRSV 和类NADC30 株核酸阳性,其他病原核酸均为阴性。
2.3 HP-PRRSV 和类NADC30 株Nsp2 基因RTPCR 扩增与序列分析
为分析该猪场流行HP-PRRSV 和类NADC30株遗传变异情况,以商业化试剂盒将RNA 基因组逆转录为cDNA。设计并合成靶向扩增PRRSV Nsp2基因引物,采用RT-PCR 法扩增病料样品cDNA 基因组PRRSV Nsp2 基因序列。反应体系(25.0 μL)包括2×PCR 预混液12.5 μL、上游引物0.5 μL、下游引物0.5 μL、cDNA 模板2.0 μL 和无RNA 酶水9.5 μL;反应条件为94℃5 min;94℃30 s,56℃30 s,72℃30 s,共35 个循环;最后为72℃5 min。反应结束后将RT-PCR 产物进行琼脂凝胶电泳。结果如图1 所示,靶向HP-PRRSV Nsp2 基因序列RT-PCR 产物大小约750 bp,靶向类NADC30 株对应序列产物大小约为450 bp,且阴性和阳性对照均成立,提示我们成功扩增获得该场HP-PRRSV 和类NADC30 流行株Nsp2 基因部分序列。其后,分别切取750 bp 和450 bp 处凝胶,凝胶回收获得RT-PCR 产物基因组,将其送至生物公司测序。
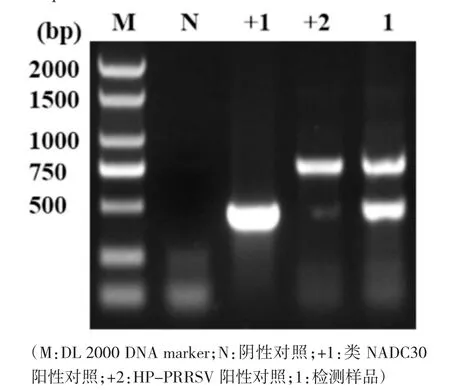
图1 临床样品PRRSV Nsp2 基因部分序列RT-PCR产物凝胶电泳结果
测序结果返回后,将测序结果与NCBI 参考序列进行核苷酸序列比对。结果发现,该场流行HP-PRRSV 株与NCBI 收录的HP-PRRSV 弱毒疫苗株(HuN4-F112)同源性最高,流行的类NADC30株则与NCBI 收录的已知NADC30 株同源性最高。以上结果再次确定该场疫情是由HP-PRRSV 和类NADC30 株混合感染所致。
3 讨论
自2006 以来,HP-PPRSV 广泛流行给养猪业造成巨大经济损失,近年来PRRSV 其他基因亚型(如类NADC30 和类NADC34 株)的流行也引起了养猪业广泛的关注。同一地区流行多种基因亚型PRRSV 株十分常见,如河北省同时流行类NADC34、类NADC30、HP-PRRSV 和PRRSV 经典株等亚型[6],这导致同一猪场流行多种基因亚型PRRSV 株也时常发生[7]。可导致妊娠母猪繁殖障碍的病原种类繁多,传统的临床诊断无法对病原进行确诊,甚至因误诊或漏诊延误疾病的治疗,导致巨大的经济损失。实验室诊断技术(如细菌分离鉴定和PCR 法)可在短时间内确诊致病原,甚至对部分病原可进行基因分型和遗传进化分析,这有利于疾病的防控和疫苗选择。
在本案例中,笔者采用实验室相关技术对一例疑似PRRS 案例进行诊断,发现采集病料样本为HP-PPRSV 和类NADC30 核酸阳性,其他病毒性病原和细菌性病原均为阴性,提示该场所发生疫情是由HP-PRRSV 和类NADC30 混合感染引起。值得注意的是,首先,猪场兽医在初期已对发病猪群进行抗生素治疗,尽管没有检测到细菌性病原,但不能确定该场未出现细菌性病原继发感染;其次,该场处于PRRSV 不稳定场,故而该场长期使用PRRSV 弱毒疫苗(HuN4-F112 株)防控PRRS,虽然病原检测结果发现病料中存在HP-PRRSV 和类NADC30 核酸,尚不能判断HP-PRRSV 是野毒还是疫苗毒株。
HP-PRRSV 和类NADC30 株ORF5 基因氨基酸序列大小基本一致,但类NADC30 株Nsp2 基因较HP-PRRSV 少131 个氨基酸,因此可采用RT-PCR 法扩增Nsp2 基因区分HP-PRRSV 和类NADC30 株[7]。在本文中,我们采用RT-PCR 扩增同一份病料HP-PRRSV 和类NADC30 株Nsp2 基因序列,发现HP-PRRSV 和类NADC30 株对应RT-PCR 产物大小分别约为750 bp 和450 bp,其后切胶回收后将产物分别测序与序列分析。发现该场检测的HP-PRRSV 株Nsp2 基因序列与弱毒疫苗株(HuN4-F112 株)同源性最高,提示其可能为弱毒疫苗株。
近年来,类NADC30 株在国内流行情况逐渐严重,已有研究证实基于HP-PRRSV 研发的弱毒疫苗对类NADC30 防控能力有限,因此猪场应该谨慎选择HP-PRRSV 弱毒疫苗用于类NADC30 株的防控。对于PRRSV(包括类NADC30 株)的防控应选择提高猪场生物安全水平、后备母猪驯化和PRRSV 阳性猪群淘汰等策略[7]。
参考文献:[1] 邓莉,阳坤,唐青海,等. 一例猪蓝耳病的实验室诊断[J].湖南畜牧兽医,2018(6): 17-21.
[2] 张艳,刘雪松,薛沾枚,等. 浅谈PCV2、PRRSV 和肺炎支原体间的相互作用[J].江西畜牧兽医杂志,2022(1):44-46.
[3]胡栋,朱迎春,赵清,等.1 株基因重组猪繁殖与呼吸综合征病毒的新型变异和遗传进化分析[J].中国兽医学报,2021,41(2):213-223.
[4] 崔志刚,于合宅. 一例类NADC30 猪繁殖与呼吸综合征病毒感染的诊断与防控[J].养猪,2022(6): 87-89.
[5]隆耀平,周军,肖璐,等.一株NADC34-like 猪繁殖与呼吸综合征病毒全基因组序列的分析[J].中国预防兽医学报,2022,45(5):544-549.
[6] 王福厚,葛生虎. 2022 年上半年河北省猪繁殖与呼吸综合征病毒流行病学调查及分析[J].养猪,2022, 184(05):108-110.
[7] 欧阳艳,马涛. 湖南汨罗一例类NADC30-like 和HP-PRRSV 毒株混合感染致猪繁殖与呼吸综合征的诊断[J]. 当代畜禽养殖业,2021(2):58-59.
