黑豆7S球蛋白提取工艺及抑制淀粉酶特性研究
2023-07-20孙丽娜张雅斐任顺成
孙丽娜,张雅斐,任顺成*
1.河南工业大学 河南省天然色素制备重点实验室,河南 郑州 450001
2.乐普(北京)医疗器械股份有限公司,北京 102200
经常食用高碳水化合物的食物会增加各种代谢综合征的风险,比如肥胖症、2型糖尿病等[1]。食物中的淀粉和糖原能被α-淀粉酶分解为葡萄糖和麦芽糖[2],从而导致血液中葡萄糖水平增加。抑制α-淀粉酶活性可有效控制血糖升高。有研究表明,植物性食物蛋白,比如大豆分离蛋白能有效抑制α-淀粉酶的活性[3]。通过抑制α-淀粉酶活性减缓淀粉消化、控制血糖升高已经成为当前研究的热点。
黑豆是我国重要的农作物之一,营养丰富,功效众多,有悠久的药食同源史[4-5],其蛋白含量高于40%,被称为“植物蛋白之王”[6]。7S球蛋白是黑豆蛋白的主要组分之一,又被称为β-伴大豆球蛋白,在球蛋白中占比1/3左右[7]。研究表明,黑豆蛋白有良好的生物活性[8-10](如抗氧化性)和优良的功能特性[11-13](如起泡性、乳化性等)。7S球蛋白对α-淀粉酶的抑制活性较好[14],可以延缓淀粉的消化。黑豆蛋白肽类具有降低脂肪生成的能力,可作为功能性成分应用到与减肥相关的产品上[15]。
碱提酸沉法具有成本低、操作简单等优点,是目前国内外提取黑豆7S球蛋白最主要的方法之一[16-17]。不同的提取条件会影响7S球蛋白的提取量及生物活性。目前,国内外有关碱提酸沉法提取7S球蛋白的研究主要集中在提取量和抗氧化性等方面[18-19],关于其抑制α-淀粉酶活性的作用鲜有报道,极大局限了黑豆资源的开发利用。
作者采用碱提酸沉法提取黑豆7S球蛋白,以液料比、提取pH值和氯化钠浓度为主要影响因素,以α-淀粉酶抑制率为指标,运用响应面法进行优化,研究提取条件对α-淀粉酶抑制活性的影响,并探究蛋白质量浓度、温度、酸碱度及淀粉质量浓度等因素对黑豆7S球蛋白的活性影响,进一步了解不同处理条件下该蛋白的活性变化。旨在提高黑豆的利用价值,为黑豆资源的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
黑豆:赣州康瑞农产品有限公司;3,5-二硝基水杨酸(DNS):国药集团化学试剂有限公司;猪胰腺α-淀粉酶、可溶性淀粉:上海源叶生物科技有限公司;石油醚、亚硫酸氢钠、氯化钠:郑州新丰化验器材有限公司。
1.2 仪器与设备
PHS-3C雷磁酸度计:上海仪电科学仪器股份有限公司;MVS-1旋涡混合器:北京金北德工贸有限公司;FA1004电子分析天平:上海上平仪器公司;TDL-5A台式低速离心机:江苏省金坛市医疗仪器厂;V-1600-B紫外可见分光光度计:上海美谱达仪器有限公司;SHZ-82数显水浴恒温振荡器:金坛华峰仪器有限公司。
1.3 试验方法
1.3.1 原料预处理
黑豆经筛选后进行粉碎,过60目标准筛。将黑豆粉与石油醚按体积比1∶3置于烧杯中,并用保鲜膜密封,常温下用磁力搅拌器搅拌4 h,倒去石油醚和脂肪,将沉淀部分自然风干,得脱脂黑豆粉,并于4 ℃冰箱中保存备用。
1.3.2 黑豆7S球蛋白的提取
参考Nagano等[20]使用的方法并进行优化:称取一定量的脱脂黑豆粉,按一定比例加入蒸馏水,室温下搅拌使其完全溶解。调pH值至7.5,3 500 r/min离心20 min,去沉淀,上清液中加入0.98 g/L的亚硫酸氢钠,搅拌溶解后,用1 mol/L的HCl或NaOH调pH值至6.4,4 ℃冷藏过夜。3 500 r/min离心20 min,去沉淀,在上清液中添加一定量的氯化钠,调pH值至5.0,3 500 r/min离心20 min,去沉淀;调节上清液的pH值,3 500 r/min离心20 min,倒去上清液,得黑豆7S球蛋白。冻干后备用。
1.3.3α-淀粉酶抑制活性的测定
食物进入肠胃后,淀粉被胰腺α-淀粉酶水解成麦芽糖和葡萄糖,它们均可被DNS还原,因此,可采用DNS比色法进行活性测定。取4支试管(25 mL)为一组,分别标记为样品管、样品对照管、空白管和空白对照管。样品管中加入250 μL、20 mg/mL的7S球蛋白溶液和α-淀粉酶溶液;样品对照管中加入250 μL的7S球蛋白溶液和蒸馏水;空白管中加入250 μL的α-淀粉酶溶液和蒸馏水;空白对照管中加入500 μL的蒸馏水。将试管放入37 ℃水浴恒温振荡器中振荡10 min,加入糊化后的1%小麦淀粉溶液500 μL,继续振荡10 min,再加入1 mL DNS试剂,沸水浴5 min,迅速取出在自来水下冲凉冷却,定容后在540 nm测定吸光度,重复3组平行。
α-淀粉酶抑制率=(1-(A1-A2)/(A3-A4))×100%,
式中:A1、A2、A3、A4分别代表样品管、样品对照管、空白管、空白对照管的吸光度。
1.3.4 单因素试验
1.3.4.1 液料比
称取50 g脱脂黑豆粉,固定氯化钠浓度为0.25 mol/L,提取pH 4.8,添加蒸馏水使液料比分别为8∶1、10∶1、12∶1、14∶1、16∶1(mL/g),提取黑豆7S球蛋白并测定α-淀粉酶的抑制率。
1.3.4.2 pH值
称取50 g脱脂黑豆粉,固定液料比为10∶1(mL/g),氯化钠浓度为0.25 mol/L,提取pH值设为4.0、4.2、4.4、4.6、4.8、5.0(提取pH值为5.0时前一个步骤的pH值设为5.2以沉淀杂质),提取黑豆7S球蛋白并测定α-淀粉酶的抑制率。
1.3.4.3 氯化钠浓度
称取50 g脱脂黑豆粉,固定液料比为10∶1(mL/g),提取pH为4.8,分别加入0、0.10、0.15、0.20、0.25、0.30 mol/L的氯化钠,提取黑豆7S球蛋白并测定α-淀粉酶的抑制率。
1.3.5 响应面优化试验
根据单因素试验结果,选取液料比、提取pH值、氯化钠浓度为影响因素,以α-淀粉酶抑制率为响应值,设计响应面优化试验。
1.3.6 影响α-淀粉酶抑制活性的因素研究
1.3.6.1 7S球蛋白质量浓度对α-淀粉酶抑制率的影响
用0.2 mol/L的磷酸盐缓冲液(pH 6.8)将7S球蛋白配制成0.1、0.5、1、5、10、15、20 mg/mL的样品溶液,用1.3.3方法探究7S球蛋白质量浓度对其抑制α-淀粉酶活性的影响。
1.3.6.2 温度对α-淀粉酶抑制率的影响
用0.2 mol/L的磷酸盐缓冲液(pH 6.8)配制7S球蛋白溶液,并分别置于20、30、40、50、60、70、80、90 ℃的恒温水浴锅中,30 min后取出冷却至室温,用1.3.3方法探究温度对7S球蛋白抑制α-淀粉酶活性的影响。
1.3.6.3 pH值对α-淀粉酶抑制率的影响
配制pH值为2、3、4、5、6、7、8、9的缓冲液(pH值为2、3、4、8、9用HCl和NaOH配制,其他用磷酸盐溶液配制),用不同pH值的缓冲液配制7S球蛋白溶液,静置2 h,用1.3.3方法探究pH值对7S球蛋白抑制α-淀粉酶活性的影响。
1.3.6.4 淀粉质量浓度对α-淀粉酶抑制率的影响
用0.2 mol/L的磷酸盐缓冲液(pH 6.8)配制质量浓度分别为10、20、30、40、50、60 mg/mL的淀粉溶液,于90 ℃恒温水浴锅糊化30 min,用1.3.3方法探究淀粉质量浓度对7S球蛋白抑制α-淀粉酶活性的影响。
1.4 数据处理与分析
采用SPSS 26对试验数据进行显著性分析,Design-Expert 8.0进行方差分析,使用Origin 2021绘图。
2 结果与讨论
2.1 单因素试验
2.1.1 液料比对α-淀粉酶抑制率的影响
由图1可知,随着液料比的增大,α-淀粉酶抑制率呈先增大后减小的趋势。液料比为12∶1时,α-淀粉酶抑制率达到峰值,此时与液料比14∶1时的抑制率差异不显著,液料比继续增大时,α-淀粉酶抑制率急剧降低。这可能是因为随着溶剂比例的增大,提取出的活性物质逐渐增加,在液料比12∶1时基本浸提完全。而当液料比进一步增大时,提取的活性物质在两相中比例减少,进而对α-淀粉酶的抑制率降低[21]。因此,液料比为12∶1(mL/g)提取7S球蛋白最为适宜。
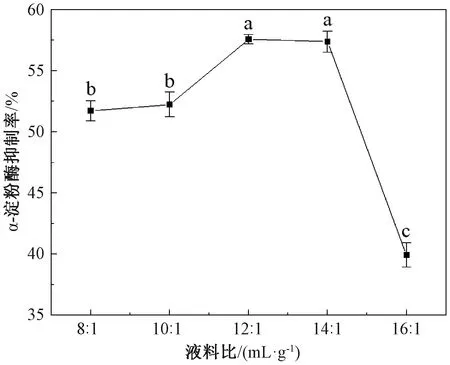
注:不同小写字母表示差异显著(P<0.05)。图2—图3同。
2.1.2 pH值对α-淀粉酶抑制率的影响
由图2可知,pH 4.0~5.0时,α-淀粉酶抑制率先增大后减小,在pH 4.8时达到峰值,pH值增大至5.0时,α-淀粉酶抑制率略微下降,差异不显著。可能是因为pH 4.8时最接近该物质的等电点,活性物质析出最多;而当pH值过大或过小时,会影响及破坏蛋白的结构,从而降低蛋白活性[22]。因此,在pH 4.8时提取7S球蛋白最为适宜。
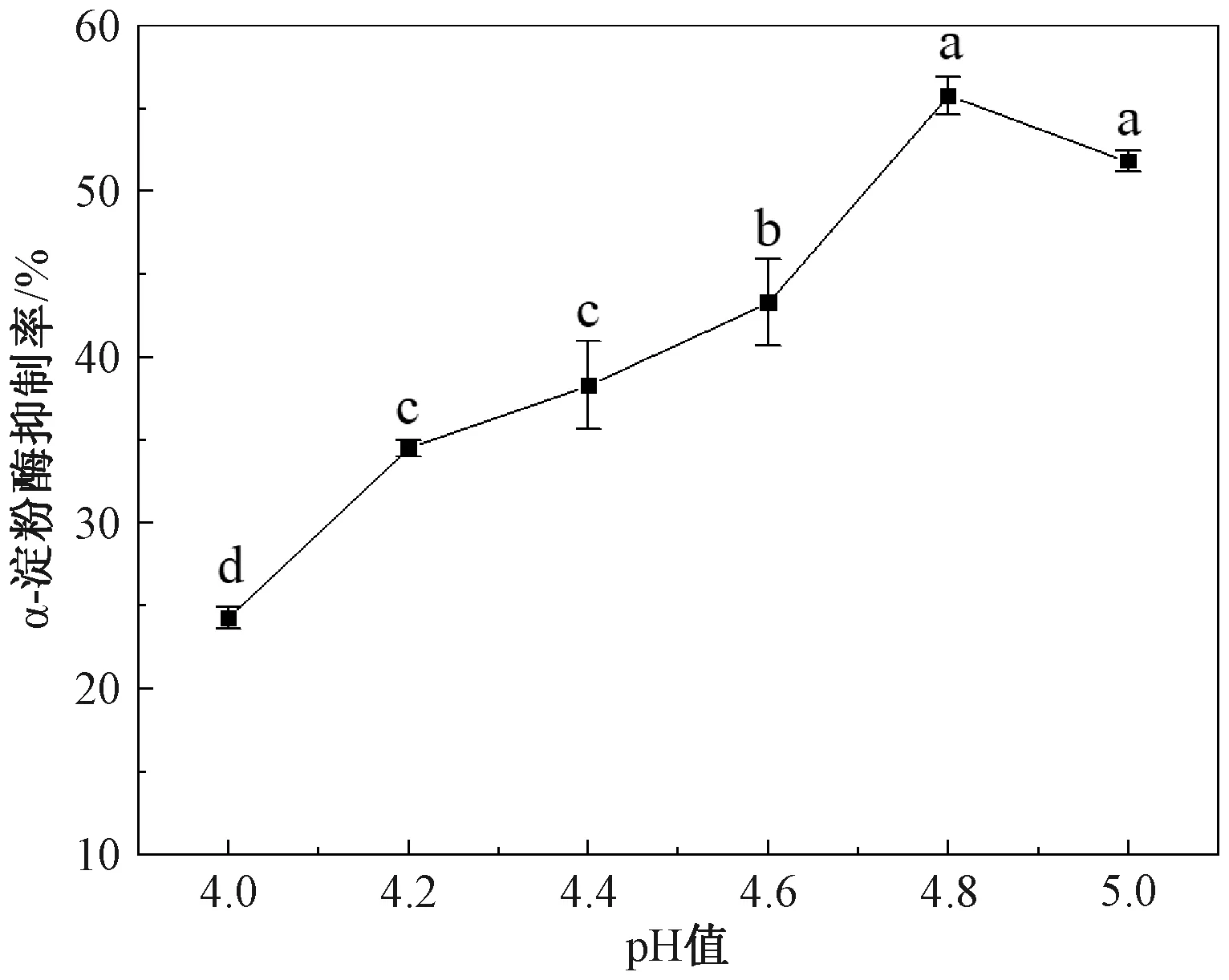
图2 pH值对α-淀粉酶抑制率的影响
2.1.3 氯化钠浓度对α-淀粉酶抑制率的影响
由图3可知,当氯化钠浓度从0 mol/L增加到0.3 mol/L时,7S球蛋白对α-淀粉酶的抑制率先增大后减小,在0.15 mol/L时达到峰值。可能是因为盐离子会影响溶液的离子强度,导致溶液发生盐溶或盐析作用。适量的盐离子可以增加活性基团的稳定性,而当其浓度过大时,活性基团会遭到破坏,从而降低对α-淀粉酶的抑制率[23]。氯化钠浓度0.15 mol/L时,与其他浓度的添加量差异显著。因此,选用0.15 mol/L的氯化钠提取7S球蛋白。
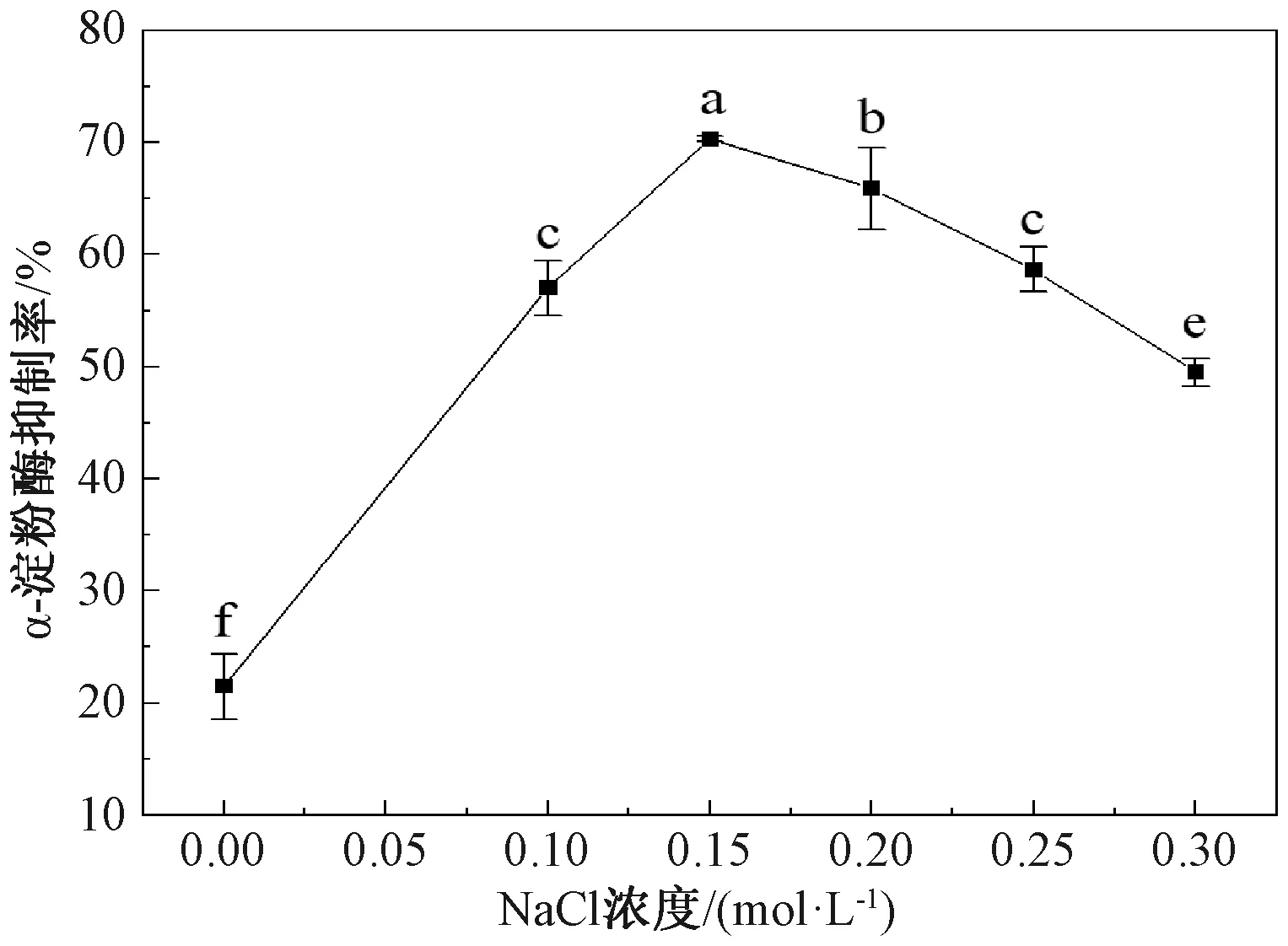
图3 NaCl浓度对α-淀粉酶抑制率的影响
2.2 响应面优化试验
2.2.1 响应面优化试验设计与结果
根据单因素试验结果,以液料比(A)、提取pH值(B)、氯化钠浓度(C)为考察因素,以α-淀粉酶抑制率(Y)为响应值,采用Design-Export 8.0软件,用Box-Behnken方法设计试验方案,试验设计及结果见表1,回归方差分析见表2。
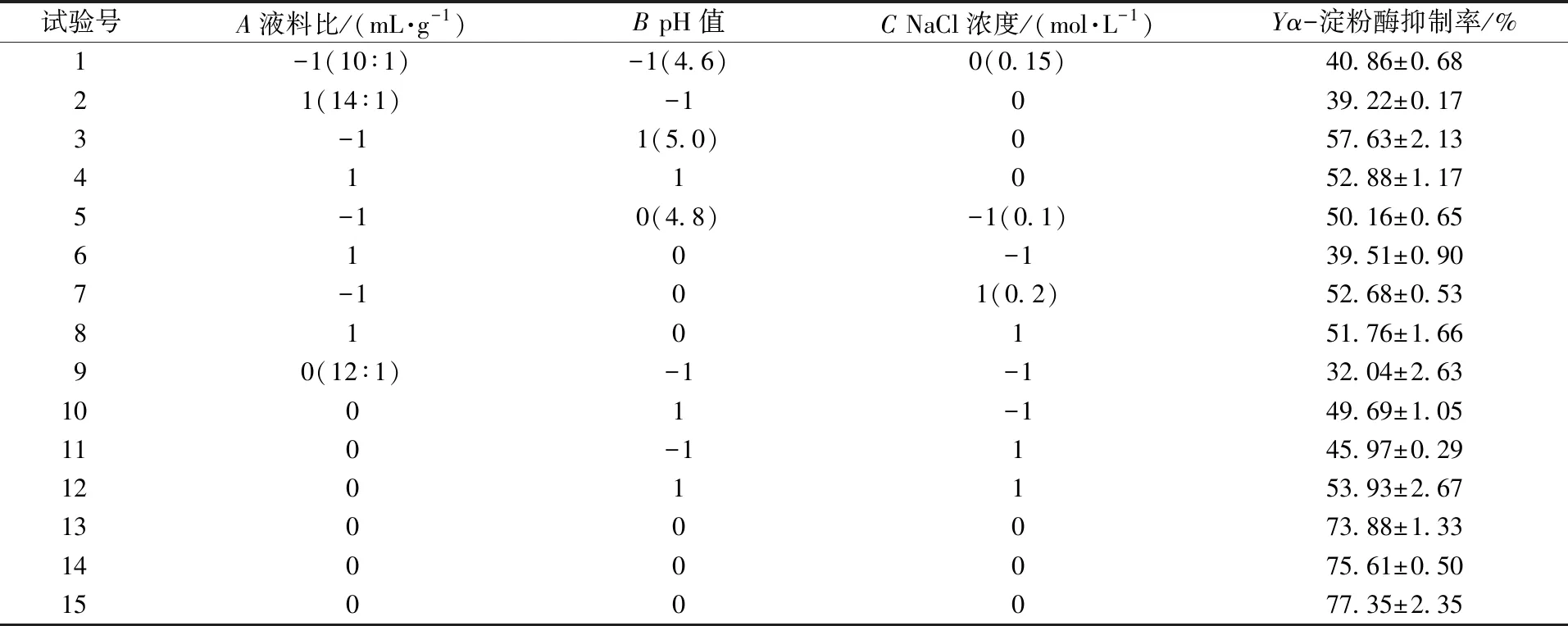
表1 响应面试验设计及结果
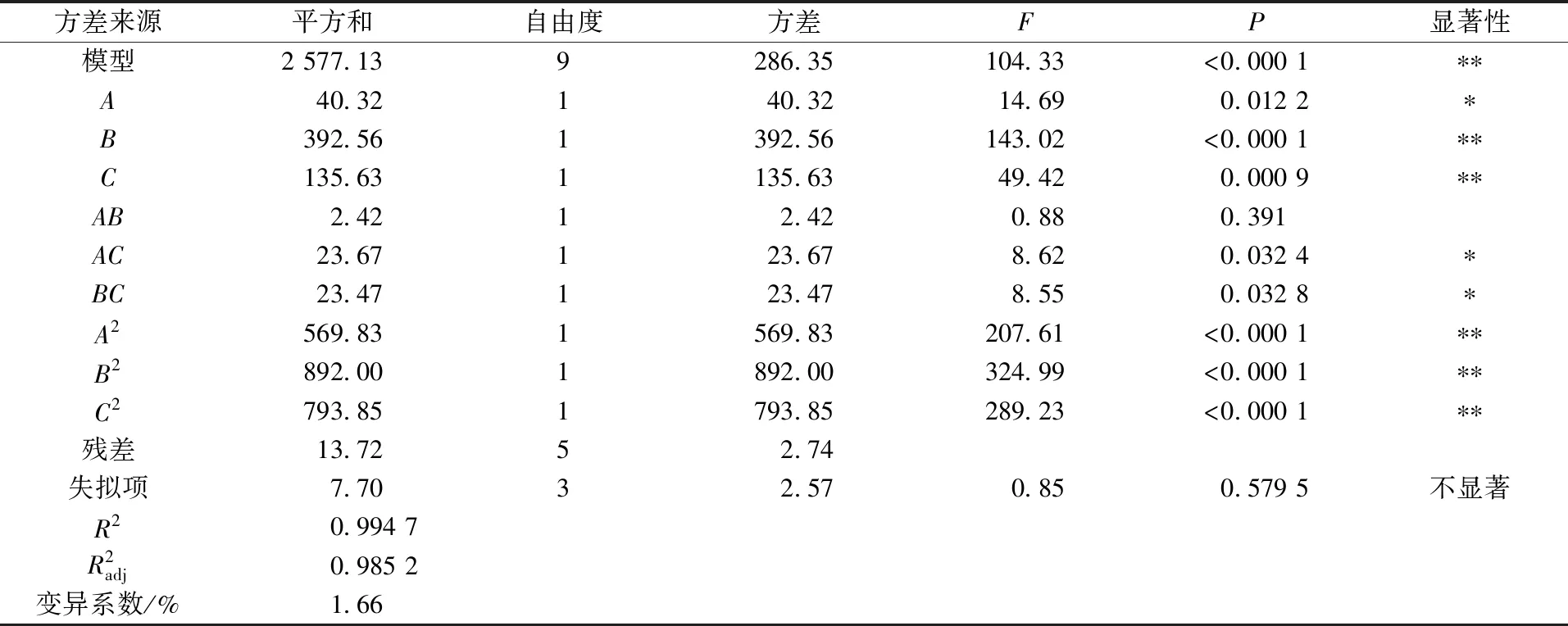
表2 回归方差分析
以α-淀粉酶抑制率为响应值,对响应结果进行回归拟合分析,得回归方程:
Y=75.61-2.25A+7B+4.12C-0.78AB+2.43AC-2.42BC-12.42A2-15.54B2-16C2。

2.2.2 响应面模型的验证
根据Design-Export 8.0分析,在液料比13.5∶1,提取pH 4.84、氯化钠浓度0.16 mol/L时,预测α-淀粉酶抑制率为68.09%。调整实际工艺参数:液料比13∶1,提取pH 4.8、氯化钠浓度0.16 mol/L,进行验证试验,得到α-淀粉酶抑制率为70.51%,与理论预测值相差<3%。此提取工艺的可靠、有效,对实际生产具有指导意义。
2.3 抑制α-淀粉酶活性的影响因素分析
2.3.1 7S球蛋白质量浓度对α-淀粉酶抑制率的影响
由图4可知,7S球蛋白的质量浓度越大,对α-淀粉酶的抑制效果就越强。当7S球蛋白质量浓度大于5 mg/mL时,α-淀粉酶抑制率线性上升。当7S球蛋白质量浓度为20 mg/mL时,抑制率达到75.38%,高于贾光锋等[24]制得的白芸豆AAI粗制品对α-淀粉酶的抑制率(43%)。

图4 7S球蛋白质量浓度对α-淀粉酶抑制率的影响
2.3.2 温度对α-淀粉酶抑制率的影响
由图5可知,30~60 ℃时,7S球蛋白具有α-淀粉酶抑制活性,且在30 ℃时抑制活性最好。当温度升到70 ℃时,7S球蛋白对α-淀粉酶的抑制率为0,此时7S球蛋白已经完全失活。表明7S球蛋白属于热敏性蛋白。
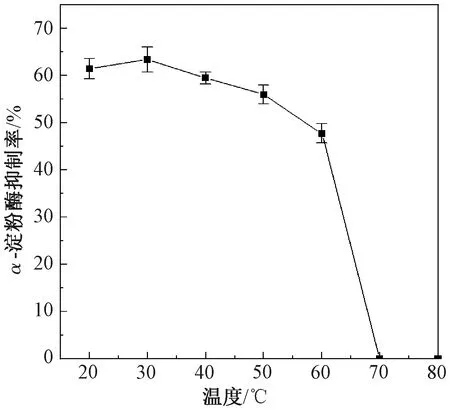
图5 温度对α-淀粉酶抑制率的影响
2.3.3 pH值对α-淀粉酶抑制率的影响
由图6可知,当pH 3~9时,7S球蛋白对α-淀粉酶均具有一定的抑制活性,且pH 5~8时抑制效果较佳。当pH值下降到2时,7S球蛋白完全丧失抑制活性。说明pH 3~9时,7S球蛋白有较好的酸碱耐受性。姜彩霞等[25]研究发现白芸豆α-淀粉酶抑制蛋白在pH 2~10时活性稳定性较高,与本研究结果类似。
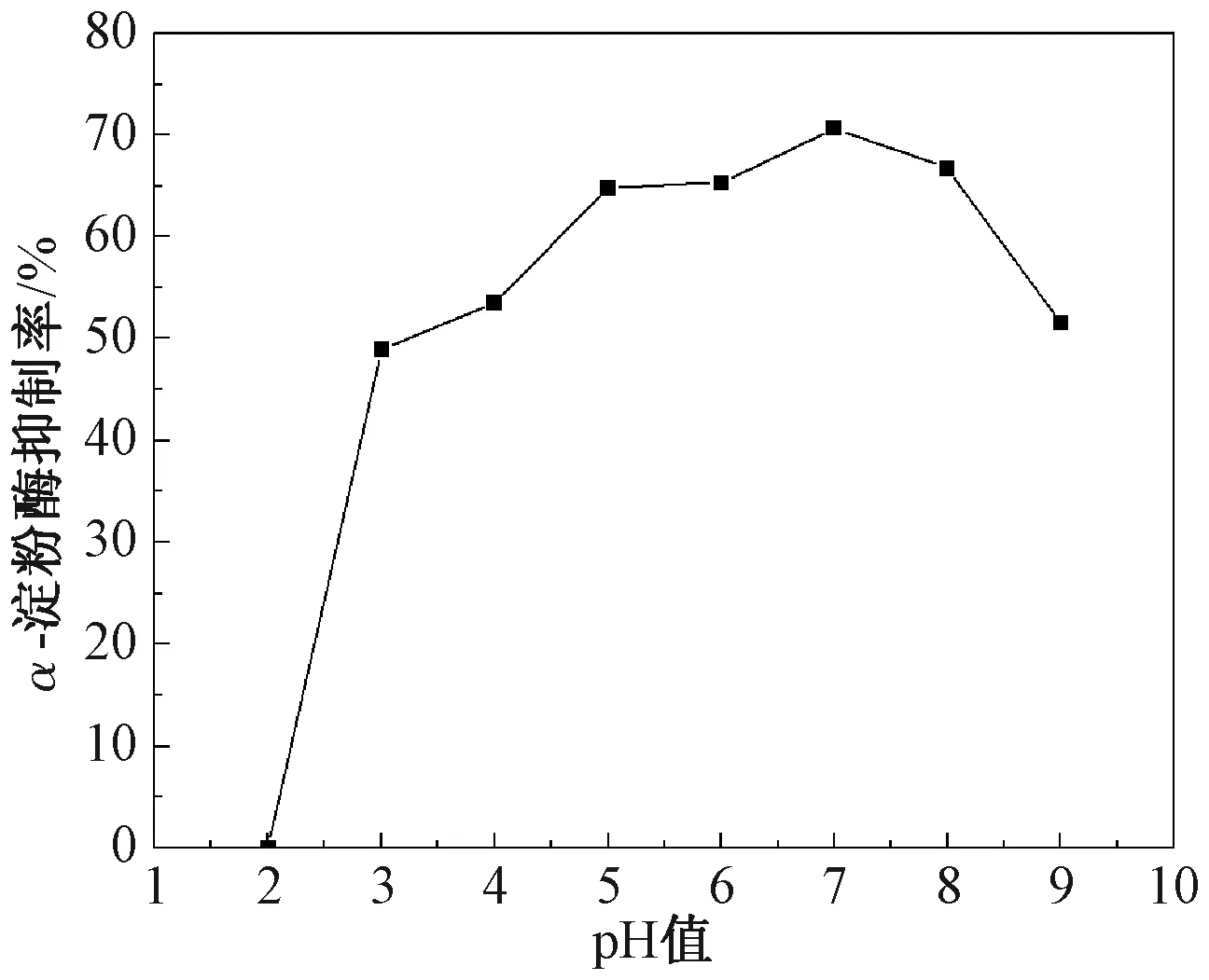
图6 pH值对α-淀粉酶抑制率的影响
2.3.4 淀粉质量浓度对α-淀粉酶抑制率的影响
由图7可知,淀粉质量浓度从10 mg/mL增加到60 mg/mL时,7S球蛋白对α-淀粉酶的抑制率变化不大。这可能跟7S球蛋白的抑制类型有关,当抑制类型为非竞争性抑制时,底物浓度的改变对抑制程度无影响[26]。表明7S球蛋白对α-淀粉酶的抑制类型可能为非竞争性抑制。由于淀粉质量浓度对α-淀粉酶的抑制率影响不大,为降低成本和原料,可选择低质量浓度淀粉测定α-淀粉酶的抑制活性。
3 结论
采用单因素和响应面优化试验,确定了提取7S球蛋白的最优工艺:提取液料比13∶1(mL/g),提取pH 4.8,氯化钠浓度0.16 mol/L,在此条件下7S球蛋白对α-淀粉酶的抑制效果最佳,可达到70.51%。通过对影响7S球蛋白抑制α-淀粉酶的因素进行研究可知,7S球蛋白的质量浓度越大,对α-淀粉酶的抑制效果越好;7S球蛋白为热敏性蛋白,在70 ℃及以上即会失活,在30 ℃抑制活性较好;pH 3~9时,7S球蛋白有较好的酸碱耐受性,pH值低于3时,7S球蛋白失活;淀粉质量浓度对α-淀粉酶抑制率没有明显影响,这可能跟7S球蛋白的抑制类型有关,后续可对7S球蛋白对α-淀粉酶的抑制类型进行探究。7S球蛋白对α-淀粉酶存在较好的抑制活性,可在降血糖、肥胖症等方面得到广泛应用,并可为黑豆中7S球蛋白的综合利用提供理论参考。
