木犀草素抑制NF-κB 增敏TRAIL 诱导肝癌HepG2 细胞凋亡作用的研究
2023-07-19吴文明侯雄军胡建新
吴文明,侯雄军,何 洁,胡建新
[江西省人民医院(南昌医学院第一附属医院)药学部,江西 南昌 330006]
木犀草素为3’,4’,5,7-四羟基黄酮,广泛存在于各种天然药用植物和蔬菜果实中。木犀草素已被证明具有抗癌活性,如诱导细胞凋亡、细胞周期停滞及血管生成抑制等[1-2]。研究表明,木犀草素具有增敏(包括TRAIL 在内的TNF 家族凋亡分子诱导多种人癌细胞凋亡)的作用,其增敏作用与下调NF-κB 表达、上调DR5 水平、抑制蛋白激酶活性以及降解XIAP 有关[3-5]。木犀草素具有安全低毒的特点,使其成为化疗增敏剂的理想候选物[3]。目前,尚没有关于木犀草素通过抑制NF-κB 活性,从而增敏TRAIL 诱导肝癌HepG2 细胞凋亡的相关研究。因此,本研究以亚细胞毒性浓度的木犀草素为研究对象,探讨其抑制NF-κB 的活性,从而增敏TRAIL 诱导人肝癌HepG2细胞凋亡的作用,为木犀草素联合TRAIL 临床治疗肝细胞肝癌提供理论基础和实验依据。
1 材料和仪器
1.1 细胞株
人肝癌HepG2 细胞(货号:CL-0103,武汉普诺赛科技有限公司)。
1.2 药物与试剂
木犀草素(HY-N0162,MCE);TRAIL(C022,Novoprotein);DMEM 培养基(含双抗,KGM12800S,凯基生物);胎牛血清(A8020, Solarbio);1× PBS(0.01M,pH = 7.4)(KGB5001,凯基生物);CCK-8法细胞增殖检测试剂盒(KGA317,凯基生物);Annexin V-APC/7-AAD 细胞凋亡试剂盒(AP105-100kit,联科生物);细胞周期染色试剂盒(CCS102,联科生物);BCA Protein Assay Kit(E-BC-K318-M,Elabscience);Marker(#26617,美国赛默飞);内参一抗:Mouse Anti-β-Actin(HC201,TransGen Biotech,1/2 000);二 抗:HRP conjugated Goat Anti-Mouse IgG (H+L)(GB23301,Servicebio,1/2 000);目的 一 抗:Mouse Anti NF-κB p65 (66535-1-Ig,Proteintech,1/500),Rabbit Anti IκBα(10268-1-AP,Proteintech,1/1 000),Rabbit Anti p-IκBα(AF2002,Affinity,1/1 000);二抗:HRP conjugated Goat Anti-Rabbit IgG (H+L)(GB23303,Servicebio,1/2 000)。
1.3 主要仪器
BPN-80CW 型CO2培养箱(上海一恒科学仪器有限公司);MF53 型荧光倒置显微镜(广州市明美光电有限公司);BBS-SDC 型超净工作台(山东博科科学仪器);SuPerMax3100 型多功能酶标分析仪(上海闪谱生物科技有限公司);NovoCyte 2060R 型流式细胞仪(ACEA Biosciences Inc.);NP80 型紫外分光光度仪(NanoPhotometer);DYY-8C 型电泳仪(北京六一生物科技有限公司);WD-2102B 型全自动酶标仪及DYY-6C 型蛋白垂直电泳仪(北京市六一仪器厂);Tanon-5200 型全自动化学发光图像分析系统(上海天能科技有限公司)。
2 方法
2.1 细胞培养
取长势良好的细胞进行传代。操作如下:吸弃培养上清,1×PBS 洗净两次,0.25%胰酶消化,细胞变圆后终止消化,加入培养基轻轻吹打,然后将细胞悬液转移至10 mL 离心管中,离心后弃上清,加入培养基反复吹打至均匀。按1 ∶3 的比例,将细胞悬液分置于预备好的培养皿中,做好标记,置于CO2培养箱中培养,完成细胞传代。根据实验需要将细胞铺至6 孔板、96 孔板、6 cm 培养皿,按细胞传代方法,根据实验需要,将细胞进行稀释,以6 孔板每孔约2×105个细胞,96 孔板每孔约1×104个细胞,6 cm培养皿每皿约5×105个细胞种板,完全贴壁后即可进行下一步实验。
2.2 CCK8 法检测细胞增殖情况
取对数期细胞,以每孔1×104个细胞接种于96孔板,培养12 h 后,分别加入终浓度为200、100、75、50、25 μmol/L 的木犀草素,100、80、60、40、20 ng/mL 的TRAIL 以及50 μmol/L 木犀草素加不同终浓度的TRAIL,处理24 h,每孔加入10 μL CCK8检测试剂,37℃培养箱中孵育4 h;取出摇匀,在波长450 nm 下,测定每孔OD值,计算细胞存活率。
2.3 流式细胞术检测细胞凋亡和周期情况
参照细胞凋亡检测试剂盒操作说明书及文献[6]:收集1 ~ 3×106个细胞,加1 mL PBS,1 500 r/min 离心3 min,洗净两次,取500 μL 预冷的1×Binding Buffer 重悬细胞,每管各加入5 μL Annexin V-APC和10 μL 7-AAD,轻微混匀,室温避光孵育10 min后,混匀,流式细胞仪检测细胞凋亡情况。参照细胞周期检测试剂盒操作说明书及文献[7]:收集2×105~3×106个细胞,离心3 min,弃上清液;加入1 mL PBS,1 500 r/min 离心弃上清液;加入1 mL DNA 染色液和10 μL 渗透溶液,涡旋振荡5 ~ 10 s 混匀,室温避光孵育30 min,流式细胞仪检测分析细胞周期。
2.4 Western-Blotting 检测NF-κB 相关蛋白
参考文献[8]报道的方法,将培养皿中细胞培养液吸弃,加入100 μL 的细胞裂解液,冰上放置20 min。将细胞刮至一侧,液体转移至标记好的EP 管中,12 000 r/min 离心10 min,取上清,即为总蛋白,测定蛋白浓度。蛋白变性后上样,电泳2 h,在300 mA恒流转膜80 min。一抗孵育,4 ℃过夜;二抗室温孵育2 h。膜上滴加发光液,凝胶成像系统中曝光,用Image Pro 软件分析各条带灰度值。
2.5 统计学方法
用SPSS 23.0 软件进行数据分析。计量资料用均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用方差分析。以P<0.05 为差异有统计学意义。
3 结果
3.1 木犀草素与TRAIL 对HepG2 细胞增殖的影响
分别用不同浓度的木犀草素和TRAIL处理HepG2细胞24 h,结果显示,木犀草素在25 ~ 200 μmol/L的浓度范围内皆有抑制HepG2 细胞增殖的作用,见图1。这与文献[9]报道的一致。其抑制率分别为5.04%、11.67%、26.88%、45.46% 和84.10%,因此选择亚细胞毒性浓度50 μmol/L 的木犀草素作为本次研究的对象。TRAIL 在20 ~ 100 ng/mL 浓度范围内对HepG2 细胞的增殖亦表现出一定的抑制作用,抑制率分别为6.61%、10.30%、14.98%、16.19%和16.32%。将50 μmol/L 木犀草素分别和不同浓度的TRAIL 共同作用于HepG2 细胞。结果显示,50 μmol/L 木犀草素和20 ng/mLTRAIL 对诱导HepG2 细胞生长的抑制率最小 (P< 0.05),协同因子达到1.802,见表1。因此,选定 50 μmol/L 的木犀草素和20 ng/mL 的TRAIL 进行接下来的实验研究。
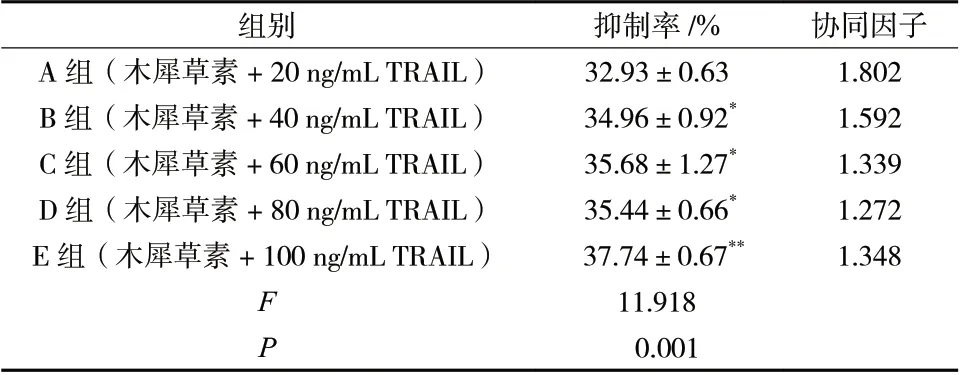
表1 50 μmol/L 的木犀草素和不同浓度TRAIL 联合用药对HepG2 细胞生长的抑制率及协同因子的影响(n = 3)Tab.1 Growth inhibition rates of HepG2 cellsand co-factors treated with 50 μmol/L luteolin in combination with various concentrations of TRAIL(n = 3)
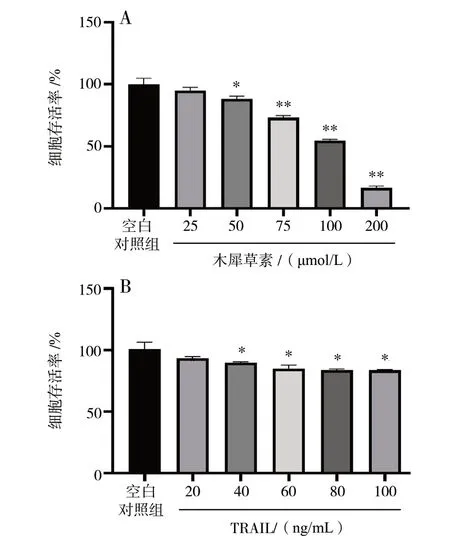
图1 不同浓度的木犀草素与TRAIL 对HepG2 细胞增殖的影响Fig.1 Effects of different concentrations of luteolin and TRAIL on proliferation of HepG2 cells
3.2 各实验组对HepG2 细胞凋亡及周期的影响
空白对照组细胞的自然凋亡率为4.80%,而由50 μmol/L 的木犀草素引起的HepG2 细胞凋亡率为20.80%,明显高于空白对照组(P<0.05),且主要是晚期凋亡。20 ng/mL TRAIL 引起的HepG2 细胞凋亡亦主要是晚期凋亡,凋亡率为11.46%。与空白对照组、木犀草素组和TRAIL 组相比,木犀草素+TRAIL 组引起的HepG2 细胞凋亡率明显上升为41.91%(P<0.05),主要为早期凋亡,见图2A。
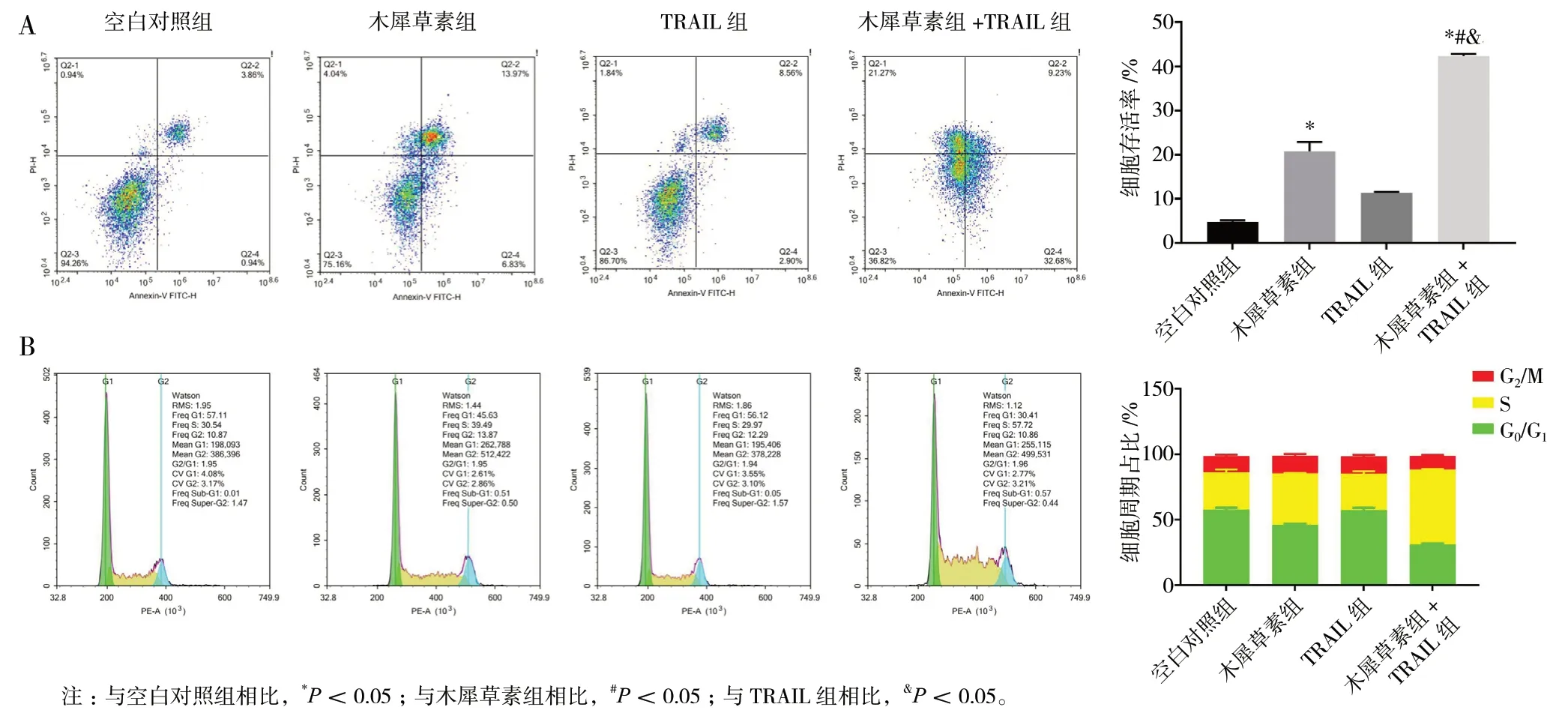
图2 各实验组对HepG2 细胞凋亡(A)及周期(B)的影响Fig.2 Effects of different experimental groups on apoptosis(A)and cycle(B)of HepG2 cells
空白对照组的G0/G1期、S 期和G2/M 期的细胞数分别占比57.12%、30.54%和12.34%。与空白对照组相比,TRAIL 组细胞各周期细胞数无明显变化;木犀草素组G0/G1期细胞数量减少为46.14%,S 期和G2/M 细胞数量增加,分别为39.49%和14.37%。与空白对照组和单独用药组相比,木犀草素+TRAIL 组G0/G1期和G2/M 期细胞数量减少,分别占比30.98%和11.30%,S 期细胞明显增加,占比57.72%,细胞停滞于S 期,见图2B。
3.3 各实验组对HepG2 细胞NF-κB 相关蛋白的影响
与空白对照组相比,木犀草素组IκBα、p-IκBα和NF-κB p65 蛋白表达下降(P<0.05),TRAIL组IκBα、p-IκBα 和NF-κB p65 表达上升;与空白对照组和单独用药组比较,木犀草素+TRAIL组IκBα、p-IκBα 和NF-κB p65 蛋白均下降 (P<0.05),见图3。结果表明,木犀草素能够抑制IκBα 磷酸化,从而抑制NF-κB 的活化;而木犀草素与TRAIL 合用,IκBα、p-IκBα 和NF-κB p65 蛋白表达下降更甚,说明对NF-κB 的抑制更强。

图3 各实验组对HepG2 细胞NF-κB 相关蛋白的影响Fig.3 Effects of different experimental groups on NF-κB-related proteins in HepG2 cells
4 讨论
TRAIL 具有广谱、高效、特异的诱导肿瘤细胞凋亡的作用,并且对正常细胞没有杀伤作用。60%的肿瘤细胞对TRAIL 诱导的凋亡并不敏感,但TRAIL与化疗药物联合应用时对大多数肿瘤细胞表现出协同杀伤效应,具有较好的应用前景[11-13]。本研究结果显示,HepG2 细胞经TRAIL 处理24 h 后出现了凋亡,说明TRAIL 具有一定的诱导HepG2 细胞凋亡的作用,这与相关文献[3-4]报道的一致。但有文献报道,经TRAIL 处理的肝癌细胞其Bcl-2 和Bcl-XL 等抗凋亡蛋白表达上调,而促凋亡蛋白Bax、Bcl-Xs 表达下降,这可能与NF-κB 的活化有关[14-15]。本研究发现,经TRAIL 处理后,细胞内的NF-κB 蛋白表达增加,而NF-κB 又能导致cIAP-1、cIAP-2、XIAP、cFLIP、Bcl-XL 和TRAIL-R3 等抗凋亡蛋白表达上调,从而抑制肝癌细胞的凋亡,这是大多数肿瘤细胞对TRAIL 诱导的凋亡不敏感的一个因素[11]。因此,抑制NF-κB 的活化,增敏TRAIL 诱导HepG2细胞的凋亡值得进一步研究。
在正常情况下,NF-κB 与其抑制蛋白IκB 以聚合体的形式存在于细胞质内,无转录活性;当受到外界刺激时,IκB 发生磷酸化水解,并与NF-κB分离,NF-κB 被释放转位进入细胞核,从而引起特定靶基因的表达,促进肿瘤的形成和进展[16]。目前,已有大量的研究证明,通过下调NF-κB 的表达能够诱导肝癌细胞的凋亡[17-19]。因此,抑制IκB 的降解以及NF-κB 的活性,是诱导肝癌细胞的凋亡的一个重要靶点[20]。目前,木犀草素已被证实具有抑制肝癌HepG2 细胞NF-κB 活性,与TRAIL 合用能否增敏TRAIL 诱导HepG2 细胞凋亡是本研究的重点。研究结果显示,亚细胞毒性的木犀草素与TRAIL 联合应用后,细胞凋亡程度明显高于单独使用TRAIL 组。同时,Western Blotting 实验结果显示,两者联合应用后,木犀草素组、木犀草素+ TRAIL 组中IκB、p-IκB和NF-κB 蛋白明显降低,表明木犀草素能抑制IκB 的磷酸化,使NF-κB 无法被激活,降低了药物抵抗性,从而增强了TRAIL 诱导细胞凋亡的作用,这可能是木犀草素增敏TRAIL 诱导肝癌HepG2 细胞凋亡的一个重要因素。
5 结论
木犀草素与TRAIL 合用可以抑制HepG2 细胞IκBα 的磷酸化,从而抑制NF-κB 活化,抵抗TRAIL激活NF-κB的作用,增加HepG2细胞对TRAIL的敏感性,促进HepG2 细胞凋亡。然而NF-κB 被抑制后,cIAP-1、cIAP-2、XIAP、cFLIP、Bcl-XL 等抗凋亡蛋白和Bax、Bcl-Xs 等促凋亡蛋白的表达尚无相关研究,这可能与木犀草素增敏TRAIL诱导肝癌HepG2细胞凋亡的机制有关,有待进一步探究。木犀草素与TRAIL 合用,不仅可以减少木犀草素在抗肿瘤中的用量,降低对正常细胞的细胞毒性,也为木犀草素联合TRAIL 在临床治疗肝癌提供理论基础和实验依据,为开发具有增敏TRAIL 诱导肿瘤细胞凋亡的药物提供实验思路。
