水稻减数分裂期高温对苯丙烷类代谢及下游分支代谢途径的影响
2023-07-18汪胜勇陈宇航陈会丽黄钰杰张啸天丁双成王宏伟
汪胜勇 陈宇航 陈会丽 黄钰杰 张啸天 丁双成 王宏伟
水稻减数分裂期高温对苯丙烷类代谢及下游分支代谢途径的影响
汪胜勇1陈宇航1陈会丽1黄钰杰1张啸天1丁双成2,*王宏伟1,*
[1农业农村部长江中游作物绿色高效生产重点实验室(部省共建)/长江大学农学院,湖北 荆州 434025;2湿地生态与农业利用教育部工程研究中心/长江大学农学院,湖北 荆州 434025;*通信联系人,email: shchding@yangtzeu.edu.cn; wanghw@yangtzeu.edu.cn]
【目的】探究水稻减数分裂期高温如何影响苯丙烷类代谢,并分析其与水稻耐热性的关系。【方法】以N22、广陆矮15、SDWG005、全两优681、Y两优900、Y两优1号、两优培九和绵恢101(MH101)等8种耐热和不耐热水稻品种为试验材料,设置常温和高温处理,分析减数分裂期高温胁迫对水稻的花粉活力与苯丙烷类代谢关键酶活性、木质素、总黄酮及总酚等主要代谢产物含量之间的相关性;并进一步选择极端耐高温的SDWG005和极端不耐高温的MH101为材料分析苯丙烷类代谢、碳水化合物代谢和抗氧化系统对水稻耐热性的影响。【结果】1) 与对照相比,高温显著降低水稻花粉活力和颖花受精率,不同的水稻品种受高温影响后,花粉活力和颖花受精率的降幅不同。2) 高温显著增加颖花中肉桂酸-4-羟化酶和4-香豆酸辅酶A连接酶活性以及木质素、总黄酮和总酚的含量,且耐热品种增幅高于敏感品种。3) 高温下花粉活力与肉桂酸-4-羟化酶活性、木质素含量显著相关,颖花受精率与木质素含量以及木质素含量与类黄酮含量极显著相关。4) 与MH101相比,SDWG005小穗颖壳中木质素受高温显著诱导积累,且高温下能够维持较高细胞壁过氧化物酶活性。5) 与MH101相比,SDWG005颖花在高温下能够维持较高过氧化物酶、超氧化物歧化酶和抗坏血酸氧化酶活性,进而减少颖花中过氧化氢和丙二醛的积累。高温下SDWG005颖花中淀粉含量更高,酸性转化酶、蔗糖合酶及ATPase基因的表达量显著增加。【结论】减数分裂期高温促进颖花中苯丙烷类代谢关键酶活性的上升和代谢产物含量的增加,耐热品种高温下能够积累较多的木质素和类黄酮,具有较高抗氧化酶活性,同时蔗糖代谢和能量产生效率较高,从而具有较强的耐热性。
水稻;高温;颖花;苯丙烷类代谢;木质素;总黄酮
水稻是主要粮食作物之一,世界一半人口以稻米为主食。高温是影响我国水稻产量潜力发挥与品质稳定性的最主要生态因子之一[1]。据IPCC第六次评估报告,预计21世纪全球气温上升将达到或超过1.5℃,气候变暖将导致水稻生长季温度升高[2,3]。研究表明,抽穗期和开花期是高温胁迫导致结实率降低的敏感时期[4],开花当天的温度高于35℃,持续时间超过2 h就会引起颖花育性下降,严重影响结实率;水稻生殖期最低温度每上升1℃,水稻产量将下降10%[5, 6]。而水稻花粉母细胞减数分裂期遭遇持续高温会使花药内壁绒毡层提前降解,花粉活力降低,同时会降低花粉的附着率和萌发率,严重影响水稻的结实率[7,8]。因此,解析水稻高温花器官育性伤害机理及其调控机制,对水稻热害防御、耐热栽培及品种改良具有重要意义。
花器官受高温胁迫伤害程度最大,高温严重影响水稻产量的形成[9,10]。高温胁迫既能影响绒毡层正常的细胞结构和生理,阻碍花药成熟和开裂,又能阻碍花粉在柱头上萌发、花粉管伸长,从而影响受精过程[11-17]。高温可降低抗氧化酶活性,影响活性氧(ROS)稳态,引起氧化胁迫并干扰小孢子时期活性氧介导的细胞程序性死亡过程[18-20]。高温胁迫能够引起糖代谢和能量利用紊乱,Parish等[21]还指出,糖积累不足导致花粉育性显著降低,淀粉的正常积累是决定花粉育性的重要指标。蔗糖合酶和蔗糖转化酶是植物体内蔗糖分解途径中的两个关键酶,高温胁迫下蔗糖转化酶活性显著降低,蔗糖降解途径受阻,可能是导致花粉中淀粉积累量下降的主要原因[22, 23]。
莽草酸途径是连接初级代谢和次级代谢的主要桥梁,其起始物是磷酸戊糖途径的中间产物4-磷酸赤藓糖和糖酵解的中间产物磷酸烯醇式丙酮酸。而莽草酸的终产物分支酸可以进入苯丙烷代谢途径形成木质素、类黄酮等芳香族化合物,因此苯丙烷代谢与糖代谢密切相关[24]。一些研究表明,木质素生物合成的碳源是由D-葡萄糖提供的[25],外源可代谢糖类能够促进拟南芥和梨愈伤组织的木质素积累[26,27]。比如,柳枝稷中过量表达蔗糖合酶PvSUS1,木质素含量会升高[28],但在逆境条件下,糖代谢和苯丙烷代谢之间的关系报道较少。
苯丙烷类代谢是植物最重要的次生代谢途径之一,起始反应由苯丙氨酸解氨酶、肉桂酸-4-羟化酶和4-香豆酸辅酶A连接酶催化,进而产生木质素和类黄酮两类最主要的分支代谢产物[29]。黄酮类化合物作为重要抗氧化物质,在植物非生物胁迫响应中起着重要作用。研究表明,黄酮醇可通过调节高温胁迫下ROS稳态来控制番茄花粉管的生长和完整性[23]。木质素是花药壁的重要组成成分,参与抵抗非生物胁迫,上调木质素生物合成基因的表达会导致木质素沉积,次生细胞壁增厚,增强植物抗逆性[29-31],参与木质素单体氧化聚合为木质素的主要为第Ⅲ类PODs,且分为可溶性及结合态。其中NADH-POD以NADH为底物产生过氧化氢,而G-POD以愈创木酚为底物,通过消耗过氧化氢来催化细胞壁中木质素的合成[32]。Dong等[33]发现水稻UDP-葡萄糖基转移酶GSA1通过调控苯丙烷类代谢途径,促进黄酮类物质积累,增强水稻耐热性。目前,高温胁迫对水稻花器官次生代谢的影响相关研究报道较少。高温胁迫如何影响水稻颖花中苯丙烷类代谢通路以及代谢产物木质素和类黄酮的形成,这两种代谢产物如何参与调控水稻耐热性的生理基础也不清楚。为此,本研究以前期筛选的8份耐热性差异水稻品种为材料,研究高温对苯丙烷类代谢关键酶、代谢产物以及其与育性指标之间的关系,并进一步选择极端耐高温的SDWG005和极端不耐高温的绵恢101来分析高温通过苯丙烷类代谢调控耐热性的生理机制,以期为丰富水稻耐热机理和品种选育提供理论基础及技术指导。
1 材料与方法
1.1 试验材料
试验于2021年和2022年在长江大学农学院试验基地进行,供试材料选用广陆矮15(常规籼稻)、绵恢101(常规籼稻,对高温极端敏感)、SDWG005(非洲常规稻,极端耐高温)、N22(非洲稻)、全两优681(杂交籼稻)、Y两优900(杂交籼稻)、Y两优1号(杂交籼稻)和两优培九(杂交籼稻)。盆栽实验用桶为内径30 cm、高32 cm的塑料桶。供试土壤为0-20 cm的稻田表层土,经风干后过4 mm筛,12.5 kg/桶,均匀拌入10 g复合肥(N∶P2O5∶K2O=26∶10∶15)。采用积温法调整播种日期以使各水稻品种的抽穗开花期基本一致,于大田播种育秧20 d后选取生长一致且健壮的幼苗移栽,移栽时植株沿桶壁栽培成圆形,距桶边缘大约2 cm,每桶20株,每个品种每处理设置20盆,在水稻生长过程中定期剪除分蘖,只留主茎。
1.2 处理设置
利用日光型人工气候室(型号 AGC-MR,浙江求是人工环境有限公司)模拟大田昼夜温度变化,设置常温(CK)和高温(HT)两个温度水平,湿度为恒湿模式(75%),温度的具体变化过程见图 1。CK和HT的日最高气温和日平均气温分别为26℃和23.5℃、38℃和33.5℃。于各水稻减数分裂期分别移入人工气候室中进行不同温度处理。为保证所取水稻的生长发育进程和处理条件一致,于CK和HT处理的当天对发育进程基本一致的稻穗(叶枕距约为2 cm)进行挂牌标记,处理5 d后将水稻植株均放置在适温条件下继续生长直到成熟。
1.3 测定项目与方法
1.3.1 水稻花粉活力和颖花受精率统计
在水稻开花期,剥取未开放颖花的花药,进行1% KI/I2染色,随后于光学显微镜观察并拍照,统计花粉活力。花粉活力(%)=染色花粉数×100/总花粉粒数。在水稻成熟期考查颖花受精率,凡有结实触感的饱粒和瘪粒均计为受精粒,其余计为非受精粒,颖花受精率(%)=受精粒数×100/总粒数。
1.3.2 苯丙烷类代谢途径中关键酶活性测定
待HT处理结束后,剥取挂牌标记稻株的幼穗,每个品种每种处理取样15穗,3次重复。用液氮冷冻处理并移至−80℃冰柜中备用。参照Liu等[34]的方法测定苯丙氨酸解氨酶(phenylalanineammonia -lyase, PAL)、肉桂酸-4-羟化酶(cinnamate 4-hydroxylase, C4H)和4-香豆酸辅酶A连接酶(4-coumarate:coenzyme A ligase, 4CL)的活性。取冷冻小穗(0.1 g)并研磨成粉末,使用PAL提取液[50 mmol/L磷酸盐缓冲液(pH 8.8),2%(/)聚乙烯吡咯烷酮,5 mmol/L β-巯基乙醇]、C4H提取液[50 mmol/L Tris-HCl,4 mmol/L MgCl2,15 mmol/L β-巯基乙醇,10 μmol/L 亮抑蛋白酶肽,5 mmol/L L-抗坏血酸,1 mmol/L 苯甲基磺酰氟(PMSF),0.1%(/)PVPP和10%(/)甘油]、4CL提取液[0.2 mol/L Tris-HCl(PH 7.5),25%甘油,0.1 mol/L 二硫苏糖醇]进行处理。将适量提取液加入分装样品中,在4℃的摇床中以250 r/min提取1 h,然后在离心机中12 000下离心30 min,取上清酶液。
PAL活性测定:取250 μL 粗酶提取物,加入250 μL含有0.02 mol/L 苯丙氨酸的50 mmol/L硼酸缓冲液(pH 8.8),用50 mmol/L硼酸缓冲液(pH 8.8)补足至1 mL,对照组使用灭活酶溶液,将混合物在37℃下孵育1 h,加入50 μL 6 mol/L 盐酸停止反应。测定PAL在290 nm处的吸光度。
C4H活性测定:将200 μL 酶提取物加入2 mL 反应液(8 μmol/L 反式肉桂酸,3 μmol/L NADPNa2,6 μmol/L G-6-PNa2,50 mmol/L Tris-HCl),在25℃下孵育30 min,加入100 μL 6 mol/L 盐酸停止反应,在340 nm处测定吸光值。
4CL活性测定:将0.5 mL 粗酶提取物加入到0.45 mL 75 mmol/L MgCl2,0.15 mL 1 μmol/L 辅酶A,0.15 mL 0.8 mmol/L ATP和0.15 mL 2 mmol/L对香豆酸混合的反应溶液中,并在333 nm处测量4CL的活性。

图1 常温与高温人工气候室的温度设置

表1 基因表达分析使用的引物
1.3.4 木质素、总黄酮和总酚含量测定
参照张水明等[35]的方法采用巯基乙酸法测定木质素含量。采用亚硝酸钠-硝酸铝-氢氧化钠比色法[36],以芦丁标准品绘制标准曲线,测定总黄酮含量。利用福林-酚法,以没食子酸为标准品绘制标准曲线,测定总酚含量。
1.3.5 抗氧化物酶活性、过氧化氢、丙二醛和ATP含量测定
过氧化物酶和超氧化物歧化酶的酶活性测定参照王成章等的方法[37]。抗坏血酸氧化酶的活性测定参照NaKano等的方法[38]。丙二醛含量使用索莱宝丙二醛含量检测试剂盒(BC0020)测定。过氧化氢含量测定使用索莱宝的过氧化氢含量检测试剂盒(BC3590)。ATP含量使用索莱宝ATP含量检测试剂盒(BC0305)测定。
1.3.6 碳水化合物含量测定和蔗糖代谢基因表达水平分析
参照李光彦[39]的方法,分别取0.5 g 绵恢101和SDWG005冷冻小穗粉末,测定可溶性糖、可溶性淀粉和非结构性碳水化合物的含量。称取1 g 绵恢101和SDWG005的冷冻小穗粉末,Trizol法提取总RNA,并反转录为cDNA。以水稻为内参进行qRT-PCR,反应体系包括cDNA模板1 μL(约80 ng)、上游引物及下游引物各0.5 μL(10 μmol/L)、10 μL荧光定量反应液(2 × Universal SYBR Green FAST PCR Mix)。采用2法对基因表达数据进行分析处理,使用引物如表1所示。
1.3.7 细胞壁氧化酶活性测定
细胞壁游离态和结合态愈创木酚过氧化物酶的活性测定参照刘清泉[40]的方法进行,略有修改。取0.1 g冷冻小穗粉末,加入2 mL蛋白质提取液(25 mmol/L MOPS,pH 7.0,200 mmol/L CaCl2)研磨,12000×下低温离心15 min,上清液为粗蛋白提取液,用于测定细胞壁游离态愈创木酚过氧化物酶。离心得到的沉淀用蛋白质提取液洗涤3次,弃上清液,加入10倍沉淀体积的含1%纤维素酶、0.1%果胶酶的0.1 mol/L乙酸缓冲液(pH 5.6)水解过夜,12000×下低温离心取上清液,用于测定细胞壁结合态愈创木酚过氧化物酶的酶活性。漆酶的活性测定使用索莱宝的漆酶活性检测试剂盒(BC1630)进行。
1.3.8 间苯三酚染色
取CK和HT处理5 d水稻幼穗中部的颖壳进行木质素间苯三酚染色,按照上海源叶木质素间苯三酚染色液(R30443)使用说明进行。
1.4 数据分析
采用Microsoft Excel 2010整理数据,SAS 9.2统计分析数据,Microsoft Excel 2010绘图。
2 结果与分析
2.1 减数分裂期高温胁迫对水稻花粉活力和颖花受精率的影响
图2-A显示,HT显著降低了8个水稻品种的花粉活力,其中降幅最小的品种为N22,降幅3.9个百分点;其次是全两优681,降幅为5.0个百分点;绵恢101降幅最大,高达39.4个百分点。图2-B显示,除N22以外,HT显著降低了其余7个水稻品种的颖花受精率,其中,广陆矮15、SDWG005、N22和全两优681的颖花受精率降幅小于其他品种,分别为25.6、17.7、8.8和23.1个百分点,绵恢101、两优培九、Y两优900和Y两优1号的颖花受精率降幅均超过30个百分点,其中绵恢101降幅最大,高达60.7个百分点。结合颖花受精率和花粉活力数据比较基因型间的差异,可以认定N22、广陆矮15、sDWG005和全两优681为耐热品种,两优培九、Y两优900、Y两优1号和绵恢101是热敏感品种。
2.2 减数分裂期高温胁迫对颖花中苯丙氨酸解氨酶、肉桂酸-4-羟化酶和4-香豆酸辅酶A连接酶活性的影响
图3-A显示,在CK处理下,N22的苯丙氨酸解氨酶(PAL)酶活性最高,其次是广陆矮15;高温处理后,N22和全两优681的PAL活性显著降低,SDWG005的PAL酶活性大幅度增加,相比于CK处理增加了45.48%。敏感品种的PAL酶活性在高温前后无变化或变化幅度较小。由图3-B和3-C可知,在HT处理下,肉桂酸-4-羟化酶(C4H)和4-香豆酸辅酶A连接酶(4CL)活性在不同水稻品种间均有不同幅度上升,耐性品种的C4H和4CL酶活性增幅总体上高于敏感品种,其中敏感品种绵恢101的C4H和4CL酶活性在CK和HT下均显著低于耐性品种。以上说明,减数分裂期高温胁迫主要影响肉桂酸-4-羟化酶和4-香豆酸辅酶A连接酶的活性,且耐性品种和敏感品种间存在显著差异。
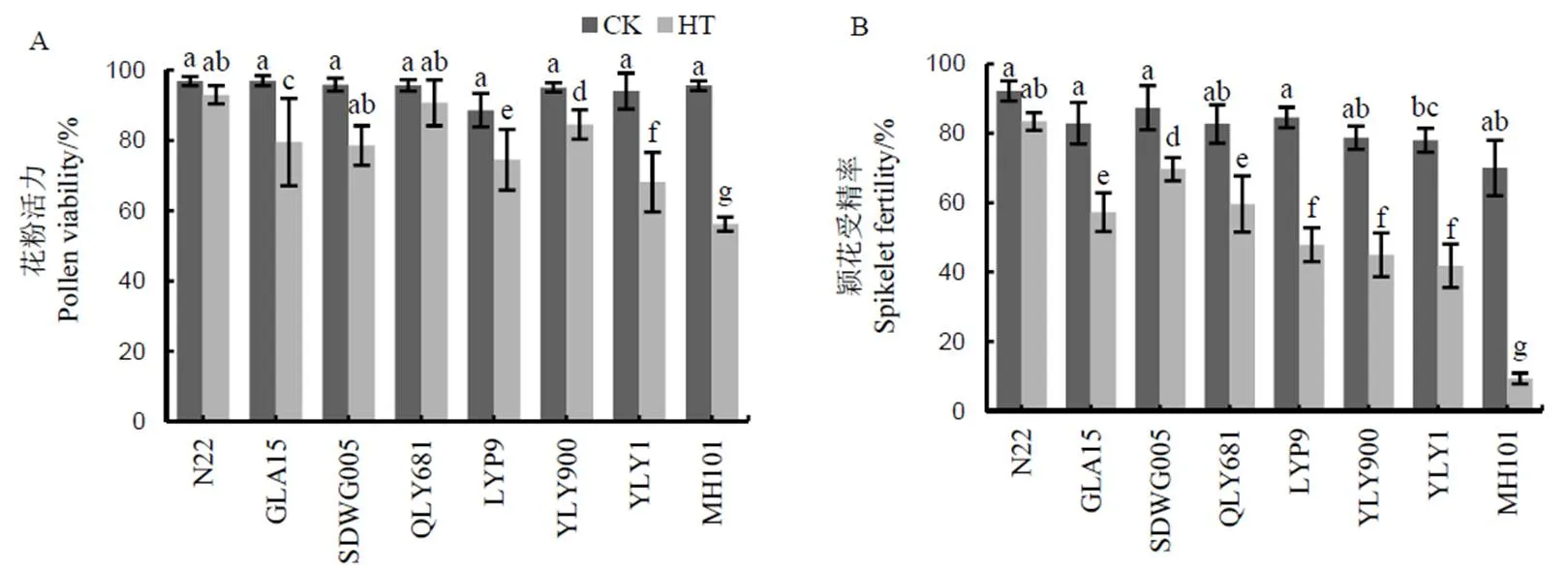
GLA15-广陆矮15;QLY681-全两优681;LYP9-两优培九;YLY900-Y两优900;YLY1-Y两优1号;MH101-绵恢101。平均值±标准差,n = 3,柱状图上不同小写字母表示不同品种及处理间差异达5%显著水平。下同。

图3 不同水稻品种减数分裂期高温处理下苯丙烷类代谢途径关键酶活性比较
2.3 减数分裂期高温胁迫对颖花木质素、总黄酮和总酚含量的影响
如图4-A所示,高温处理下8个水稻品种的木质素含量均显著增加,相比CK增加了约0.4~2.5倍,其中耐性品种增幅总体大于敏感性品种。总黄酮含量也受到高温胁迫的影响,除N22增幅不明显外,其他品种均有不同幅度的增加,绵恢101增加了24.8%,广陆矮15、SDWG005和全两优681分别增加了33.8%、42.1%和41.9%,HT下耐性品种总黄酮含量增幅总体显著高于敏感品种(图4-B)。图4-C显示,除N22外,高温处理下其余7个水稻品种颖花中总酚含量均有增加,广陆矮15增幅最大,高达69.4%。以上说明减数分裂期高温促进了颖花中苯丙烷类代谢通路中三类主要代谢产物积累,特别是木质素和总黄酮含量,二者在耐性品种和敏感性品种间增幅差异显著。
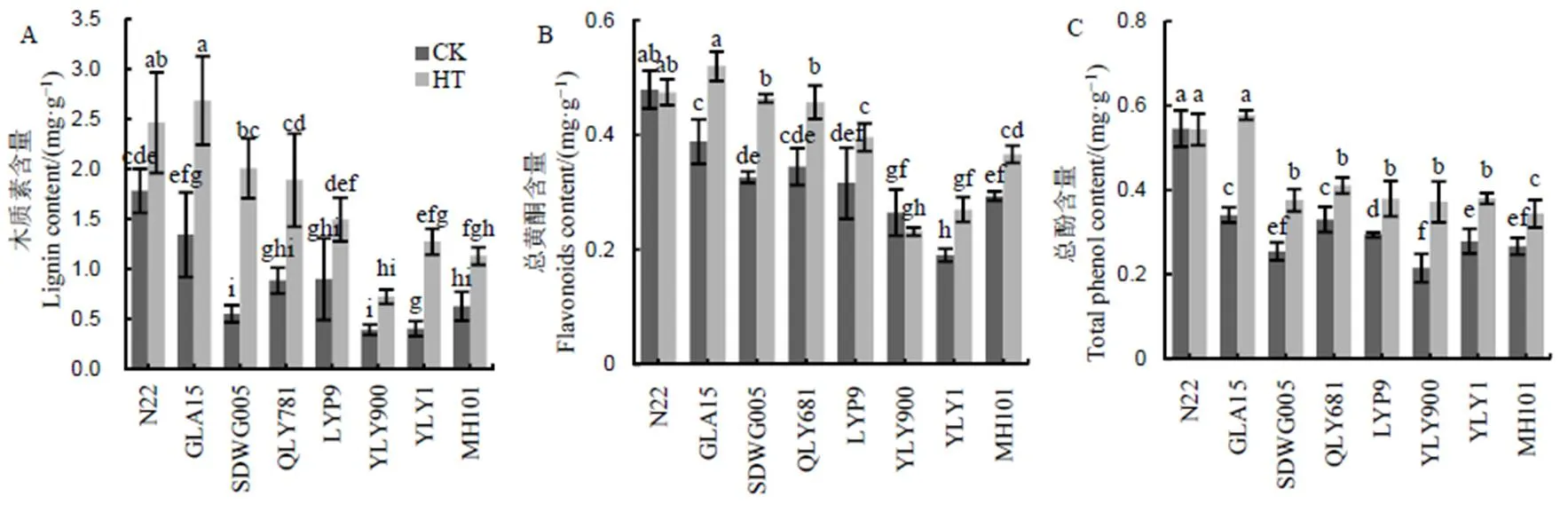
图4 不同水稻品种减数分裂期高温处理下颖花木质素、总黄酮和总酚含量的比较
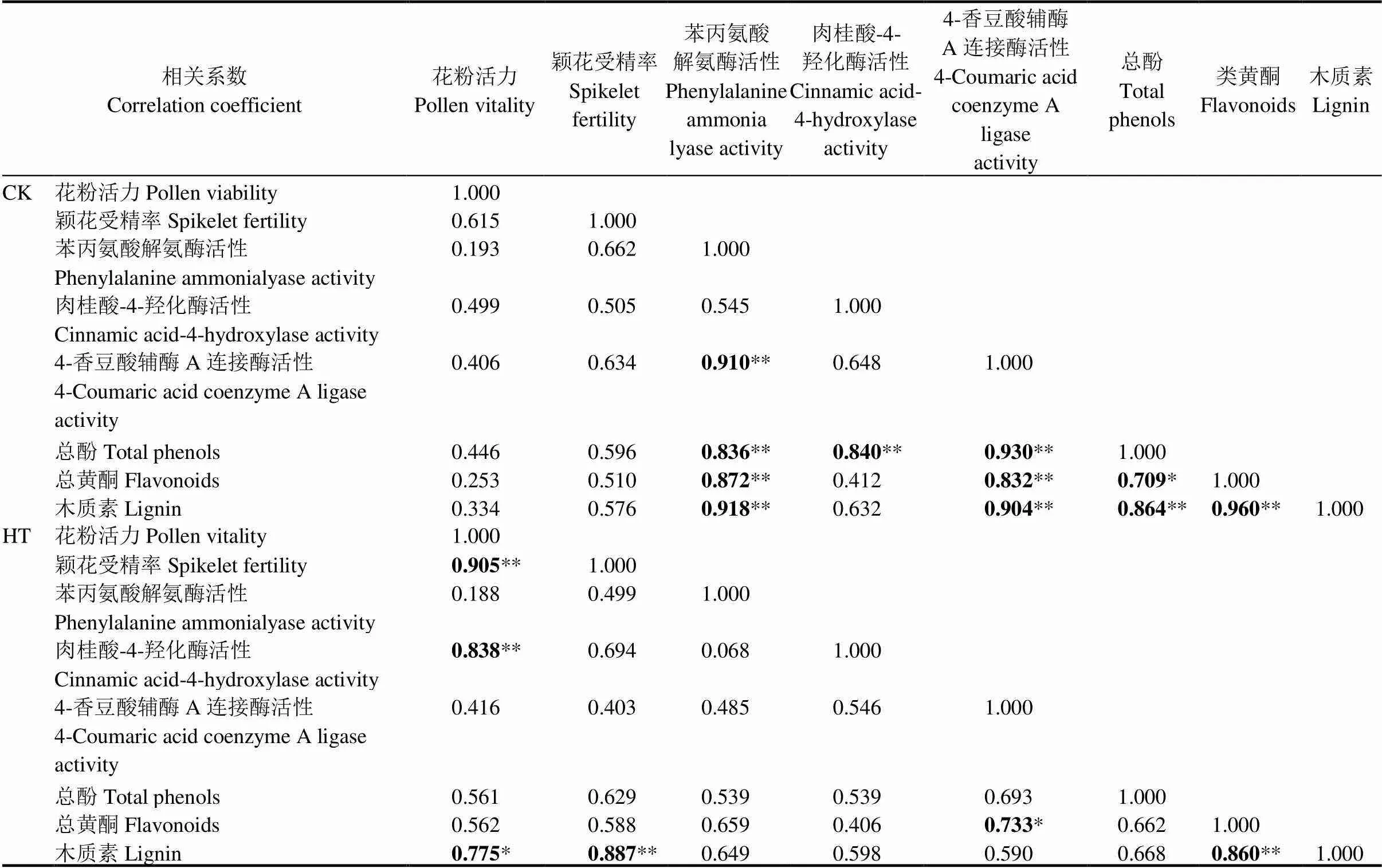
表2 CK和HT处理下苯丙烷类代谢及下游分支代谢途径相关指标相关性分析
为进一步明确哪一种代谢产物与高温结实伤害关联最显著,我们将花粉活力、颖花受精率、苯丙氨酸解氨酶活性、肉桂酸-4-羟化酶活性、4-香豆酸辅酶A连接酶活性、总酚含量、总黄酮含量、木质素含量等指标进行相关性分析。分析结果显示CK处理下苯丙氨酸解氨酶活性和4-香豆酸辅酶A连接酶活性与总酚、总黄酮和木质素等三种代谢产物含量均极显著相关,肉桂酸-4-羟化酶活性与总酚含量也极显著相关,但是花粉活力和颖花受精率均与关键酶活性(苯丙氨酸解氨酶活性、肉桂酸-4-羟化酶活性和4-香豆酸辅酶A连接酶活性)和代谢产物(总酚、总黄酮和木质素)含量相关不显著(表2)。但是,高温处理下,花粉活力与肉桂酸-4-羟化酶活性、木质素含量极显著相关,颖花受精率与木质素含量也极显著相关,木质素含量与总黄酮含量极显著相关(表2)。由此可见,高温引起颖花中木质素和总黄酮含量积累,且敏感性品种中积累水平较低,可能是影响高温下水稻结实的一个重要因素。
2.4 减数分裂期高温胁迫对颖花细胞壁过氧化物酶活性的影响
以高温下苯丙烷类代谢通路具有显著差异的水稻品种SDWG005和绵恢101为材料,进一步分析减数分裂期高温如何影响木质素积累。如图5所示,间苯三酚染色显示高温处理促进了水稻小穗颖壳木质素积累,且SDWG005木质化水平高于绵恢101。木质素氧化聚合依靠相关细胞壁氧化物酶作用,高温显著增加了以H2O2为底物的愈木创酚过氧化物酶活性,SDWG005增幅大于绵恢101。颖花中以NADH为底物的NADH过氧化物酶活性在高温下也受到激活,SDWG005中激活的是可溶态NADH过氧化物酶,绵恢101中激活的是细胞壁结合态NADH过氧化物酶。漆酶活性同样受到高温的影响,不同的是SDWG005颖花漆酶活性在高温下无显著变化,而绵恢101漆酶活性则受到显著抑制(图5)。以上说明高温下颖花中不同形态的过氧化物酶活性呈上升趋势,且酶活性总体水平SDWG005高于绵恢101,因此,SDWG005木质素积累水平较高。
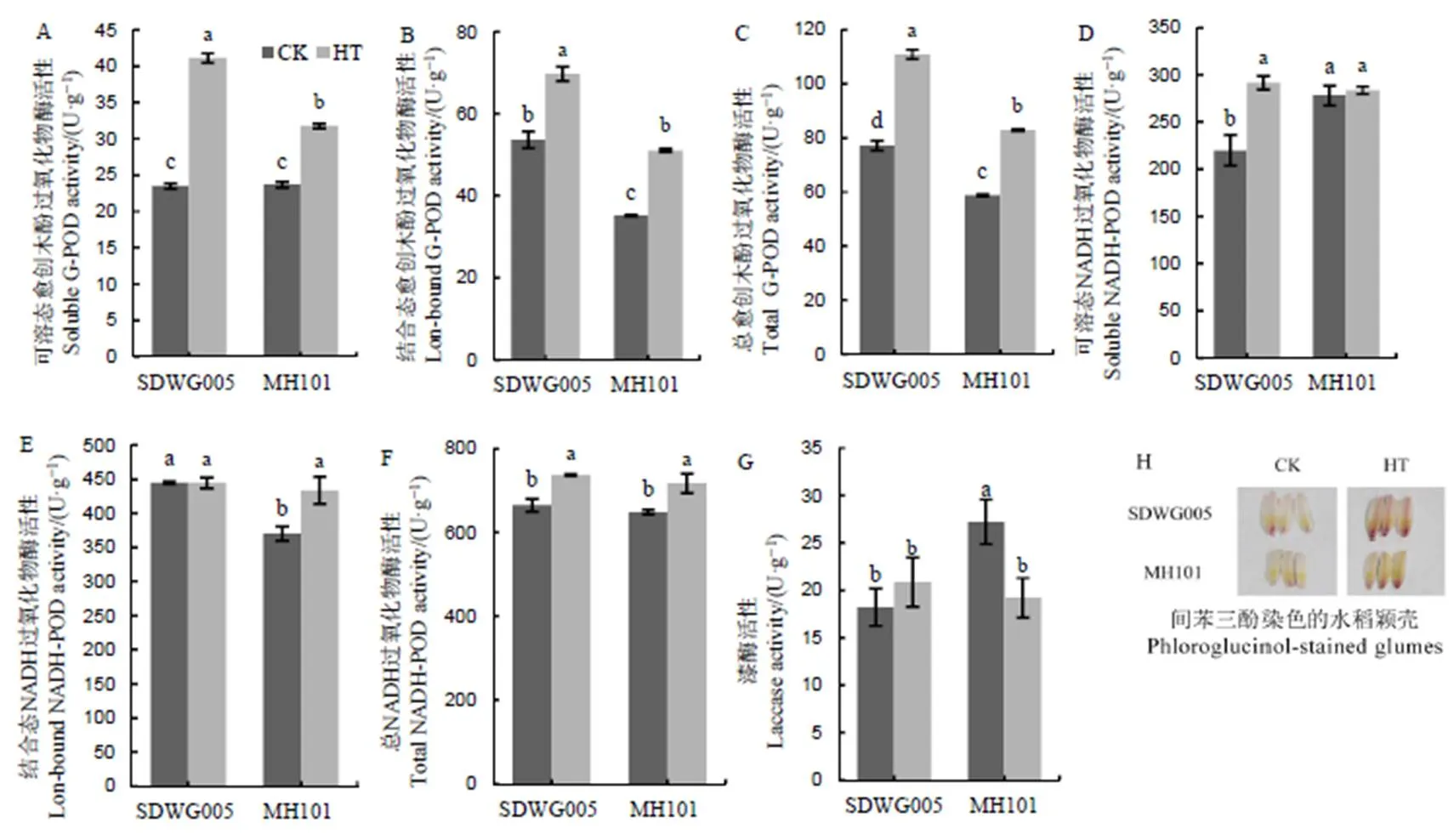
柱状图上不同小写字母表示不同品种及处理间差异达5%显著水平。
2.5 减数分裂期高温胁迫对水稻颖花抗氧化系统、碳水化合物代谢和能量产生的影响
如图6所示,高温显著增加了SDWG005穗部过氧化物酶和超氧化物歧化酶活性。对绵恢101来说,穗部过氧化物酶对减数分裂期高温胁迫相对钝感,超氧化物歧化酶活性甚至出现显著降低。此外,SDWG005和绵恢101穗部抗坏血酸过氧化物酶活性呈现下降趋势,其中绵恢101降幅较大。因此,高温胁迫下绵恢101穗部相比SDWG005积累了较多的过氧化氢和丙二醛含量(图6)。
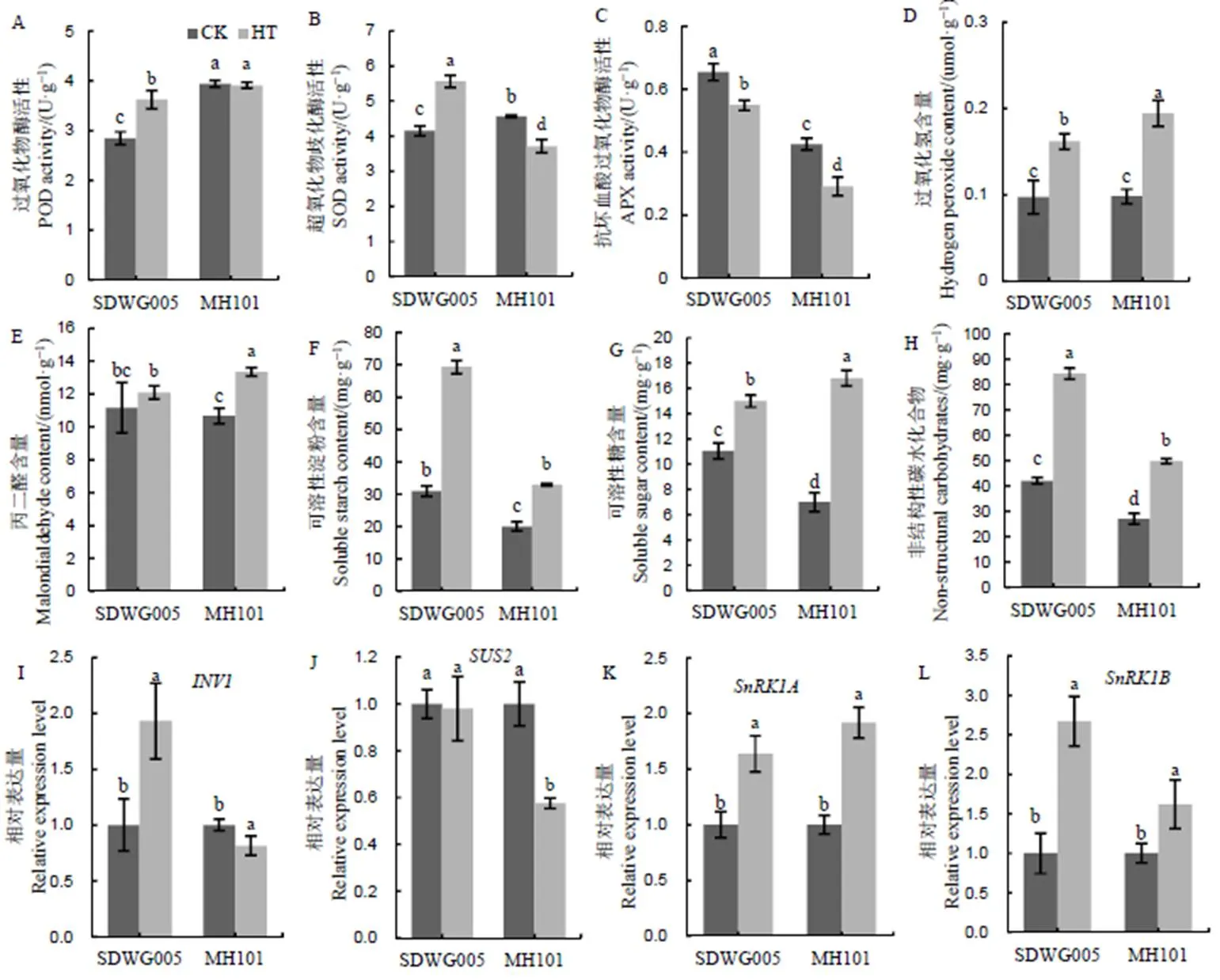
进一步测定耐性品种和敏感性品种高温处理下穗部碳水化合物含量。如图6所示,高温促进了可溶性糖、可溶性淀粉和非结构性碳水化合物等的积累,可溶性糖含量绵恢101增幅大于SDWG005,但是可溶性淀粉和非结构性碳水化合物绵恢101增幅均小于SDWG005。通过荧光定量PCR分析颖花蔗糖代谢关键基因和表达水平,结果显示SDWG005颖花中的基因表达在高温下受到诱导上调表达,而绵恢101颖花中的基因表达在高温下受到明显抑制。此外,饥饿响应基因和受高温诱导上调表达,表达并不受高温的影响,且的表达在SDWG005中上调幅度显著大于绵恢101,SDWG005 的ATP含量在高温下显著增加,而绵恢101增加不显著。以上说明减数分裂期高温影响了敏感性品种绵恢101颖花淀粉积累水平和能量水平,这可能是高温引起敏感性品种产生结实伤害的原因之一。
3 讨论
不同的水稻品种产量是由其作物遗传特性决定的[41]。而高温作为一种非生物胁迫,能够极大地影响水稻正常的生长发育,并影响其产量。其中,水稻在生殖生长阶段对高温胁迫较为敏感,特别是减数分裂期花粉形成过程中高温通过影响花粉发育过程中的物质和能量代谢,引起花粉败育,进而影响授粉受精过程,导致结实率下降,但品种间耐热性存在显著差异[42,43]。本研究发现不同的水稻品种在高温胁迫下表现出花粉活力和颖花受精率的变化,其中N22、广陆矮15、SDWG005对高温的耐受性较高,而绵恢101对温度极为敏感。目前对于不同品种水稻的耐热机制研究较少。前人研究表明,外施水杨酸(SA)能显著增加水稻的耐热性,减缓花药抗氧化酶活性的下降,减少花药中ROS及MDA含量的上升,从而减少花药绒毡层细胞程序性死亡(PCD)的产生,减轻高温下花粉粒败育[44]。SA合成关键酶苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)和4-香豆酸辅酶A连接酶(4CL)共同引导上游产物进入苯丙烷类代谢途径下游分支[45],其中木质素和类黄酮分别为两个分支的代谢产物,在非生物胁迫中其着重要作用[29,46]。目前对苯丙烷代谢响应非生物胁迫的研究较多,木质素和类黄酮含量的变化会引起花粉育性的改变[29]。本研究发现,水稻中苯丙烷代谢产物在高温胁迫后加速积累,耐高温材料的苯丙烷代谢产物的含量在高温处理下相比于敏感材料高出不少,并且不同水稻品种的苯丙烷代谢产物积累量与水稻的育性指标呈正相关。进一步分析表明,苯丙烷代谢上游途径中的肉桂酸-4-羟化酶和4-香豆酸辅酶A连接酶受到高温的显著诱导,说明了上游关键酶的活性是苯丙烷代谢产物积累的关键原因,然而作为水杨酸合成关键酶的苯丙氨酸解氨酶的活性在高温下并没有显著变化,推测这可能是由于在植物中水杨酸合成途径主要是异分支酸合成酶途径(ICS),而非苯丙氨酸解氨酶途径(PAL)[47],同时有研究表明酚类物质的合成一般不受PAL活性的控制,这与我们的实验结果一致[48]。木质素是花药细胞壁的组成成分之一,由木质素单体在细胞壁氧化酶和漆酶的催化下聚合而成[32]。本研究发现敏感材料的漆酶活性受到了抑制,而抗性材料的漆酶活性无显著变化,但细胞壁过氧化物酶活性显著提升,这有利于木质素的合成以维持花药细胞壁的形成。同时,在形成木质素的过程中,细胞壁过氧化物酶也会消耗更多的过氧化氢,有利于水稻在高温下的生长。有研究指出,黄酮类化合物是一类重要的抗氧化物质,可以激活抗氧化酶活性以及清除过量的ROS,维持正常的花粉育性及花粉管的生长[30]。本研究发现耐性品种在高温处理下具有更高的抗氧化酶活性,较少的H2O2和MDA含量。说明耐热品种在积累更多的木质素和类黄酮的过程中,水稻花粉ROS稳态受到影响,维持了较高的花粉育性。
可溶性糖作为一种渗透调节物质,对细胞具有渗透调节及保护细胞膜结构稳定的作用。苯丙烷类代谢初产物苯丙氨酸由糖代谢中的莽草酸途径产生,苯丙烷类代谢途径与糖代谢联系紧密。有研究指出,糖代谢能够为苯丙烷类代谢提供碳骨架,间接参与苯丙烷类代谢途径[24]。本研究观察到,高温显著增加颖花中可溶性糖、可溶性淀粉和非结构性碳水化合物的含量,说明糖类有助于水稻在热应激下正常生长,但是敏感材料绵恢101的可溶性糖增幅大于抗性材料SDWG005。一方面可能是由于热应激下为苯丙烷类代谢途径提供底物消耗,另一方面由于蔗糖转化酶()基因受高温诱导上调表达。前人研究表明,蔗糖合酶和转化酶受到抑制会导致植物的育性指标下降[49],这与我们发现SDWG005中这两种酶基因表达量较高,花粉活力比绵恢101高具有一致性。研究表明,SnRK1和TOR蛋白激酶作为能量管理的枢纽,逆境条件下营养物质不足或能量缺乏时SnRK1被激活抑制植株生长以减少消耗能量的合成代谢,而TOR在能量充足时刺激生物合成代谢[50,51]。能量代谢是植物体现对逆境环境耐受性的一方面,能量不足会导致植物抗逆性下降[52]。高温处理下和基因表达量增加,基因表达量无显著变化,说明高温导致颖花中碳水化合物代谢受阻,能量处于缺乏状态。SDWG005中基因表达量显著增加,而绵恢101中基因表达量增幅较小,也说明在高温热害下耐性品种仍具有较高的能量水平,能够为提高抗氧化能力提供充足的能量,最终增强水稻耐热性。
[1] Shi P H, Tang L, Wang L H, Sun T, Liu L L, Cao W X, Zhu Y. Post-heading heat stress in rice of south China during 1981-2010[J]., 2015, 10(6): e0130642.
[2] Shukla P R, Skeg J, Calvo Buendia E, Masson-Delmotte V, Pörtner H O, Malley J. Climate change and land: An IPCC special report on climate change, desertification, land degradation, sustainable land management, food security, and greenhouse gas fluxes in terrestrial ecosystems [M]. Koyoto, Japan: Intergovernmental Panel on Climate Change(IPCC), 2019.
[3] 杨军, 章毅之, 贺浩华, 李迎春, 陈小荣, 边建民, 金国花, 李翔翔, 黄淑娥. 水稻高温热害的研究现状与进展[J]. 应用生态学报, 2020, 31(8): 2817-2830.
Yang J, Zhang Y Z, He H H, Li Y C, Chen X R, Bian J M, Jin G H, Li X X, Huang S E. Current status and research advances of high-temperature hazards in rice[J]., 2020, 31(8): 2817-2830. (in Chinese with English abstract)
[4] 田小海, 罗海伟, 吴晨阳. 中国水稻热害研究历史、进展与展望[J]. 中国农学通报, 2009, 25(22): 166-168.
Tian X H, Luo H W, Wu C Y. Research on heat stress of rice in China: Progress and prospect[J]., 2009, 25(22): 166-168. (in Chinese with English abstract)
[5] Peng S B, Huang J L, Sheehy J E, Laza R C, Cassman K G. Rice yields decline with higher night temperature from global warming[J]., 2004, 101(27): 9971-9975.
[6] Ray D K, Gerber J S, Macdonald G K, West P C. Climate variation explains a third of global crop yield variability[J]., 2015, 6: 5989.
[7] Sage T L, Bagha S, Lundsgaard-Nielsen V, Branch H A, Sultmanis S, Sage R F. The effect of high temperature stress on male and female reproduction in plants[J]., 2015, 182: 30-42.
[8] Endo M, Tsuchiya T, Hamada K, Kawamura S, Yano K. High temperatures cause male sterility in rice plants with transcriptional alterations during pollen development[J]., 2009, 50(11): 1911-22.
[9] Sato S, Peet M M, Thomas J F. Determining critical pre- and post-anthesis periods and physiological processes inMill. exposed to moderately elevated temperatures[J]., 2002, 53(371): 1187-1195.
[10] Jagadish S V K, Craufurd P Q, Wheeler T R. Phenotyping parents of mapping populations of rice for heat tolerance during anthesis[J]., 2008, 48(3): 1140-1146.
[11] Wilson Z A, Song J, Taylor B, Yang C Y. The final split: The regulation of anther dehiscence[J]., 2011, 62(5): 1633-1649.
[12] Matsui T, Omasa K, Horie T. High temperature at flowering inhibits swelling of pollen grains, a driving force for thecae dehiscence in rice (L.)[J]., 2000, 3(4): 430-434.
[13] Matsui T, Omasa K. Rice cultivars tolerant to high temperature at flowering: Anther characteristics[J]., 2002, 89(6): 683-687.
[14] Prasad P V V, Boote K J, Allen L H, Sheehy J E. Species, ecotype and cultivar differences in spikelet fertility and harvest index of rice in response to high temperature [J]., 2006, 95(2): 398-411.
[15] Jagadish S V, Muthurajan R, Oane R, Wheeler T R, Heuer S, Bennett J, Craufurd P Q. Physiological and proteomic approaches to address heat tolerance during anthesis in rice (L.)[J]., 2010, 61(1): 143-156.
[16] Kobayashi K, Matsui T, Murata Y, Yamamoto M. Percentage of dehisced thecae and length of dehiscence control pollination stability of rice cultivars [J]., 2011, 14(2): 89-95.
[17] 张桂莲, 张顺堂, 肖浪涛, 唐文帮, 肖应辉, 陈立云. 抽穗开花期高温胁迫对水稻花药、花粉粒及柱头生理特性的影响[J]. 中国水稻科学, 2014, 28(2): 155-166.
Zhang G L, Zhang S T, Xiao L T, Tang W B, Xiao Y H, Chen L Y. Effect of high temperature stress on physiological characteristics of anther, pollen and stigma of rice during heading-flowering stage[J]., 2014, 28(2): 155-166. (in Chinese with English abstract)
[18] Wahid A, Gelani S, Ashraf M, Foolad M R. Heat tolerance in plants: An overview[J]., 2007, 61(3): 199-223.
[19] Locato V, de Pinto M C, de Gara L. Different involvement of the mitochondrial, plastidial and cytosolic ascorbate-glutathione redox enzymes in heat shock responses[J]., 2009, 135(3): 296-306.
[20] Locato V, Gadaleta C, de Gara L, de Pinto M C. Production of reactive species and modulation of antioxidant network in response to heat shock: A critical balance for cell fate[J]., 2008, 31(11): 1606-1619.
[21] Parish R W, Phan H A, Iacuone S, Li S F. Tapetal development and abiotic stress[J]., 2012, 39(7): 553-559.
[22] De Storme N, Geelen D. The impact of environmental stress on male reproductive development in plants: Biological processes and molecular mechanisms[J]., 2014, 37(1): 1-18.
[23] Bahuguna R N, Solis C A, Shi W J, Jagadish K S. Post-flowering night respiration and altered sink activity account for high night temperature-induced grain yield and quality loss in rice (L.)[J]., 2017, 159(1): 59-73.
[24] Herrmann K M, Weaver L M. The Shikimate Pathway[J]., 1999, 50: 473-503.
[25] Schubert W J, Acerbo S N. The conversion of D-glucose into lignin in[J]., 1959, 83(1): 178-82.
[26] Rogers L A, Dubos C, Cullis I F, Surman C, Poole M, Willment J, Mansfield S D, Campbell M M. Light, the circadian clock, and sugar perception in the control of lignin biosynthesis[J]., 2005, 56(416): 1651-63.
[27] Jiao Y, Gong X, Qi K, Xie Z, Wang Y, Yuan K, Pan Q, Zhang S, Shiratake K, Khanizadeh S, Tao S. Transcriptome analysis provides new ideas for studying the regulation of glucose-induced lignin biosynthesis in pear calli[J]., 2022, 22(1): 310.
[28] Poovaiah C R, Mazarei M, Decker S R, Turner G B, Sykes R W, Davis M F, Stewart C N, Jr. Transgenic switchgrass biomass is increased by overexpression of switchgrass sucrose synthase (PvSUS1)[J]., 2015, 10(4): 552-563.
[29] Dong N Q, Lin H X. Contribution of phenylpropanoid metabolism to plant development and plant-environment interactions[J]., 2021, 63(1): 180-209.
[30] Muhlemann J K, Younts T L B, Muday G K. Flavonols control pollen tube growth and integrity by regulating ROS homeostasis during high-temperature stress[J]., 2018, 115(47): e11188-e11197.
[31] Zhang D B, Wilson Z A. Stamen specification and anther development in rice[J]., 2009, 54(14): 2342-2353.
[32] Fecht-Christoffers M M, Fuhrs H, Braun H P, Horst W J. The role of hydrogen peroxide-producing and hydrogen peroxide-consuming peroxidases in the leaf apoplast of cowpea in manganese tolerance[J]., 2006, 140(4): 1451-63.
[33] Dong N Q, Sun Y, Guo T, Shi C L, Zhang Y M, Lin H X. UDP-glucosyltransferase regulates grain size and abiotic stress tolerance associated with metabolic flux redirection in rice[J]., 2020, 11(1): 2629.
[34] Liu Y Y, Ge Y H, Bi Y, Li C Y, Deng H W, Hu L G, Dong B. Effect of postharvest acibenzolar-S-methyl dipping on phenylpropanoid pathway metabolism in muskmelon fruits[J]., 2014, 168: 113-119.
[35] 张水明, 龚凌燕, 曹丹琴, 张永娟, 杨健. 石榴种皮总木质素含量及基因的克隆与表达[J]. 热带亚热带植物学报, 2015, 23(1): 65-73.
Zhang S M, Gong L Y, Cao D Q, Zhang Y J, Yang J. Total lignin content in pomegranate seed coat and cloning andexpression analysis ofgene[J]., 2015, 23(1): 65-73. (in Chinese with English abstract)
[36] 黄晓彤, 史锐, 刘苗苗, 丛龙娇, 刘斯文, 王琪瑶. 同属不同种桑叶总黄酮的含量测定及分析[J]. 亚太传统医药, 2022, 18(8): 91-95.
Huang X T, Shi R, Liu M M, Cong L J, Liu S W, Wang Q Y. Optimization of extraction process and content determination of total flavonoids from different mulberry leaves[J]., 2022, 18(8): 91-95. (in Chinese with English abstract)
[37] 王成章, 李建华, 郭玉霞, 方丽云, 高永革. 光周期对不同秋眠型苜蓿SOD、POD活性的影响[J]. 草地学报, 2007, 15(5): 407-411. (in Chinese with English abstract)
Wang C Z, Li J H, Guo Y X, Fang L Y, Gao Y G. Effect of photoperiod on SOD and POD activities in alfalfa varieties with different fall dormancy[J]., 2007, 15(5): 407-411.
[38] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specificperoxidase in spinach chloroplasts[J]., 1981, 22(5): 867-880.
[39] 李光彦. 能量代谢影响水稻耐热性的作用机理[D]. 武汉: 华中农业大学, 2021.
Li G Y. The mechanism of energy metabolism mediating rice heat resistance[D]. Wuhan: Huangzhong Agricultural University, 2021. (in Chinese with English abstract)
[40] 刘清泉. 铜胁迫下水稻木质素合成的响应机制及水稻漆酶在植物重金属耐性中的作用[D]. 南京: 南京农业大学, 2015.
Liu Q Q. Response mechanism of lignin synthesis in rice under copper stress and the role of rice in plants tolerance to heavy metal[D]. Nanjing: Nanjing Agricultural University, 2015. (in Chinese with English abstract)
[41] 崔莹莹, 王晓玲. 水稻产量相关性状QTL的遗传研究进展[J]. 江苏农业科学, 2017, 45(13): 1-7.
Cui Y Y, Wang X L. Genetic research progress of QTL related traits in rice yield[J]., 2017, 45(13): 1-7.(in Chinese)
[42] 张桂莲, 张顺堂, 肖浪涛, 武小金, 肖应辉, 陈立云. 花期高温胁迫对水稻花药生理特性及花粉性状的影响[J]. 作物学报, 2013, 39(1): 177-183.
Zhang G L, Zhang S T, Xiao L T, Wu X J, Xiao Y H, Chen L Y. Effect of high temperature stress on physiological characteristics of anther and pollen traits of rice at flowering stage[J]., 2013, 39(1): 177-183. (in Chinese with English abstract)
[43] Oshino T, Abiko M, Saito R, Higashitani A. Premature progression of anther early developmental programs accompanied by comprehensive alterations in transcription during high-temperature in barley plants[J]., 2007, 278(1): 31-42.
[44] Feng B H, Zhang C X, Chen T T, Zhang X F, Tao L X, Fu G F. Salicylic acid reverses pollen abortion of rice caused by heat stress[J]., 2018, 18(1): 245.
[45] Fraser C M, Chapple C. The phenylpropanoid pathway in Arabidopsis[J]., 2011, 9: e0152.
[46] Dixon R A. Natural products and plant disease resistance[J]., 2001, 411(6839): 843-847.
[47] Mishra A K, Baek K H. Salicylic acid biosynthesis and metabolism: A divergent pathway for plants and bacteria[J]., 2021. 11(5): 705.
[48] 陈爱国, 彭东, 陈向东, 石屹, 梁洪波. 烤烟苯丙烷代谢中相关酶活性和多酚产物的关系研究[C]. 山东植物生理学会第七次代表大会暨植物生物学与现代农业研讨会, 济南: 山东省科学技术协会, 2012: 240-246.
Chen A G, Peng D, Chen X D, Shi Y, Liang H B. Studies on Relationships of Related Enzyme Activities and Polyphenol Products of Phenylpropanoid Metabolic Pathway in Flue-cured tobacco[C]. Proceedings of the 7th Congress of Shandong Plant Physiology Society and Symposium on Plant Biology and Modern Agriculture, Jinan: Shandong Science and technology Association, 2012: 240-246.(in Chinese with English abstract)
[49] Zhang C X, Feng B H, Chen T T, Fu W M, Li H B, Li G Y, Jin Q Y, Fu G F. Heat stress-reduced kernel weight in rice at anthesis is associated with impaired source-sink relationship and sugars allocation[J]., 2018, 155: 718-733.
[50] Baena-González E, Hanson J. Shaping plant development through the SnRK1-TOR metabolic regulators[J]., 2017, 35: 152-157.
[51] Yu P H, Jiang N, Fu W M, Zheng G J, Li G Y, Feng B H, Chen T T, Ma J Y, Li H B, Tao L X, Fu G F. ATP hydrolysis determines cold tolerance by regulating available energy for glutathione synthesis in rice seedling plants[J]., 2020, 13(1): 23.
[52] Li G Y, Zhang C X, Zhang G H, Fu G F. Abscisic acid negatively modulates heat tolerance in rolled leaf rice by increasing leaf temperature and regulating energy homeostasis[J]., 2020, 13(1): 18.
Effects of High Temperature on Phenylpropane Metabolism and Downstream Branch Metabolic Pathways in Rice Meiosis
WANG Shengyong1, CHEN Yuhang1, CHEN Huili1, HUANG Yujie1, ZHANG Xiaotian1, DING Shuangcheng2,*, WANG Hongwei1,*
[MARA Key Laboratory of Sustainable Crop Production in the Middle Reaches of the Yangtze River (Co-construction by Ministry and Province)/College of Agriculture, Yangtze University, Jingzhou 434025, China; Engineering Research Center of Ecology and Agricultural Use of Wetland, Ministry of Education/ College of Agriculture, Yangtze University, Jingzhou 434025, China; Corresponding author, email: shchding@yangtzeu.edu.cn; wanghw@yangtzeu.edu.cn]
【Objective】Our purposes are to investigate how high temperature during rice meiosis affects phenylpropane metabolism and analyze its relationship with heat tolerance of rice. 【Methods】Eight rice varieties differed in heat tolerance including N22, GLA15 (Guanglu’ai 15), SDWG005, QLY681 (Quanliangyou 681), YLY900 (Y Liangyou 900), YLY1 (Y Liangyou 1), LYP9 (Liangyoupeijiu), and MH101 (Mianhui 101) were used as experimental materialsand exposed to room temperature and high temperature for 5 days. The correlations between activities of key enzymes in phenylpropane metabolism and main metabolite contents such as lignin, total flavonoids and total phenols were analyzed as well as the fertility of rice under high temperature stress during the meiotic stage. SDWG005 (heat resistant) and MH101 (heat sensitive) were used as experimental materials to analyze the effects of phenylpropane metabolism, carbohydrate metabolism and antioxidant defense system on heat tolerance of rice. 【Results】1) Compared with the control, the pollen vitality and fertilization rate of spikelets decreased significantly to various extents at high temperature. 2) HT(high temperature) significantly increased the activities of cinnamate-4-hydroxylase and 4-coumaric acid coenzyme A ligase, as well as the accumulation of lignin, flavonoids and total phenols in spikelets, with resistant varieties registering a higher growth than sensitive ones. 3) Correlation analysis showed that in response to HT pollen activity was significantly correlated with cinnamate-4-hydroxylase activity and lignin content, spikelet fertility was significantly correlated with lignin content, and lignin content was significantly correlated with flavonoid content. 4) Compared with MH101, lignin accumulation in the glumes of SDWG005 was significantly induced under HT. And higher cell wall peroxidase activities were maintained in SDWG005 under HT. 5) Compared with MH101, SDWG005 could maintain higher antioxidant enzyme activities under HT, resulting in less accumulation of H2O2and malondialdehyde. Under HT, the starch level in SDWG005 flowers was higher, and the expression levels of genes involved in acid invertase, sucrose synthase and ATPasewere significantly upregulated. 【Conclusion】High temperature stress increases the key enzyme activities and metabolite contents in the phenylpropanoid pathway in spikelets during the meiosis stage. The resistant variety accumulates more lignin and flavonoids during HT, has higher antioxidant enzyme activities, higher sucrose metabolism and energy utilization efficiency, thereby improving heat tolerance.
rice; high temperature; spikelet; phenylpropane metabolism; lignin; flavonoids
10.16819/j.1001-7216.2023.221112
2022-11-24;
2023-02-07。
湿地生态与农业利用教育部工程研究中心开放基金资助项目(KFT202012);主要粮食作物产业化湖北省协同创新中心开放基金资助项目(KFT202108)。
