β-谷甾醇对阿尔茨海默病模型小鼠认知功能的改善作用及其机制
2023-07-18王星烨孔祥日金梦丽王冰梅黎明全
王星烨, 孔祥日, 金梦丽, 王冰梅, 黎明全
(1.长春中医药大学中西医结合学院中西医结合实验室,吉林 长春 130117;2.长春中医药大学第三附属医院脑病科,吉林 长春 130118;3.长春中医药大学中医学院内分泌科,吉林 长春 130117;4.长春中医药大学临床医学院生理教研室,吉林 长春 130117)
阿尔茨海默病(Alzheimer’s disease,AD)是一种年龄相关性神经退行性疾病,随着人口年龄结构的改变,AD 患病率逐年升高,给患者家庭和社会带来巨大压力。研究[1-2]显示:AD 发病机制源于突触功能障碍,进而相继形成β 淀粉样蛋白(amyloid β-protein,Aβ)斑块和神经元纤维缠结(neurofibrillary tangles,NFT)及磷酸化tau 蛋白过度聚集。神经炎症在AD 发生发展中发挥了重要作用,以促炎细胞因子释放、免疫细胞浸润和胶质细胞激活为特征。研究[3-4]显示:神经炎症在神经退行性疾病的发病过程中起重要作用。当发生神经炎症时,免疫细胞被激活从而释放大量有毒细胞因子至外周神经元中,并进一步激活免疫细胞,形成恶性循环,促进疾病进展[5-7]。因此,抑制神经炎症可能是缓解神经退行性疾病的有效措施。
白细胞介素17 (interleukin-17,IL-17)是一种主要的促炎细胞因子,介导对病原体或组织损伤的反应,并驱动自身免疫性疾病[8]。研究[9]显示:IL-17 可能在各种神经退行性疾病中起重要作用。白细胞介素17A (interleukin-17A,IL-17A)为IL-17 家族成员的配体。转录因子p53 作用于细胞周期控制、DNA 损伤反应和细胞凋亡过程,维持基因组完整性。p53 蛋白能保持基因组的稳定性,避免或减少基因突变的发生,是防止神经元退化的各种补偿或防御机制的基础[10]。β-谷甾醇是一种植物甾醇,广泛分布于多种油料性植物及中药植物的根、茎、叶、种子和果实中[11]。目前已有研究[11-12]证实:β-谷甾醇在人体内发挥多种有益作用,包括抗菌、抗炎、抗氧化、抗动脉粥样硬化斑块和抗衰老等作用。研究[13-14]表明:β-谷甾醇与HT22 海马细胞膜结合,通过影响雌激素受体使磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)在膜脂募集,从而激活PI3K 信号通路,延缓因脑膜脂质过氧化而加快的AD 进展。β-谷甾醇还可通过与线粒体膜结合,提高增强线粒体内膜流动性腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)含量,延缓神经退行性疾病的进展[15]。
本研究对C57BL/6J 小鼠侧脑室注射β 淀粉样蛋白1-42(amyloid β-protein1-42,Aβ1-42)建立AD 模型,探讨β-谷甾醇通过抑制神经炎症对AD 模型小鼠认知功能的改善作用,并阐明其可能的分子机制,为延缓AD 进展,优化神经退行性疾病治疗方案提供新的策略。
1 材料与方法
1.1 实验动物、主要试剂和仪器72 只6~8 周龄的雄性C57BL/6J 小鼠(SPF 级)购自辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(吉)2011-0004。所有小鼠在光照/黑暗:12 h/12 h 环境中饲养,可自由饮食。β-谷甾醇(上海源叶生物科技有限公司),盐酸多奈哌齐片(中国卫才药业有限公司),Aβ1-42(上海Sigma Aldrich 贸易有限公司),小鼠 IL-17A 酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)检测试剂盒、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA 检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒和还原型谷胱甘肽(glutathione,GSH)水平测定试剂盒(北京普利莱基因技术有限公司),RNA 提取试剂盒和逆转录试剂盒(南京诺唯赞生物科技股份有限公司),重组Anti-p53 抗体、重组Anti-B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)抗体、重组Anti-β-actin抗体、重组Anti-Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、Anti-cleaved Caspase-3 抗体、Anti-Caspase-3 抗体和重组Anti-IL-17A 抗体(上海艾博抗贸易有限公司)。小鼠自由活动箱、新物体识别实验装置和Morris 水迷宫(北京诺达思信息技术有限责任公司),核酸定量仪NanoDrop 2000c、酶标仪Multiskan GO 和实时荧光定量PCR (realtime fluorescence quantitative PCR,RT-qPCR)仪(美国Thermo Fisher 公司),垂直电泳仪(美国Bio-Rad 公司),化学发光成像仪(Fusion FX7,法国Vilber 公司)。
1.2 实验动物造模和给药72 只C57BL/6J 小鼠随机分为对照组、假手术组、AD 组、盐酸多奈哌齐组(0.6 mg·kg-1盐酸多奈哌齐)、低剂量β-谷甾醇组(1.0 mg·kg-1β-谷甾醇)和高剂量β-谷甾醇组(4.0 mg·kg-1β-谷甾醇),每组12 只。除对照组和假手术组,其他各组小鼠按照参考文献[16]的方法制备小鼠AD 模型,Aβ1-42在37 ℃无菌生理盐水中孵育7 d,使蛋白肽结构发生变化,从而产生毒性。采用1.25% 阿佛丁溶液 (0.02 mL·g-1)对小鼠进行深度麻醉,采用微针向小鼠侧脑室注射5 μL Aβ1-42(1 g·L-1)建立AD 小鼠模型。假手术组小鼠侧脑室注射5 μL 生理盐水,对照组小鼠不予处理。盐酸多奈哌齐组、低剂量β-谷甾醇组和高剂量β-谷甾醇组小鼠自造模后灌胃β-谷甾醇或盐酸多奈哌齐,连续给药14 d,每日1 次。Aβ1-42注射造模7 d 后开始行为学观察实验。待行为学实验全部结束后,处死各组小鼠,取海马组织用于后续实验。
1.3 自主活动实验观察各组小鼠自由活动次数小鼠自由活动箱尺寸为(长×宽×高=0.30m×0.30 m×0.45 m),箱体底部和侧壁不透光,顶端设有红外摄像机。将小鼠放入箱中试验开始,小鼠自由活动10 min 后开始记录,采集30 min 内各组小鼠自由活动次数。以自由活动次数代表小鼠自主活动能力。
1.4 筑巢行为实验观察各组小鼠社会行为和日常活动能力筑巢行为实验区别于空间学习和记忆相关的行为实验,注重考察小鼠认知功能,其更关注小鼠日常活动和执行功能[17]。将群养的小鼠分成单笼饲养,适应48 h,每笼中换入厚度为1 cm 的玉米芯垫料,12 h 后放入方形无味薄纸片16 张(边长4 cm),18 h 后按照4 分法对筑巢质量进行评分:1 分,纸片无规则地分散在笼子中,未被撕咬;2 分,纸片较松散地聚集于笼子一侧,但无成型的巢,无明显的撕咬痕迹;3 分,纸片聚拢折叠成型,但只有较平的巢,无明显的撕咬痕迹;4 分,纸片聚拢折叠成较深的巢,并被撕咬成小块。
1.5 新物体辨别实验观察各组小鼠非空间记忆能力新物体识别实验是一种较为精细的行为学检测方法,通过记录小鼠对不同物体探索时间的区别,检测小鼠的非空间记忆能力[18]。按照参考文献[19]的方法操作,实验在隔音和避光的装置中进行,固定尺寸(长×宽×高=0.25 m×0.25 m×0.40 m),准备3 个足够重物体,其中2 个物体为颜色形状完全一致的立方体,另一个物体为与前2 个物体完全不同的圆锥体。在测试装置上方以60 W白光灯照射以消除阴影。适应阶段(第1 天):仅将小鼠置入测试盒的中央,适应活动5 min;训练阶段(第2 天):在测试盒内置入2 个颜色形状完全相同的物体,位置固定,将小鼠背对物体置入装置中,探索10 min;检测阶段(第3 天):取出相同物体中的1 个物体,并于相同位置置入颜色外观不同的物体,将小鼠背对物体置入装置中,探索10 min。记录不同阶段小鼠探索时长,并计算新旧物体辨别时间的比值,即辨别比(discrimination ratio,DR),以对新物体辨别时间和DR 代表小鼠非空间记忆能力。DR=探索新物体时间/探索物体总时间。
1.6 Morris 水迷宫实验观察各组小鼠空间记忆和空间辨别能力实验前在水池壁上做不同标记参照物,位置保持不变。定位巡航:水池十字均分为4 个象限,平台始终置于第1 象限的中央不变。将小鼠头朝池壁放入任一象限的水中,逃避潜伏期定义为小鼠找到平台所用时间。引导小鼠学习上台并停留10 s。每次学习上限90 s,若小鼠未成功登陆平台,记为90 s,每只小鼠每天间歇性训练3 次,连续训练5 d。空间探索:第7 天,移除平台,开始空间探索。将小鼠由第3 象限置入水中,记录逃避潜伏期和90 s 内小鼠穿越原平台的次数用于评价小鼠的空间记忆和空间辨别能力。
1.7 RT-qPCR 法检测各组小鼠海马组织中IL-17A 和p53 mRNA 表达水平采用TRIzol 法提取小鼠海马组织中总RNA,按照逆转录试剂盒将RNA 逆转录为cDNA,进行RT-qPCR 检测。引物由上海生工生物工程股份有限公司合成,引物序列见表1。采用2-ΔΔCt法计算各组小鼠海马组织中IL-17A 和p53 mRNA 表达水平。

表1 引物序列Tab.1 Primer sequences
1.8 Western blottig 法检测各组小鼠海马组织中IL-17A、p53、Caspase-3、cleaved Caspase-3、Bcl-2 和Bax 蛋白表达水平采用匀质仪破碎各组小鼠海马组织总蛋白,溶解于含1%蛋白酶抑制剂PSMF 和2%磷酸酶抑制剂的RIPA 溶液中。采用BCA 蛋白浓度测定试剂盒测定总蛋白浓度,加入5×Loading Buffer 煮样后离心。采用4%~20% 预制SDS-PAGE 分离蛋白,并转至PVDF 膜上。采用5% 脱脂奶粉封闭2 h,采用一抗(1∶1 000 稀释)孵育过夜,TBST 缓冲液洗涤后,HRP 标记的山羊抗兔或抗鼠二抗(1∶5 000 稀释)孵育2 h。采用ECL 化学发光试剂盒在化学发光成像仪上成像目的蛋白条带。以β-actin 为内参,采用SHST 图像分析软件(杭州申花科技有限公司)检测蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.9 ELISA 法检测各组小鼠海马组织中SOD 活性和GSH、TNF-α 及IL-17A 水平按照ELISA 检测试剂盒说明书操作,检测各组小鼠海马组织中SOD 活性和GSH、TNF-α 及IL-17A 水平。采用酶标仪检测波长450 nm 和412 nm 处吸光度(A)值,绘制标准曲线。根据标准曲线和A 值计算海马组织中SOD 活性和GSH、TNF- α 及IL-17A 水平。
1.10 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组小鼠自主活动次数,筑巢行为评分,对新物体辨别时间,DR,逃避潜伏期,跨越平台次数,海马组织中IL-17A 和p53 mRNA 及蛋白表达水平,海马组织中Caspase 3、cleaved Caspase-3、Bax 和Bcl-2 蛋白表达水平,SOD 活性和GSH、TNF-α 及IL-17A 水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用Dunnett’st检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠自主活动能力和筑巢行为评分各组小鼠自主活动次数比较差异均无统计学意义(P>0.05)。与对照组比较,AD 组小鼠筑巢行为评分明显降低(P<0.01)。与AD 组比较,盐酸多奈哌齐组和低剂量β-谷甾醇组小鼠筑巢行为评分升高(P<0.05)。见表2。
表2 各组小鼠自主活动次数和筑巢行为评分Tab.2 Number of autonomic activity and scores of nesting behavior of mice in various groups (n=12,±s)
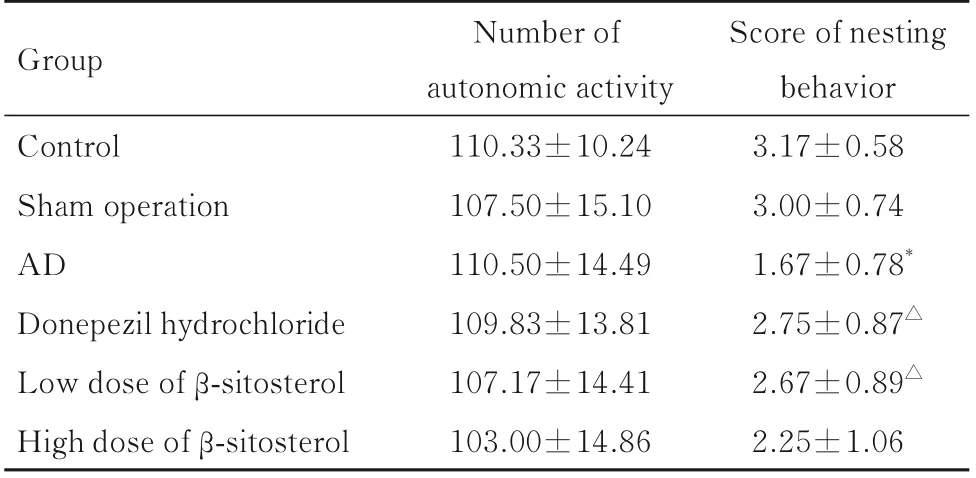
表2 各组小鼠自主活动次数和筑巢行为评分Tab.2 Number of autonomic activity and scores of nesting behavior of mice in various groups (n=12,±s)
*P<0.01 vs control group; △P<0.05 vs AD group.
Group Score of nesting behavior Control Sham operation AD Donepezil hydrochloride Low dose of β-sitosterol High dose of β-sitosterol Number of autonomic activity 110.33±10.24 107.50±15.10 110.50±14.49 109.83±13.81 107.17±14.41 103.00±14.86 3.17±0.58 3.00±0.74 1.67±0.78*2.75±0.87△2.67±0.89△2.25±1.06
2.2 各组小鼠非空间记忆能力与对照组比较,AD 组小鼠对新物体辨别时间明显减少(P<0.01),且DR 明显降低(P<0.01)。与AD 组比较,盐酸多奈哌齐组和高剂量β-谷甾醇组小鼠对新物体辨别时间明显增加(P<0.01),DR 差异无统计学意义(P>0.05);低剂量β-谷甾醇组小鼠对新物体辨别时间差异无统计学意义(P>0.05),DR 升高(P<0.05)。见表3。
表3 各组小鼠对新物体辨别时间和DRTab.3 Indentification time of new object and DR of mice in various groups(n=12,±s)

表3 各组小鼠对新物体辨别时间和DRTab.3 Indentification time of new object and DR of mice in various groups(n=12,±s)
*P<0.01 vs control group; △P<0.05, △△P<0.01 vs AD group.
Group DR Control Sham operation AD Donepezil hydrochloride Low dose of β-sitosterol High dose of β-sitosterol Idenfification time of new object (t/s)57.56±11.78 54.30±10.96 34.47±7.94*50.88±11.30△△39.37±10.68 44.53±4.01△△0.65±0.14 0.64±0.15 0.36±0.11*0.48±0.15 0.51±0.14△0.45±0.10
2.3 各组小鼠空间记忆和空间辨别能力随着小鼠训练时长增加,各组小鼠逃避潜伏期逐渐缩短,其中对照组小鼠逃避潜伏期缩短幅度较大,盐酸多奈哌齐组和低及高剂量β-谷甾醇组小鼠逃避潜伏期也呈缩短趋势。与对照组比较,AD 组小鼠在定位巡航训练第3 和5 天逃避潜伏期明显延长(P<0.01)。与AD 组比较,盐酸多奈哌齐组和低及高剂量β-谷甾醇组小鼠训练第1 天逃避潜伏期差异无统计学意义(P>0.05),盐酸多奈哌齐组和低及高剂量β-谷甾醇组小鼠训练第3和5天逃避潜伏期明显延长(P<0.05或P<0.01)。与对照组比较,AD组小鼠跨越平台次数明显增加(P<0.01)。与AD 组比较,盐酸多奈哌齐组和低及高剂量β-谷甾醇组小鼠跨越平台次数明显减少(P<0.01)。见表4。
表4 各组小鼠逃避潜伏期和跨越平台次数Tab.4 Escape latencies and number of crossing platform of mice in various groups(±s)
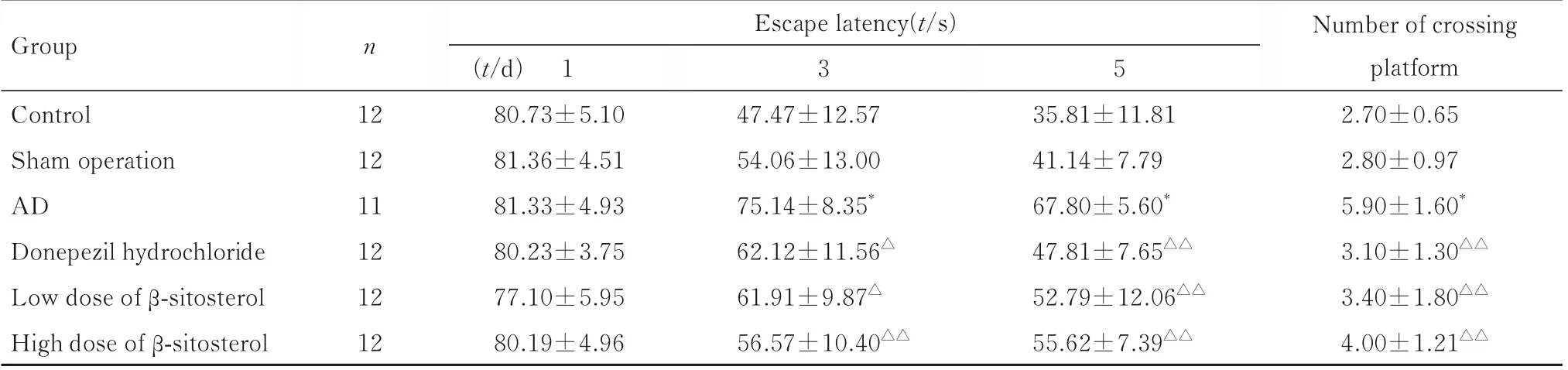
表4 各组小鼠逃避潜伏期和跨越平台次数Tab.4 Escape latencies and number of crossing platform of mice in various groups(±s)
*P<0.01 vs control group; △P<0.05, △△P<0.01 vs AD group.
Group n Escape latency(t/s)3 5 Number of crossing platform Control Sham operation AD Donepezil hydrochloride Low dose of β-sitosterol High dose of β-sitosterol 12 12 11 12 12 12(t/d) 1 80.73±5.10 81.36±4.51 81.33±4.93 80.23±3.75 77.10±5.95 80.19±4.96 47.47±12.57 54.06±13.00 75.14±8.35*62.12±11.56△61.91±9.87△56.57±10.40△△35.81±11.81 41.14±7.79 67.80±5.60*47.81±7.65△△52.79±12.06△△55.62±7.39△△2.70±0.65 2.80±0.97 5.90±1.60*3.10±1.30△△3.40±1.80△△4.00±1.21△△
2.4 各组小鼠海马组织中IL-17A 和p53 mRNA 表达水平与对照组比较,AD 组小鼠海马组织中IL-17A 和p53 mRNA 表达水平均明显升高(P<0.01)。与AD 组比较,低和高剂量β-谷甾醇组小鼠海马组织中IL-17A mRNA 表达水平降低(P<0.05);盐酸多奈哌齐组和高剂量β-谷甾醇组小鼠海马组织中p53 mRNA 表达水平降低(P<0.05)。见图1。
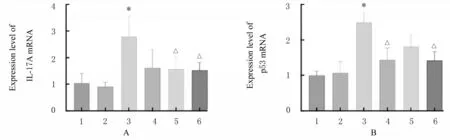
图1 各组小鼠海马组织中IL-17A(A)和p53(B) mRNA 表达水平Fig.1 Expression levels of IL-17A(A) and p53 (B) mRNA in hippocampus tissue of mice in various groups
2.5 各组小鼠海马组织中IL-17A、p53、Caspase-3、cleaved Caspase-3、Bax 和Bcl-2 蛋白表达水平与对照组比较,AD 组小鼠海马组织中IL-17A、p53 和cleaved Caspase-3 蛋白表达水平及Bax/Bcl-2 比值明显升高(P<0.01)。与AD 组比较,低剂量β-谷甾醇组小鼠海马组织中IL-17A 和p53 蛋白表达水平及Bax/Bcl-2 比值明显降低(P<0.05 或P<0.01),盐酸多奈哌齐组小鼠海马组织中cleaved Caspase-3 蛋白表达水平明显降低(P<0.01),高剂量β-谷甾醇组小鼠海马组织中IL-17A、cleaved Caspase-3 蛋白表达水平和Bax/Bcl-2 比值明显降低(P<0.05 或P<0.01)。见图2。
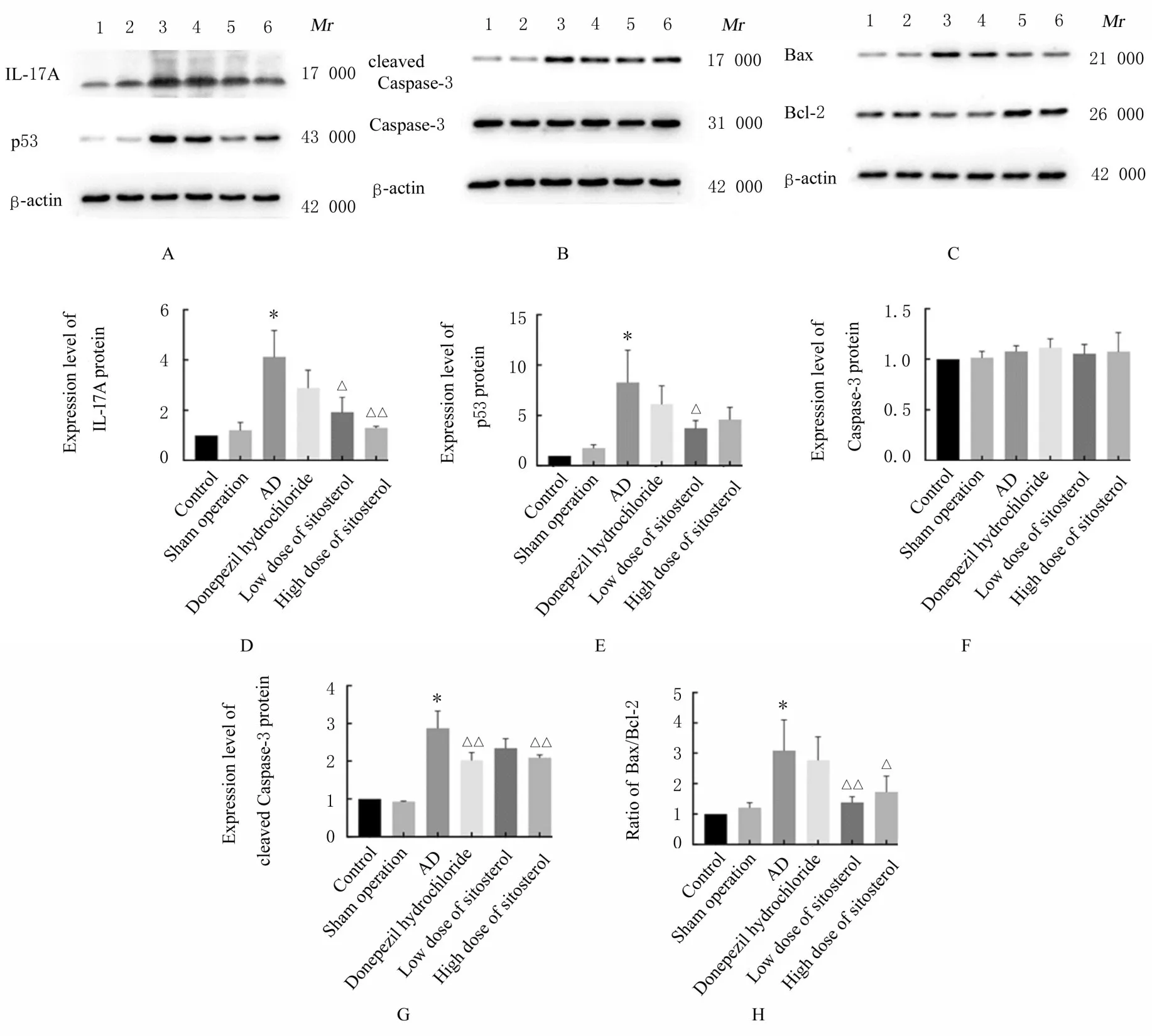
图2 各组小鼠海马组织中凋亡相关蛋白表达电泳图(A-C)和直条图(D-H)Fig.2 Electrophoregrams(A-C) and histograms(D-F) of expressions of apoptosis-related proteins in hippocampus tissue of mice in various groups
2.6 各组小鼠海马组织中SOD 活性和GSH 水平与对照组比较,AD 组小鼠海马组织中SOD 活性和GSH 水平明显降低(P<0.01)。与AD 组比较,高剂量β-谷甾醇组小鼠海马组织中SOD 活性和GSH 水平明显升高(P<0.01),盐酸多奈哌齐组和低剂量β-谷甾醇组小鼠海马组织中SOD 活性和GSH 水平均有升高趋势,但差异无统计学意义(P>0.05)。见表5。
表5 各组小鼠海马组织中SOD 活性和GSH 水平Tab.5 SOD activities and GSH levels in hippocampus tissue of mice in various groups(n=3,±s)

表5 各组小鼠海马组织中SOD 活性和GSH 水平Tab.5 SOD activities and GSH levels in hippocampus tissue of mice in various groups(n=3,±s)
*P<0.01 vs control group; △P<0.01 vs AD group.
Group Control Sham operation AD Donepezil hydrochloride Low dose of β-sitosterol High dose of β-sitosterol SOD[λB/(U·mL-1)]56.97±5.51 54.77±6.30 37.41±9.94*44.18±14.76 40.15±7.89 53.56±8.13△GSH[cB/(μmol·L-1)]123.47±27.99 123.71±22.85 70.59±9.64*88.30±10.95 93.70±16.22 109.59±13.59△
2.7 各组小鼠海马组织中TNF-α 和IL-17A 水平
与对照组比较,AD 组小鼠海马组织中TNF-α和IL-17A 水平明显升高(P<0.01)。与AD 组比较,低剂量β-谷甾醇组小鼠海马组织中TNF-α 水平降低(P<0.05),高剂量β-谷甾醇组小鼠海马组织中IL-17A 水平降低(P<0.05)。见表6。
表6 各组小鼠海马组织中TNF-α 和IL-17A 水平Tab.6 Levels of TNF-α and IL-17A in hippocampus tissue of mice in various groups[n=3,±s,ρB/(ng·L-1)]

表6 各组小鼠海马组织中TNF-α 和IL-17A 水平Tab.6 Levels of TNF-α and IL-17A in hippocampus tissue of mice in various groups[n=3,±s,ρB/(ng·L-1)]
*P<0.01 vs control group;△P<0.05 vs AD group.
Group Control Sham operation AD Donepezil hydrochloride Low dose of β-sitosterol High dose of β-sitosterol IL-17A 192.98±57.22 218.30±62.85 489.49±45.26*454.13±92.60 415.89±64.78 381.97±94.82△TNF-α 467.63±36.50 495.21±54.06 571.12±52.05*547.58±32.65 507.49±41.57△525.28±39.31
3 讨 论
本研究采用小鼠侧脑室注射Aβ1-42建立小鼠AD模型,通过检测小鼠海马组织中IL-17A 蛋白表达水平,发现其在海马组织中高表达,证实AD 小鼠海马周围组织神经炎症。使用β-谷甾醇治疗后,小鼠海马组织中IL-17A 蛋白表达水平降低。CHEN 等[20]研究显示:IL-17 水平升高与AD 疾病的进展有关。CRISTIANO 等[21]研究表明:采用IL-17 中和抗体治疗减轻了AD 小鼠的神经炎症和记忆障碍,并提出了通过中和IL-17 可能成为未来治疗AD 潜在途径。因此,靶向IL-17 可能是治疗AD 的潜在途径,本研究为靶向IL-17 治疗AD 提供了理论基础。
本研究中AD 小鼠海马组织中p53 蛋白表达水平升高,Bax/Bcl-2 比值和cleaved Caspase-3 蛋白表达水平升高。β-谷甾醇治疗后,Bax/Bcl-2 比值降低,提示β-谷甾醇对于p53 信号通路抑制细胞凋亡的发生可能是通过调控Bax 和Bcl-2 蛋白表达水平进行的。AD 是一种以蛋白质聚集物为特征的神经退行性疾病,p53 聚集后激活,以应对威胁基因组稳定性的各种压力源[22-23]。研究[24-25]表明:只有在AD 的早期阶段,p53 蛋白才能在DNA 修复中发挥其功能。AD 大鼠脑组织中p53 蛋白表达水平升高,并维持持续的tau 蛋白过度磷酸化,而细胞中Aβ 蓄积有助于促进下游p53 效应[22,26]。激活的p53 诱导细胞周期停滞等功能,而DNA 修复机制的失败导致p53 介导的细胞凋亡[27]。
氧化应激在AD 进程中的作用十分重要。本研究结果显示:AD 组小鼠海马组织中SOD 活性和GSH 水平降低,提示中枢系统的过度氧化应激。而高剂量β-谷甾醇治疗后,GSH 水平明显升高。自由基可以促进Aβ 蓄积,造成tau 蛋白过度磷酸化,使神经元发生基因突变。当机体无法维持自由基与清除自由基的平衡时,积聚的过氧化物与组织和细胞中的脂质及蛋白质等过度反应,造成组织损伤和细胞凋亡[28]。
综上所述,本研究采用小鼠侧脑室注射Aβ1-42建立AD 模型,采用β-谷甾醇进行干预治疗,以多种行为学观察实验评估β-谷甾醇对AD 小鼠认知功能的改善作用,并采用分子生物学的方法检测到小鼠海马组织中IL-17 和p53 表达水平的改变,提示β-谷甾醇可能通过IL-17-p53 信号通路作用机制来抑制神经炎症、神经细胞凋亡和氧化应激,改善AD 小鼠的认知功能。
