芹菜素对小鼠RAW264.7 巨噬细胞极化和炎症反应的作用及其机制
2023-07-18李海涛胡国富滕云飞
李海涛, 李 沁, 蔡 飞, 胡国富, 滕云飞
(华中科技大学同济医学院附属协和医院血管外科,湖北 武汉 430000)
动脉粥样硬化是一种常见的原发性血管疾病,以动脉壁增厚和局部炎症为主要特征。近年来随着生活水平的提高,在全球范围内动脉粥样硬化的发病率和死亡率逐年升高[1]。动脉粥样硬化通常是一种慢性炎症的过程,研究[2-3]发现:氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)可刺激炎症细胞分泌炎症因子,同时促进单核细胞趋化为巨噬细胞,ox-LDL 被巨噬细胞吞噬形成泡沫细胞,在炎症因子的刺激下平滑肌细胞迁移并加速动脉斑块产生,且使得斑块不稳定、较易破裂[2-3]。斑块破裂后会在血管内形成急性血栓,导致心肌梗死和中风[4]。巨噬细胞根据其激活状态主要分为M1 巨噬细胞和M2 巨噬细胞,前者主要由辅助型T 细胞1(helper T cell 1,Th1)细胞因子如γ-干扰素(interferon-γ,IFN-γ)等诱导产生,导致促炎细胞因子的产生;后者则主要由辅助型T细胞2(helper T cell 2,Th2)细胞因子如白细胞介素4(interleukin-4,IL-4)等诱导产生,在机体内发挥着抗炎、修复和促进血管生成活性物质的作用[5]。研究[6]表明:巨噬细胞具有可塑性,其M1和M2 细胞表型可以互相转换。因此可以通过调节斑块中巨噬细胞的表型及相对比例达到治疗动脉粥样硬化的作用。芹菜素(apigenin,API)是一种黄酮类化合物,具有“植物激素”之称[7]。ASHRAFIZADEH 等[8]发现:API 具有抗肿瘤、抗炎症、降血压和抗氧化等多种功效。研究[9]表明:API 能够抑制动脉粥样硬化斑块的形成,但其对动脉粥样硬化中巨噬细胞表型调控的相关机制尚未完全阐明。本研究通过使用API 作用RAW264.7源性泡沫细胞模型,探讨API 对其炎症反应和极化的作用,并阐明其可能的机制,为API 治疗动脉粥样硬化提供实验依据。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠单核巨噬细胞系RAW264.7 购自武汉普诺赛生物公司。DMEM 培养基、1%青-链霉素溶液和0.25%胰蛋白酶溶液购自武汉普诺赛生物公司,API 和CCK-8 试剂盒购自美国MCE 公司,胎牛血清购自江苏依科赛生物公司,ox-LDL 和油红O 染色液购自北京索莱宝科技有限公司,RIPA 裂解液和BCA 蛋白浓度测定试剂盒购自上海碧云天生物公司。白细胞介素1β(interleukin-1β,IL-1β)、IL-4、白细胞介素10(interleukin-10,IL-10)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)试剂盒等酶联免疫吸附测 定 (enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉华美生物科技有限公司,HRP 标记羊抗兔二抗、兔多抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)、诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)、精 氨 酸 酶 1(arginase-1,Arg-1)、核因子κB (nuclear factor kappa B,NF-κB)和信号转导与转录激活因子6(signal transducer and activator of transcription 6,STAT6)购自武汉三鹰生物技术有限公司,兔单抗磷酸化NF-κB (phosphorylated NF-κB,p-NFκB)和磷酸化STAT6 (phosphorylated STAT6,p-STAT6)购自美国CST 公司。离心机购自德国Eppendorf 公司,超低温冰箱购自青岛海尔股份有限公司,CO2恒温培养箱购自日本Sanyo 公司。
1.2 细胞培养将RAW264.7 细胞培养于含10%胎牛血清和1% 青-链霉素的DMEM 完全培养基中,置于37 ℃、5% CO2相对饱和湿度的孵育箱中培养。根据细胞生长情况2~3 d 传代1 次,采用0.25 %胰酶消化,取对数生长期生长状态良好的细胞进行实验。
1.3 CCK-8 法检测RAW264.7 细胞增殖率取处于对数生长期、生长状态良好的RAW264.7 细胞,用培养基将细胞密度调整至1×105mL-1,接种于96 孔细胞培养板,每孔100 μL 细胞悬液,同时设空白组,37 ℃培养过夜,在细胞孔周围孔内加入无菌PBS 缓冲液。将细胞分为RAW264.7 组(不做任何处理)和RAW264.7+API 组(2、4、8、16 和32 μmol·L-1API),每组3 个复孔,37 ℃培养箱中分别培养;细胞培养24 h 后,每孔加入10 μL CCK-8 试剂,37 ℃培养2 h;酶标仪于波长450 nm处测定各孔吸光度(A)值,计算各组细胞增殖率。细胞增殖率=实验组A 值/对照组A 值×100%。依据CCK-8 实验选择无毒的低浓度(2 μmol·L-1)和高浓度(8 μmol·L-1)的API 作为后续实验浓度。
1.4 油红O 染色观察RAW264.7 细胞中泡沫细胞形态表现RAW264.7 细胞分RAW264.7 组、RAW264.7+ox-LDL 组、RAW264.7+ox-LDL+低剂量API 组和RAW264.7+ox-LDL+高剂量API 组。其中RAW264.7 组为正常RAW264.7 细胞,作为对照组;RAW264.7+ox-LDL 组为模型组,采用0.08 g·L-1ox-LDL 诱导RAW264.7 细胞24 h 建立RAW264.7 源性泡沫细胞模型[10];RAW264.7+ox-LDL+ 低 剂 量 API 组 和RAW264.7+ox-LDL+高剂量API 组为API 药物处理组,分别采用2和8 μmol·L-1API及0.08 g·L-1的ox-LDL 处理细胞24 h。各组细胞接种于铺有盖玻片的6 孔细胞培养板中,处理24 h 后弃细胞培养液,PBS 缓冲液清洗细胞3 次,多聚甲醛固定10 min,油红O 染色15 min;60%油红O 异丙醇清洗,即刻PBS 缓冲液清洗3 次,光学显微镜下观察各组细胞形态表现。
1.5 ELISA法检测各组细胞培养上清液中TNF-α、IL-1β、IL-4 和IL-10 水平细胞分组同“1.4”步骤,药物处理细胞24 h 后收集细胞培养上清液,采用ELISA 试剂盒检测M1 巨噬细胞极化相关炎症因子TNF-α 和IL-1β 及M2 巨噬细胞极化相关抗炎因子IL-4 和IL-10 水平,单位均为ng·L-1,操作步骤参考试剂盒说明书。
1.6 Western blotting 法检测各组细胞中NF-κB p65、p-NF-κB p65、iNOS、STAT6、p-STAT6 和Arg-1 蛋白表达水平细胞分组同“1.4”步骤,药物处理细胞24 h 后收集细胞,根据蛋白提取试剂盒步骤提取细胞总蛋白。蛋白定量30 μg 进行SDSPAGE 电泳,转移至PVDF 膜上,采用5%脱脂奶粉室温下封闭2 h,分别加入GAPDH 一抗(1∶20 000)、NF-κB p65 一抗(1∶2 000)、p-NF-κB p65 (1∶500)、iNOS (1∶1 000)、STAT6 (1:1 000)、p-STAT6(1∶500)和Arg-1(1∶1 000),4 ℃孵育过夜,TBST 清洗3 次后,加入辣根过氧化物酶标记的二抗(1∶5 000),室温下孵育2 h,加入ECL 化学发光显影后扫描胶片,采用Image J软件分析蛋白条带灰度值。以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.7 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组RAW264.7 细胞增殖率,细胞培养上清液中TNF-α、IL-1β、IL-4 和IL-10 水平,细胞中NF-κB p65、p-NF-κB p65、iNOS、STAT6、p-STAT6 和Arg-1 蛋白表达水平均呈正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组RAW264.7 细胞增殖率CCK-8 检测结果显示:与RAW264.7 组比较,RAW264.7+API组2、4 和8 μmol·L-1API 细胞增殖率差异无统计学意义(P>0.05),RAW264.7+API 组(16 和32 μmol·L-1API)细胞增殖率降低(P<0.05)。依据CCK-8 法检测结果选择无毒的低浓度2 μmol·L-1和高浓度8 μmol·L-1作为后续实验的API 浓度。见图1。

图1 CCK-8 法检测各组RAW264.7 细胞增殖率Fig.1 Proliferation rates of RAW264.7 cells in various groups detected by CCK-8 method
2.2 各组RAW264.7 细胞中泡沫细胞形成情况油红O 染色结果显示:RAW264.7 组极少数的RAW264.7 细胞被油红O 染色;RAW264.7+ox-LDL 组较多的细胞被染成暗红色,胞内脂质明显增加,表明成功建立了RAW264.7 源性泡沫细胞;RAW264.7+ox-LDL+ 低剂量 API 组和RAW264.7+ox-LDL+高剂量API 组少量细胞被油红O 染色,且其染色程度与剂量呈负相关关系。见图2。
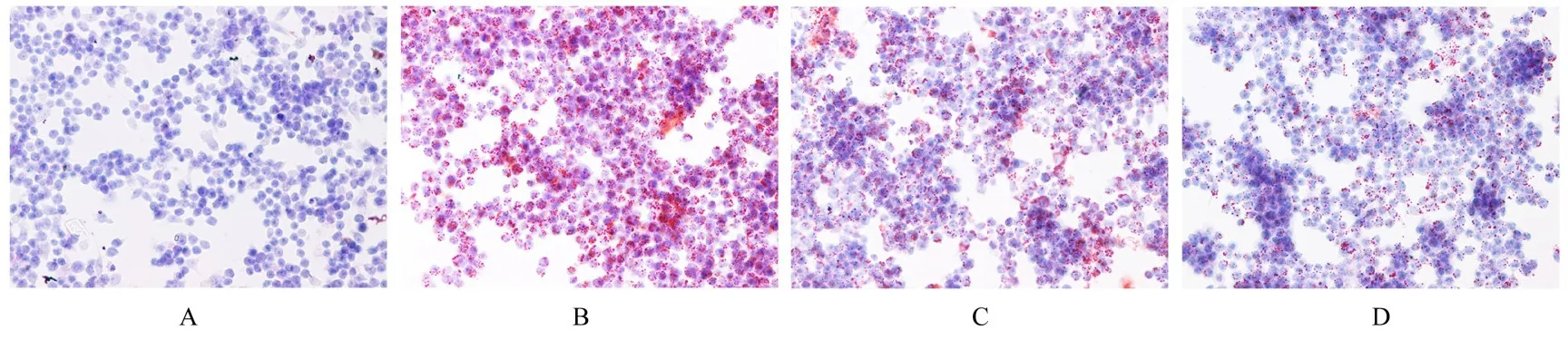
图2 油红O 染色观察各组RAW264.7 细胞中泡沫细胞形态表现(×400)Fig.2 Morphology of foam cells in RAW264.7 cells in various groups detected by Oil red O staining(×400)
2.3 各组RAW264.7 细胞培养上清液中TNF-α、IL-1β、IL-4 和IL-10 水平ELISA 检测结果显示:与RAW264.7 组比较,RAW264.7+ox-LDL 组和RAW264.7+ox-LDL 低剂量及高剂量API 组细胞培养上清液中TNF-α 和IL-1β 水平均升高(P<0.05),IL-4 和IL-10 水平均降低(P<0.05)。与RAW264.7+ox-LDL 组 比 较,RAW264.7+ox-LDL+低剂量和高剂量API 组细胞培养上清液中TNF-α 和IL-1β 水平均降低(P<0.05),IL-4 和IL-10 水平均升高(P<0.05)。与RAW264.7+ox-LDL+ 低剂量API 组比较,RAW264.7+ox-LDL+高剂量API 组细胞中TNF-α 和IL-1β 水平均降低(P<0.05),IL-4 和IL-10 水平均升高(P<0.05)。见图3。
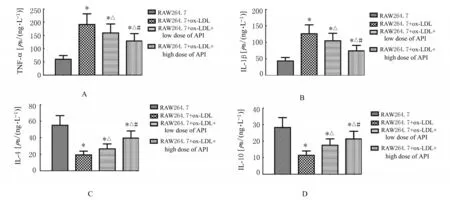
图3 ELISA 法检测各组RAW264.7 细胞培养上清液中TNF-α(A)、IL-1β(B)、IL-4(C)和IL-10(D)水平Fig.3 Levels of TNF-α(A), IL-1β(B), IL-4(C),and IL-10(D) in culture supernatant of RAW264.7 cells in various groups detected by ELISA method
2.4 各组RAW264.7 细胞中Arg-1 和iNOS 蛋白表达水平Western blotting 法检测结果显示:与RAW264.7 组比较,RAW264.7+ox-LDL 组、RAW264.7+ox-LDL+ 低 剂 量 API 组 和RAW264.7+ox-LDL+高剂量API 组细胞中Arg-1蛋白表达水平降低(P<0.05),iNOS 蛋白表达水平升高(P<0.05)。与RAW264.7+ox-LDL 组比较,RAW264.7+ox-LDL+ 低剂量 API 组和RAW264.7+ox-LDL+高剂量API 组细胞中Arg-1蛋白表达水平均升高(P<0.05),iNOS 蛋白表达水平均降低(P<0.05)。与RAW264.7+ox-LDL+低剂量API 组比较,RAW264.7+ox-LDL+高剂量API 组细胞中Arg-1 蛋白表达水平升高(P<0.05),iNOS 蛋白表达水平降低(P<0.05)。见图4。

图4 Western blotting 法检测各组RAW264.7 细胞中Arg-1 和iNOS 蛋白表达电泳图(A)和直条图(B,C)Fig.4 Electrophoregram(A) and histograms(B, C) of expressions of Arg-1 and iNOS proteins in RAW264.7 cells in various groups detected by Western blotting method
2.5 各组RAW264.7 细胞中NF-κB p65、p-NF-κB p65、STAT6 和p-STAT6 蛋白表达水平Western blotting 法检测结果显示:与RAW264.7 组比较,RAW264.7+ox-LDL 组、RAW264.7+ox-LDL+低剂量API 组和RAW264.7+ox-LDL+高剂量API 组细胞中p-NF-κB p65 蛋白表达水平升高(P<0.05),p-STAT6 蛋白表达水平降低(P<0.05)。与 RAW264.7+ox-LDL 组 比 较,RAW264.7+ox-LDL+ 低 剂 量 API 组 和RAW264.7+ox-LDL+高剂量API 组细胞中p-NFκB p65 蛋白表达水平降低(P<0.05),p-STAT6蛋白表达水平升高(P<0.05)。与RAW264.7+ox-LDL+低剂量API 组比较,RAW264.7+ox-LDL+高剂量API 组细胞中p-NF-κB p65 蛋白表达水平降低(P<0.05),p-STAT6 蛋白表达水平升高(P<0.05)。各组细胞中NF-κB p65 和STAT6蛋白表达水平差异均无统计学意义(P>0.05)。见图5。
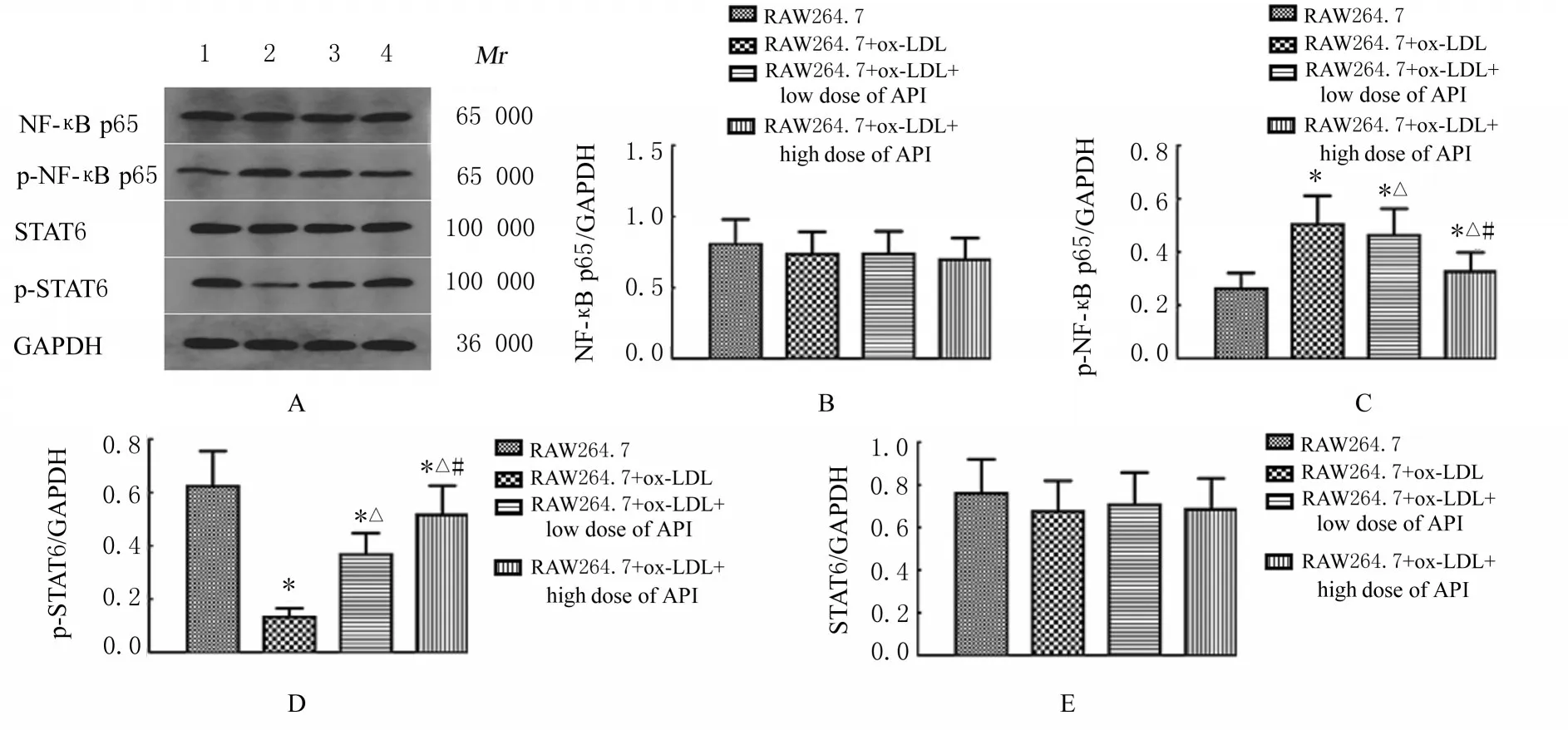
图5 Western blotting 法检测各组RAW264.7 细胞中NF-κB p65、p-NF-κB p65、STAT6 和p-STAT6 蛋白表达电泳图(A)和直条图(B-E)Fig.5 Electrophoregram(A) and histograms(B-E) of expressions of NF-κB p65, p-NF-κB p65,STAT6, and p-STAT6 proteins in RAW264.7 cells in various groups detected by Western blotting method
3 讨 论
动脉粥样硬化进展与动脉内膜泡沫细胞形成有密切关联。研究[11]证实:动脉内膜出现泡沫细胞是动脉粥样硬化的早期表现之一,而单核细胞分化而来的巨噬细胞是泡沫细胞的重要来源。泡沫细胞的主要特征是细胞中含有多种类型的脂质,当出现动脉粥样硬化后体内胆固醇摄取和排出间的平衡被破坏,从而诱导泡沫细胞大量生成[12]。本研究通过油红O 染色观察发现:RAW264.7+ox-LDL 组泡沫细胞形成增多,采用API 作用后泡沫细胞形成减少;表明API 可以有效调节动脉粥样硬化泡沫细胞形成,这可能是其可有效治疗动脉粥样硬化的具体机制之一。CLAYTON 等[13]研究发现:API 可以防止泡沫细胞形成从而改善动脉粥样硬化。
动脉粥样硬化是以局部炎症为特征的原发性血管疾病,而巨噬细胞与炎症有密切关联[14]。巨噬细胞具有M1 和M2 两种分化表型,其中M1 巨噬细胞具有促炎作用,并促进内皮细胞增殖产生iNOS和内皮素等血管活性分子,加速不稳定斑块的破裂,促进动脉粥样硬化的发展[15-16]。研究[17]显示:M1 巨噬细胞分泌代表性炎症因子主要包括TNF-α、IL-1β 和iNOS 等。TNF-α 可刺激血管内皮细胞,使中性粒细胞、单核细胞和淋巴细胞黏附于内皮细胞表面分泌炎症因子[18]。iNOS 主要存在于不稳定型斑块中,其水平升高易导致斑块破裂,加速动脉粥样硬化的发展[19]。M2 巨噬细胞具有抗炎作用,多出现在稳定的斑块中,同时可分泌IL-10 和IL-4等抗炎因子,抑制炎症反应,同时具有吞噬组织碎片和清除凋亡小体的作用,进一步减轻炎症反应,缓解动脉粥样硬化的发展[20]。研究[21]显示:M2极化代表抗炎因子主要包括IL-4、IL-10 和Arg-1等,当巨噬细胞分化为M2 巨噬细胞,抗炎因子可以抑制炎症因子造成的损伤,缓解动脉粥样硬化[21]。本研究结果显示:RAW264.7+ox-LDL 组细胞M1 巨噬细胞标志物iNOS 和炎症因子TNF-α及IL-1β 水平升高,M2 巨噬细胞标志物Arg-1 和抗炎因子IL-4 及IL-10 水平降低,API 作用后细胞中iNOS、TNF-α 和IL-1β 水平降低,Arg-1、IL-4 和IL-10 水平升高;表明API 可以调节巨噬细胞的表型,能促进炎症相关的M1 巨噬细胞减少,抗炎相关的M2 巨噬细胞增加,从而改善RAW264.7 的炎症反应。NF-κB 信号通路和STAT6 信号通路是常见的炎症调控信号通路,其作用机制与调控巨噬细胞M1/M2 极化转变密切相关。研究[22-23]显示:巨噬细胞中NF-κB 通路激活后,p-NF-κB 蛋白表达水平升高进而激活下游炎症相关靶基因表达,促进巨噬细胞分化为M1巨噬细胞;巨噬细胞中STAT6 通路激活后,p-STAT6 蛋白表达水平升高,活化的p-STAT6 蛋白进入细胞核调控下游应答基因的表达,促使巨噬细胞分化为M2 巨噬细胞。本研究结果显示:RAW264.7+ox-LDL组细胞中p-NF-κB p65蛋白表达水平升高,p-STAT6 蛋白表达水平降低,表明NF-κB 通路被激活,STAT6 通路被抑制。API 作用后p-NF-κ B p65 蛋白表达水平降低,p-STAT6 蛋白表达水平升高,表明API 调控M1 和M2 巨噬细胞表型可能与NF-κB 及STAT6 通路有密切关联。
综上所述,API 可降低RAW264.7 源性泡沫细胞内脂质水平,抑制泡沫细胞的形成及调控巨噬细胞向M2 极化改善炎症反应,其调控巨噬细胞极化转变的机制可能与NF-κB 及STAT6 通路有关。
