circRASSF2靶向miR-1343-3p对乳腺癌MDA-MB-231细胞增殖和凋亡的影响
2023-07-17赵津津王振宇马贞秀
赵津津,王振宇,马贞秀
乳腺癌是一种严重危害女性健康的恶性肿瘤,随着对乳腺癌发病机制认识的加深,分子靶向逐渐应用于乳腺癌的治疗[1-2]。确定潜在的分子靶标有助于开发新的靶向治疗药物。研究表明,circRNA在多种癌症中异常表达,可作为肿瘤诊断的生物标志物,可提供新的癌症治疗的靶标[3]。circRASSF2是位于20 号染色体且来源于Ras 相关序列家族2(ras association domain family 2,RASSF2)的一种circRNA。文献报道,circRASSF2在喉鳞状细胞癌组织和细胞系中显著上调,敲除circRASSF2 可通过上调miR-302b-3p/IGF-1R 轴显著抑制喉鳞癌细胞增殖和迁移[4]。circRASSF2在结直肠癌组织和细胞系中上调,敲除circRASSF2 可通过上调miR-195-5p、下调卷曲蛋白4(frizzled 4,FZD4)表达,从而抑制结直肠癌细胞的增殖并促进其凋亡[5]。然而,circRASSF2在乳腺癌中的作用及机制尚不清楚。在卵巢癌中,miR-1343-3p 表达下调,miR-1343-3p 的过表达可抑制卵巢癌的细胞生长和迁移[6]。LINC02323可通过海绵化miR-1343-3p促进肺腺癌的上皮-间质转化和转移[7]。lncRNA GAS8-AS1 通过靶向下调miR-1343-3p/自噬相关蛋白7 轴,从而促进甲状腺癌细胞的自噬[8]。据此,笔者认为miR-1343-3p 可能参与调控了多种癌症的进展。目前,miR-1343-3p 对乳腺癌的影响及其是否被circRASSF2 调控尚未知。 本研究旨在探讨circRASSF2 对乳腺癌细胞增殖、凋亡的影响及其与miR-1343-3p的靶向调控关系。
1 材料与方法
1.1 主要材料
收集2021 年1 月—2022 年4 月于青海省第五人民医院收治的37例乳腺癌患者的癌及癌旁组织,均为手术切除后超低温冰箱内保存。乳腺癌细胞株MDA-MB-231(上海烜雅生物科技有限公司);转染物si-circRASSF2及其阴性对照物si-NC,miR-1343-3p 及其阴性对照物miR-NC(广州锐博生物有限公司);Lipofectamine®2000 Transfection Reagentt 转染试剂购自美国Invitrogen公司;抗体Cleaved-caspase 3、Cleavedcaspase 9(英国abcam 公司);Trizol 试剂、逆转录荧光定量聚合酶链反应(RT-qPCR)试剂盒(日本Takara公司);蛋白提取试剂盒(上海臻诺生物科技有限公司);四甲基偶氮唑盐比色法(MTT)试剂盒、凋亡试剂盒(日本同仁研究所);RPMI-1640培养基(美国Gibco 公司);双荧光素酶报告实验试剂盒(上海泽叶生物科技有限公司);T100PCR仪(美国Bio-Rad公司);Multiskan GO 酶标仪、Western blot 系统、凝胶成像分析系统和细胞培养箱(美国赛默飞世尔公司);FACSAria™Fusion 流式细胞仪(美国BD公司)。
1.2 细胞转染与分组
将MDA-MB-231 细胞培养于RPMI-1640 培养基中,至对数生长期时按5.0×105个/孔接种至96 孔板。将细胞分为miR-1343-3p 组(转染miR-1343-3p)、si-circRASSF2 组(转染si-circRASSF2)、si-NC 组(转染si-NC)、miR-NC 组(转染miR-NC)、si-circRASSF2+anti-miR-1343-3p 组(共转染sicircRASSF2 和anti-miR-1343-3p)及si-circRASSF2+antimiR-NC组(共转染si-circRASSF2和anti-miR-NC)。
1.3 RT-qPCR 检测circRASSF2、miR-1343-3p 的相对表达水平
取乳腺癌组织、癌旁组织及各组细胞,加入Trizol 试剂提取总RNA,取200 ng RNA 逆转录合成cDNA,以cDNA 为模板进行PCR。circRASSF2引物序列:上游5'-CTTTTCAAA GAGAGTGGCCCAG-3',下游5'-ACGGTGTACTTGCGCATCA G-3';miR-1343-3p:上游5'-CGAAGTTCCCTTTGTCATCCT-3',下游5'-GTGCAGGGTCCGAGGTATTC-3';GAPDH:上游5'-AGTCAGGCTGGGGCTCATTG-3',下游5'-AGGGGCCATC CACAGTCTTC-3';U6:上游5'-CTCGCTTCGGCAGCACA-3',下游5'-AACGCTTCACGAATTTGCGT-3'。反应条件:94 ℃2 min;94 ℃30 s,56 ℃30 s,72 ℃60 s,循环30 次。GAPDH和U6 分别为circRASSF2 和miR-1343-3p 的内参基因,采用2-ΔΔCt法计算circRASSF2、miR-1343-3p相对表达量。
1.4 MTT法检测细胞活性
各组细胞培养48 h后接种于96孔板(200µL,3×103个/孔)。每孔加10µL MTT 试剂(5 g/L),培养4 h加入150µL DMSO,多功能酶标仪检测490 nm波长处光密度(OD)值。
1.5 克隆形成实验检测细胞克隆形成数
分别取各组细胞并接种至6 孔板(1×103个/孔),37 ℃培养2 周。磷酸盐缓冲液(PBS)冲洗2 次,加入甲醇固定2~3 min 后滴加吉姆萨染色液染色,于光学显微镜下计数克隆形成数(>50个细胞)。
1.6 流式细胞术检测细胞凋亡
转染48 h 后用0.125%胰蛋白酶制备细胞悬液,室温250×g离心5 min,用4 ℃预冷PBS 洗涤2 次后将细胞重悬于结合缓冲液,浓度为1×106个/mL。随后,在暗室中用Annexin V-FITC和PI孵育15 min;上流式细胞仪检测,FlowJo 7.6.1分析细胞凋亡情况。
1.7 Western blot 检测Cleaved-caspase 3、Cleaved-caspase 9蛋白相对表达水平
取各组细胞,通过蛋白提取试剂盒提取细胞总蛋白,进行蛋白定量后行SDS-PAGE 凝胶电泳,转膜、封闭,加Cleaved-caspase 3、Cleaved-caspase 9 一抗稀释液(1∶1 000)4 ℃孵育过夜,加二抗(1∶2 000)室温孵育2 h,曝光显影,Image Lab软件分析各蛋白条带灰度值。
1.8 双荧光素酶实验检测circRASSF2 和miR-1343-3p 的靶向关系
采用Starbase 软件(https://starbase.sysu.edu.cn/)预测circRASSF2与miR-1343-3p有无结合位点。将野生型(WT)和突变型(MUT)circRASSF2 双荧光素酶报告载体、miR-NC及miR-1343-3p共转染乳腺癌细胞株MDA-MB-231,48 h后按照试剂盒说明书检测miR-NC组和miR-1343-3p组细胞中circRASSF2 荧光素酶相对活性。分别将pcDNA、pcDNAcircRASSF2、si-circRASSF2、si-NC 转染MDA-MB-231 细胞,记为pcDNA组、pcDNA-circRASSF2组、si-circRASSF2组、si-NC组,按照1.3方法检测各组miR-1343-3p表达水平。
1.9 统计学方法
采用SPSS 20.0软件进行数据分析。符合正态分布的计量资料以±s表示,2组间比较行t检验,多组间比较采用单因素方差分析,组间多重比较行SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 circRASSF2、miR-1343-3p在乳腺癌中的表达
与癌旁组织比较,乳腺癌组织中circRASSF2 表达水平升高,miR-1343-3p 表达水平降低(P<0.01),见表1。
Tab.1 Comparison of circRASSF2 and miR-1343-3p expression levels between breast cancer tissue and paracancer tissue表1 乳腺癌组织和癌旁组织中circRASSF2和miR-1343-3p的表达水平比较(n=37,±s)

Tab.1 Comparison of circRASSF2 and miR-1343-3p expression levels between breast cancer tissue and paracancer tissue表1 乳腺癌组织和癌旁组织中circRASSF2和miR-1343-3p的表达水平比较(n=37,±s)
**P<0.01。
组织癌旁组织乳腺癌组织t circRASSF2 1.00±0.02 4.03±0.21 89.518**miR-1343-3p 1.00±0.05 0.37±0.03 60.709**
2.2 si-NC组和si-circRASSF2组细胞增殖水平比较
与si-NC 组比较,si-circRASSF2 组circRASSF2表达水平和MDA-MB-231细胞活性降低,细胞克隆形成数减少(P<0.01),见图1、表2。
Tab.2 Comparison of cell proliferation between the si-NC group and the si-circRASSF2 group表2 si-NC组和si-circRASSF2组细胞增殖水平比较(n=3,±s)

Tab.2 Comparison of cell proliferation between the si-NC group and the si-circRASSF2 group表2 si-NC组和si-circRASSF2组细胞增殖水平比较(n=3,±s)
**P<0.01。
组别si-NC组si-circRASSF2组t circRASSF2 1.00±0.06 0.34±0.02 19.219**OD490 0.71±0.06 0.34±0.03 9.992**克隆形成数/个101.25±8.96 48.79±2.34 9.815**
2.3 si-NC组和si-circRASSF2组细胞凋亡比较
与si-NC组比较,si-circRASSF2组细胞凋亡率、Cleaved-caspase 3、Cleaved-caspase 9 表达水平升高(P<0.01),见图2、3,表3。

Fig.2 Apoptosis of the si-NC group and the si-circRASSF2 group图2 si-NC组和si-circRASSF2组细胞凋亡情况
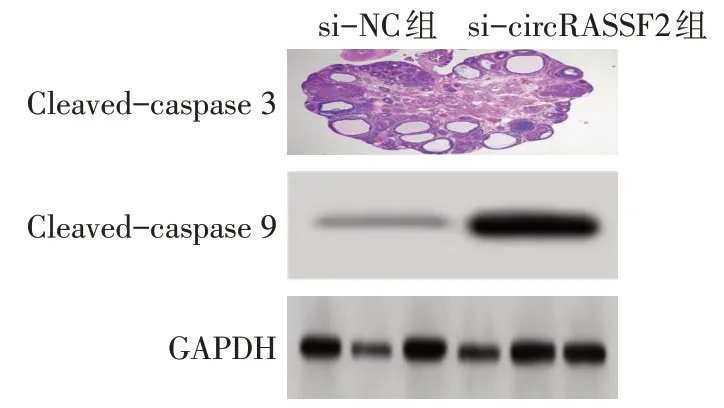
Fig.3 Expression levels of apoptosis related proteins in the si-NC group and the si-circRASSF2 group图3 si-NC组和si-circRASSF2组细胞凋亡相关蛋白表达
Tab.3 Comparison of apoptosis rate and related protein expression levels between the si-NC group and the si-circRASSF2 group表3 si-NC组和si-circRASSF2组细胞凋亡率及凋亡相关蛋白表达比较(n=3,±s)

Tab.3 Comparison of apoptosis rate and related protein expression levels between the si-NC group and the si-circRASSF2 group表3 si-NC组和si-circRASSF2组细胞凋亡率及凋亡相关蛋白表达比较(n=3,±s)
**P<0.01。
组别si-NC组si-circRASSF2组t细胞凋亡率/%8.75±0.13 23.89±3.21 8.156**Cleavedcaspase 3 0.27±0.04 0.75±0.09 8.486**Cleavedcaspase 9 0.20±0.02 0.54±0.06 10.304**
2.4 circRASSF2靶向调控miR-1343-3p
circRASSF2与miR-1343-3p存在互补的核苷酸序列,见图4。与miR-NC 组比较,miR-1343-3p 组WT-circRASSF2 荧光素酶活性降低(t=9.076,P<0.05),而2 组MUT-circRASSF2 荧光素酶活性差异无统计学意义(t=0.475,P>0.05),见图5A。RT-qPCR结果显示,与pcDNA 组比较,pcDNA-circRASSF2 组miR-1343-3p 表达水平降低(t=51.898,P<0.05),与si-NC组比较,si-circRASSF2组miR-1343-3p表达水平升高(t=23.106,P<0.05),见图5B。

Fig.4 Binding sequence of circRASSF2 and miR-1343-3p图4 circRASSF2与miR-1343-3p的结合序列
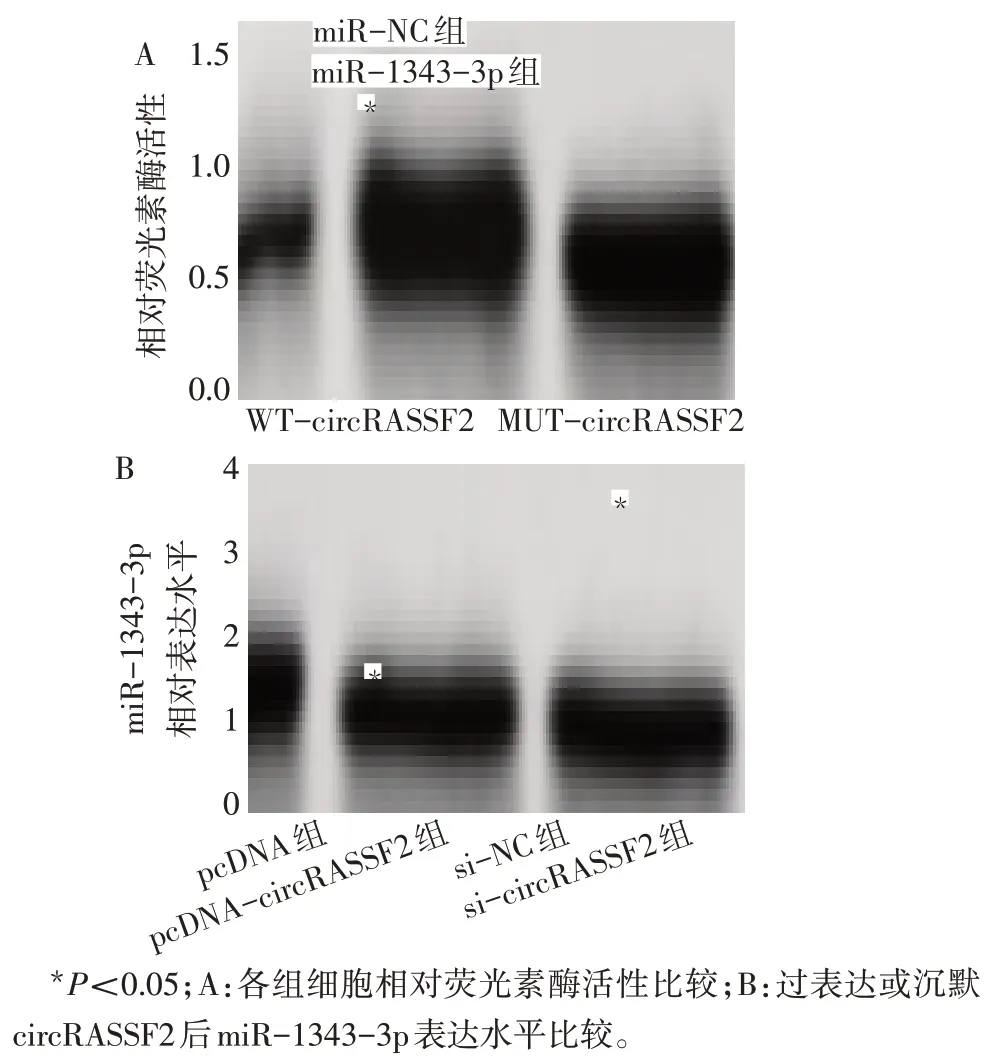
Fig.5 circRASSF2 targeting regulates the expression of miR-1343-3p图5 circRASSF2靶向调控miR-1343-3p的表达
2.5 miR-NC 组和miR-1343-3p 组乳腺癌MDAMB-231细胞增殖、凋亡水平比较
与miR-NC组比较,miR-1343-3p组miR-1343-3p 表达水平升高,细胞凋亡率升高,Cleavedcaspase 3、Cleaved-caspase 9 表达水平升高,细胞活性下降,克隆形成数减少(P<0.01),见图6、7,表4。
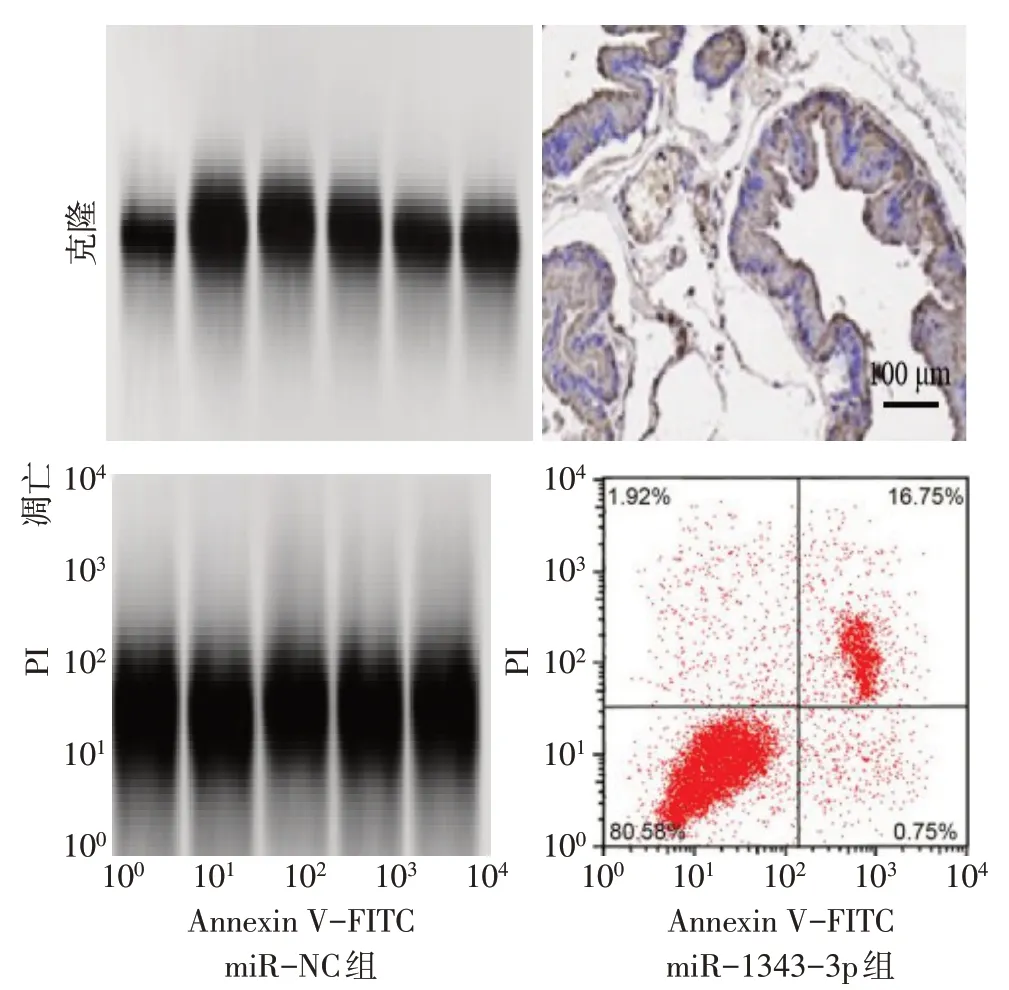
Fig.6 Clonal formation and apoptosis in the miR-NC group and the miR-1343-3p group图6 miR-NC组和miR-1343-3p组细胞克隆形成和凋亡

Fig.7 Expression of apoptosis related proteins in the miR-NC group and the miR-1343-3p group图7 miR-NC组和miR-1343-3p组细胞凋亡相关蛋白表达
Tab.4 Comparison of proliferation and apoptosis between the miR-NC group and the miR-1343-3p group表4 miR-NC组和miR-1343-3p组细胞增殖和凋亡比较(n=3,±s)
**P<0.01。表5同。
组别miR-NC组miR-1343-3p组t miR-1343-3p 1.01±0.02 3.21±0.13 28.357**OD490 0.70±0.05 0.42±0.03 9.058**克隆形成数/个99.87±8.43 50.23±2.45 9.794**细胞凋亡率/%7.48±0.51 19.96±2.03 10.317**Cleaved-caspase 3 0.25±0.03 0.73±0.08 9.821**Cleaved-caspase 9 0.19±0.02 0.48±0.05 10.793**
2.6si-circRASSF2+anti-miR-NC 组 和 sicircRASSF2+anti-miR-1343-3p 组乳腺癌MDAMB-231细胞增殖和凋亡比较
与si-circRASSF2+anti-miR-NC 组比较,sicircRASSF2+anti-miR-1343-3p 组miR-1343-3p 表达水平、细胞凋亡率、Cleaved-caspase 3、Cleavedcaspase 9 表达水平降低,细胞活性和克隆形成数升高(P<0.05),见表5,图8、9。

Fig.8 Clonal formation and apoptosis in the si-circRASSF2+antimiR-NC group and the si-circRASSF2+anti-miR-1343-3p group图8 si-circRASSF2+anti-miR-NC组和si-circRASSF2+anti-miR-1343-3p组细胞克隆形成和凋亡
Tab.5 Proliferation and apoptosis in the si-circRASSF2+anti-miR-NC group and the si-circRASSF2+anti-miR-1343-3p group表5 si-circRASSF2+anti-miR-NC组和si-circRASSF2+anti-miR-1343-3p组细胞增殖和凋亡(n=3,±s)

Tab.5 Proliferation and apoptosis in the si-circRASSF2+anti-miR-NC group and the si-circRASSF2+anti-miR-1343-3p group表5 si-circRASSF2+anti-miR-NC组和si-circRASSF2+anti-miR-1343-3p组细胞增殖和凋亡(n=3,±s)
组别si-circRASSF2+anti-miR-NC组si-circRASSF2+anti-miR-1343-3p组t miR-1343-3p 1.00±0.03 0.28±0.02 35.040**OD490 0.39±0.02 0.65±0.04 10.373**克隆形成数/个40.78±3.51 82.63±8.74 7.696**细胞凋亡率/%27.45±3.11 12.13±0.98 8.140**Cleavedcaspase 3 0.75±0.09 0.32±0.04 7.460**Cleavedcaspase 9 0.52±0.06 0.24±0.02 7.545**
3 讨论
乳腺癌是女性常见的恶性肿瘤,其治疗方法包括手术、化疗和免疫治疗,然而由于局部复发和转移发生率较高,晚期乳腺癌患者预后仍然很差[9]。因此,确定新的生物标志物对开发乳腺癌新靶向治疗很有必要。研究显示,circRNA 参与调控乳腺癌的恶性生物学行为,如circ_0025202 可以抑制乳腺癌细胞的增殖、集落形成和迁移,并增加癌细胞凋亡[10]。沉默circ_0004771 通过靶向miR-653/ZEB2以抑制乳腺癌的增殖并诱导其凋亡[11]。Zhong 等[12]研究显示,circRASSF2 在乳腺癌组织和血清中表达增加,敲除circRASSF2 后乳腺癌细胞的增殖能力下降。本研究结果亦显示,circRASSF2 在人乳腺癌组织中表达水平升高,抑制circRASSF2 表达可降低MDA-MB-231 细胞增殖活性,并使细胞凋亡率升高,表明抑制circRASSF2 可促进乳腺癌细胞凋亡和抑制癌细胞增殖,提示circRASSF2 的失调参与了乳腺癌的进展。
通过生物信息学分析发现,circRASSF2 可以靶向调控各种miRNAs 表达。本研究选择了其中的miR-1343-3p 作为circRASSF2 的靶点。研究显示,miR-1343-3p 在胰腺癌中低表达,LINC01559 通过充当miR-1343-3p的竞争性内源RNA 来上调RAF1表达,从而促进胰腺癌的进展[13]。LINC01559 海绵化miR-1343-3p,上调PGK1,激活PI3K/AKT 途径,进而促进胃癌的发展[14]。EIF3J-AS1 通过海绵化miR-1343-3p 上调ANXA11 表达,从而促进神经胶质瘤细胞增殖[15]。本研究结果显示,在乳腺癌组织中miR-1343-3p低表达,且miR-1343-3p过表达后,细胞活性、克隆形成数下降,凋亡率升高,表明上调miR-1343-3p表达可抑制乳腺癌细胞增殖和促进细胞凋亡,提示miR-1343-3p 具有抗乳腺癌作用。通过双荧光素酶报告基因检测验证了circRASSF2 与miR-1343-3p有靶向关系,发现两者表达水平相反。在检测细胞增殖和凋亡后,本研究发现circRASSF2敲除对乳腺癌细胞的影响可以通过抑制miR-1343-3p表达部分逆转,提示抑制circRASSF2表达可通过上调miR-1343-3p,从而抑制MDA-MB-231 细胞增殖并促进其凋亡。
综上所述,circRASSF2在乳腺癌中高表达,抑制circRASSF2可通过上调miR-1343-3p来抑制乳腺癌细胞增殖,并促进细胞凋亡。circRASSF2 通过下调miR-1343-3p的表达,促进乳腺癌增殖并阻碍凋亡,circRASSF2有望成为乳腺癌的潜在诊断生物标志物和治疗靶点。然而,由于本研究所纳入的临床标本有限,且检测手段单一、缺乏体内实验等,因此后续需针对此类问题进行完善和深入探讨。
