牛磺酸对胰腺癌细胞系BxPC-3和PANC-1细胞增殖、凋亡和迁移的影响
2023-07-17高慧婕李倩田斌朱日明刘超
高慧婕,李倩,田斌,朱日明,刘超△
胰腺癌是常见的消化系统肿瘤之一,居恶性肿瘤死亡率第4 位[1-2]。我国的胰腺癌发病率也呈逐年增加趋势[3]。传统中药及相关中药单体的抗肿瘤活性研究已成为热点。中药单体是从传统中药中提取出的有效成分。研究发现,槲皮素[4]、黄芩素[5]、姜黄素[6]、大黄素[7]等中药单体能够抑制胰腺癌细胞增殖、促进其凋亡,抑制肿瘤的生长与转移,在临床观察与体内实验中也具有同样的作用。牛磺酸(Taurine,Tau)是一种人体内含量丰富的必需氨基酸,同时也是一种具有广泛生理和药理活性的中药有效成分,因其首次从牛胆汁中分离得到而命名[8]。Tau 具有抗氧化应激、解毒抗炎、降低血糖、增强免疫功能等作用[9]。尽管有研究发现Tau 具有一定的抗癌活性[10-11],但对胰腺癌的相关研究尚少。本研究观察Tau 对胰腺癌细胞的增殖、凋亡和迁移的影响,并探讨其作用机制,为胰腺癌的预防、分子靶向治疗及抗癌中药的研发提供实验依据。
1 材料与方法
1.1 材料与试剂
人胰腺癌细胞系BxPC-3 和PANC-1 细胞购自韦辉生物科技公司,DMEM、胎牛血清(FBS)购自Hyclone。牛磺酸购自阿拉丁试剂有限公司。逆转录试剂盒购自TAKARA Biotech,荧光定量PCR 试剂盒(AcaQ qPCR SYBR Green Master)、CCK-8 试剂盒、TUNEL 检测试剂盒均购自Vazyme Biotech,RIPA 裂解液、蛋白酶磷酸酶抑制剂混合物、BCA 蛋白浓度测定试剂盒、SDS-PAGE 凝胶快速配制试剂盒、特超敏ECL 化学发光试剂盒均购自Beyotime Biotechnology Biotech,Western blot Marker 购自 Solarbio Science &Technology,Tubulin 抗体、P21 抗体、P53 抗体均购自Wuhan Boster Biological Technology,山羊抗小鼠抗体、山羊抗兔抗体(辣根过氧化物酶标记)购自Beyotime Biotechnology公司。
1.2 仪器与设备
多功能酶标仪、CO2培养箱、低温离心机等购自Thermo Fisher Scientific 公司;荧光定量PCR 仪、超灵敏多功能成像系统、电泳仪、垂直电泳槽、半干转膜仪等购自Biorad公司;恒温金属浴购自大龙兴创有限公司;手持式组织研磨器购自上海净信实业器械厂。
1.3 方法
1.3.1 细胞培养与分组
BxPC-3 和PANC-1 细胞用含10%FBS 的DMEM 高糖培养基在37 ℃、5%CO2培养箱中培养,取对数生长期细胞进行相关实验。
1.3.2 CCK-8检测细胞活力
制备胰腺癌细胞悬液,接种于96孔细胞培养板中,每孔细胞数量控制在1 000~3 000个。BxPC-3和PANC-1均分为对照组和不同Tau 浓度处理组(10、20、40、80、160 mmol/L),24~72 h 后,每孔加入CCK-8 试剂10µL,放入培养箱后孵育2 h,放置于酶标仪进行光密度(OD)值检测,波长为450 nm。
1.3.3 细胞划痕实验
制备胰腺癌细胞悬液,接种于6孔细胞培养板中,接种细胞量约每孔1×106个,放置于培养箱中,待细胞贴壁、长满,使用微量移液器枪头进行划线,PBS 冲洗掉悬浮的细胞。Tau处理,24 h 后使用荧光倒置显微镜进行观察,记录划线区域的细胞迁移的变化,进行对比分析。Image J软件计算划痕面积(S),划痕愈合率(%)=[(S0h-S24h)/S0h]×100%。
1.3.4 TUNEL检测细胞凋亡
制备胰腺癌细胞悬液,接种于12孔细胞培养板中,接种细胞量每孔约5×105个,置于培养箱培养待其贴壁。Tau处理后,根据TUNEL试剂盒说明进行实验操作,使用多聚甲醛固定细胞。荧光显微镜下观察细胞凋亡情况并拍照,记录每张照片内的凋亡细胞数。
1.3.5 实时荧光定量聚合酶链反应(qPCR)检测p53、p21 等基因的mRNA表达
Tau 干预胰腺癌细胞,24 h 后使用Trizol 法提取细胞RNA,提取的RNA使用无核酸酶的水溶解,置于-80 ℃保存。参照试剂说明,使用普通PCR 仪将RNA 反转录为cDNA。qPCR 反应体系:上、下游引物各0.4µL,SYBR Green Mix 10µL,cDNA 1µL,加ddH2O 至20µL。反应条件:95 ℃预变性5 min;95 ℃变性50 s,58 ℃退火44 s,72 ℃延伸2 min,40个循环。引物序列见表1。

Tab.1 The primers for qPCR表1 qPCR引物序列
1.3.6 Western blot检测P53、P21的蛋白表达
Tau 干预胰腺癌细胞24 h 后使用RIPA 裂解液提取细胞总蛋白,BCA蛋白浓度测定试剂盒测量蛋白浓度,置于-80 ℃保存。配制10%SDS-PAGE 凝胶进行电泳,半干转膜仪将蛋白转至PVDF 膜上。仪转膜后Western 洗涤液洗涤2 min,然后置于封闭液中封闭2 h。封闭结束后分别使用一抗(内参为Tubulin 抗体,目的蛋白分别为P21 抗体、P53 抗体,均1∶1 000 稀释)和相应二抗进行孵育(一抗4 ℃过夜孵育,二抗4 ℃孵育2 h),每次孵育后使用Western 洗涤液洗涤3 次,每次摇洗10 min。使用特超敏ECL化学发光试剂盒显色,置于超灵敏多功能成像进行显影记录分析。
1.4 统计学方法
所有数据应用GraphPad Prism 9.0软件进行分析,符合正态分布的计量资料采用均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
2.1 Tau对胰腺癌细胞增殖活力的影响
不同浓度的Tau(10、20、40、80、160 mmol/L)处理胰腺癌导管细胞系BxPC-3 细胞和PANC-1 细胞24、48、72 h,Tau 对BxPC-3 细胞和PANC-1 细胞增殖活力的抑制作用呈现一定的剂量依赖性,见图1、2。而且,40 mmol/L 浓度的Tau 对BxPC-3 细胞和PANC-1 细胞增殖活力开始展现出明显的抑制,后续主要以40 mmol/L浓度的Tau作为干预浓度。

Fig.1 Effects of taurine on proliferation of human pancreatic cancer cell lines BxPC-3图1 Tau对胰腺癌细胞BxPC-3细胞增殖活力的影响

Fig.2 Effects of taurine on proliferation of human pancreatic cancer cell lines PANC-1图2 Tau对胰腺癌细胞PANC-1细胞增殖活力的影响
2.2 Tau 对胰腺癌细胞BxPC-3 细胞和PANC-1 细胞迁移的影响
细胞划线结果表明,与对照组相比,Tau(40 mmol/L)对BxPC-3细胞和PANC-1细胞的迁移能力均具有明显抑制作用,见图3、4。

Fig.3 Migration ability of cells of the four groups图3 各组细胞的迁移能力

Fig.4 Effects of taurine on migration of human pancreatic cancer cell lines BxPC-3 and PANC-1图4 Tau对胰腺癌细胞BxPC-3和PANC-1迁移能力的影响
2.3 Tau对胰腺癌细胞凋亡的影响
TUNEL 染色结果表明,与对照组相比,Tau(40 mmol/L)能明显促进胰腺癌导管细胞系BxPC-3细胞和PANC-1细胞的凋亡,见图5、6。
Fig.5 Apoptosis of cells of the four groups图5 各组细胞的凋亡情况

Fig.6 Effects of taurine on apoptosis of human pancreatic cancer cell lines BxPC-3 and PANC-1图6 Tau对胰腺癌细胞BxPC-3和PANC-1细胞凋亡的影响
2.4 Tau对胰腺癌细胞凋亡及细胞周期蛋白相关基因mRNA表达的影响
结果显示,不同浓度的Tau 作用于BxPC-3 细胞,细胞凋亡相关基因BAX、p53、p21 mRNA 的表达水平较对照组升高,而PCNA mRNA 的表达降低(P<0.01)。见表2。
Tab.2 Comparison of p53,p21,BAX and PCNA mRNA levels of BxPC-3 cells between the three groups表2 各组BxPC-3细胞p53、p21、BAX、PCNA mRNA表达水平比较(n=3,±s)
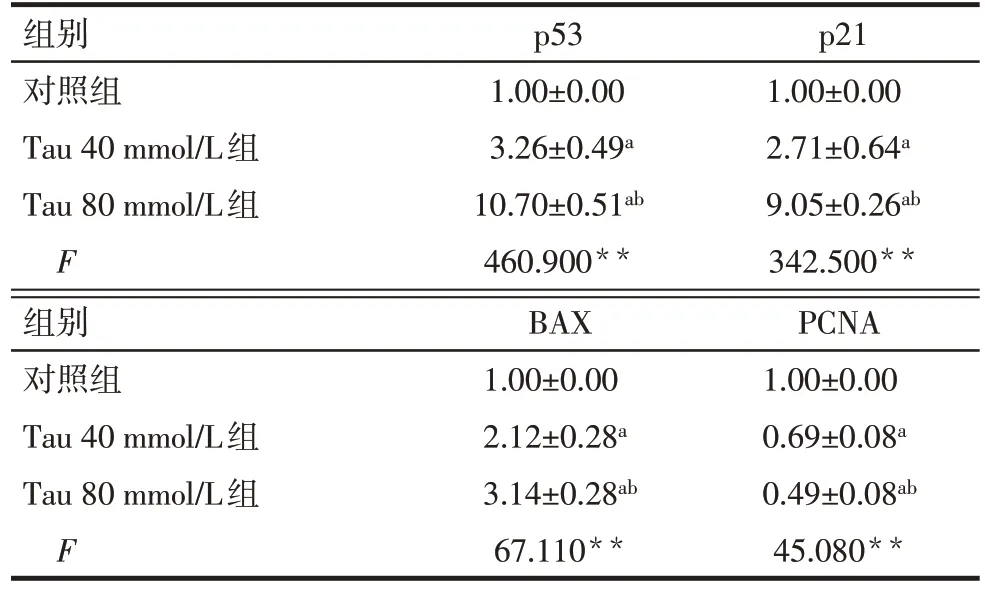
Tab.2 Comparison of p53,p21,BAX and PCNA mRNA levels of BxPC-3 cells between the three groups表2 各组BxPC-3细胞p53、p21、BAX、PCNA mRNA表达水平比较(n=3,±s)
**P<0.01;a与对照组比较,b与Tau 40 mmol/L组比较,P<0.05。
组别对照组Tau 40 mmol/L组Tau 80 mmol/L组F p53 1.00±0.00 3.26±0.49a 10.70±0.51ab 460.900**p21 1.00±0.00 2.71±0.64a 9.05±0.26ab 342.500**组别对照组Tau 40 mmol/L组Tau 80 mmol/L组F BAX 1.00±0.00 2.12±0.28a 3.14±0.28ab 67.110**PCNA 1.00±0.00 0.69±0.08a 0.49±0.08ab 45.080**
Tau作用于PANC-1细胞时,Tau 80 mmol/L组细胞凋亡相关基因p53、p21 mRNA 的表达水平较对照组明显升高;Tau 40 mmol/L 组和Tau 80 mmol/L 组Bcl-2、PCNA、CyclinA2、CyclinB1、CyclinE、CDK1、CDK2、CDK4、CDK6 mRNA的表达水平较对照组均明显下降,见表3。
Tab.3 Comparison of mRNA levels of p53,p21 and other genes of PANC-1 cells between the three groups表3 各组PANC-1细胞p53、p21等基因mRNA表达水平比较(n=3,±s)

Tab.3 Comparison of mRNA levels of p53,p21 and other genes of PANC-1 cells between the three groups表3 各组PANC-1细胞p53、p21等基因mRNA表达水平比较(n=3,±s)
**P<0.01;a与对照组比较,b与Tau 40 mmol/L组比较,P<0.05。
组别对照组Tau 40 mmol/L组Tau 80 mmol/L组F p53 1.00±0.00 1.31±0.09 1.80±0.25ab 20.640**p21 1.00±0.00 1.22±0.10 1.54±0.17ab 17.070**Bcl-2 1.00±0.00 0.08±0.02a 0.15±0.08a 352.200**PCNA 1.00±0.00 0.23±0.09a 0.27±0.01a 221.200**CyclinA2 1.00±0.00 0.11±0.02a 0.07±0.02a 2 296.000**CyclinB1 1.00±0.00 0.23±0.12a 0.06±0.02a 150.400**组别对照组Tau 40 mmol/L组Tau 80 mmol/L组F CyclinE 1.00±0.00 0.16±0.05a 0.16±0.05a 413.200**CDK1 1.00±0.00 0.06±0.01a 0.03±0.01ab 8 613.00**CDK2 1.00±0.00 0.11±0.07a 0.08±0.07a 337.800**CDK4 1.00±0.00 0.10±0.02a 0.13±0.08a 338.900**CDK6 1.00±0.00 0.33±0.10a 0.27±0.04a 121.700**
2.5 Tau对BxPC-3和PANC-1细胞P53、P21蛋白表达水平的影响
采用不同浓度的Tau处理BxPC-3和PANC-1细胞后,与对照组相比,P21、P53 的蛋白表达升高,见图7。
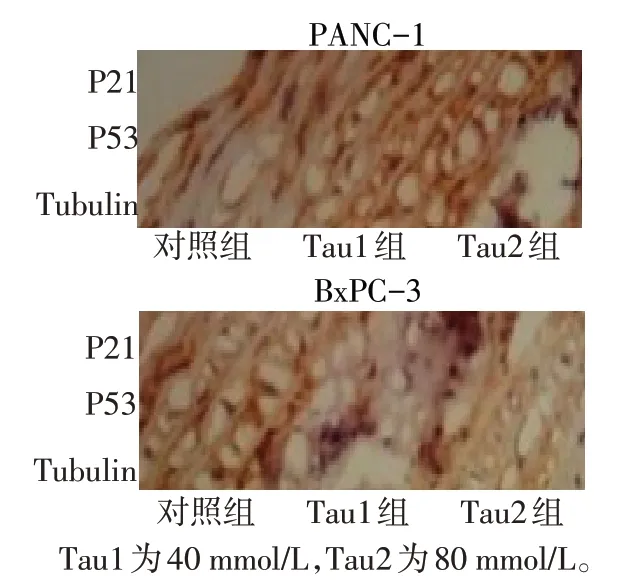
Fig.7 Effects of Taurine on P21 and P53 proteins in BxPC-3 and PANC-1 cells图7 Tau对胰腺癌细胞BxPC-3和PANC-1细胞中P21、P53蛋白的影响
3 讨论
3.1 Tau的抗癌机制尚未明确
近年来,随着化学治疗、免疫治疗以及新型分子靶向治疗的应用进展,出现了吉西他滨、厄洛替尼、酪氨酸激酶抑制剂和磷酸肌醇3-激酶抑制剂等多种抗胰腺癌药物[12-13],但中晚期胰腺癌患者的临床预后效果仍然不理想,因此寻找新型的抗胰腺癌药物依旧是研究热点。
Tau 既是人体内必不可少的营养元素,同时也是具有广泛药效的中药活性成分。近年有研究认为Tau 可通过诱导肿瘤细胞的凋亡、调节细胞自噬及对化疗药物的减毒增效作用来发挥抗肿瘤活性[14-15],但具体机制尚未明确。
3.2 P53/P21通过干扰细胞周期促进细胞凋亡并发挥其抗肿瘤活性
p53 作为与人类肿瘤关系密切的基因之一,主要是通过诱导细胞周期阻滞以及促进细胞凋亡发挥其抗肿瘤活性作用的[16]。一旦细胞周期发生分裂阻滞,被活化的P53 可以通过提高P21 的表达来促进细胞凋亡及细胞周期的抑制;P21 是周期蛋白依赖性激酶(CDKs)抑制剂,可以干扰细胞周期蛋白的活性从而调节细胞周期,抑制S—G1期[17]。
3.3 Tau通过影响P53/P21通路抑制胰腺癌
谷倬宇等[18]研究显示姜黄素可能通过上调P53等蛋白水平的表达起到抗胰腺癌的作用。潘海强等[19]研究发现辣椒素可能通过上调P53 蛋白的表达,进而激活Caspase-3,从而促进SW1990细胞发生凋亡。与他们的研究一致,Tau 可以显著抑制胰腺癌细胞的增殖和迁移活性,促进细胞凋亡。Tau 处理后的胰腺癌细胞中细胞凋亡基因p53、p21显著上升,而细胞周期蛋白CyclinA2、CyclinB1 等基因表达明显下调。由此推测Tau 可能是通过作用于P53/P21 通路引发细胞凋亡及细胞周期阻滞,发挥其抗肿瘤活性。
本次实验初步阐明了Tau抗胰腺癌活性的作用机制,认为其具有作为抗胰腺癌药物的潜力,为抗胰腺癌药物的研究提供了新的思路和方向。同时,Tau抑制胰腺癌细胞的活力以及细胞周期调控是一个复杂的过程,需要进一步开展更为广泛的相关蛋白及信号通路的研究。
