木犀草苷对阿尔茨海默病模型细胞凋亡和炎性因子表达的研究
2023-07-17王翠杨畅金玉高蜜张雯王琼金海涛
王翠,杨畅,金玉,高蜜,张雯,王琼,金海涛△
阿尔茨海默病(Alzheimer’s disease,AD)是造成老年痴呆的常见原因,发病率随人口老龄化的加剧逐年增加,85 岁以上老人发病率高达10%[1]。研究显示,β 淀粉样蛋白(Aβ)可造成神经细胞凋亡及过度炎症反应,是诱发AD 的主要因素[2]。因此,抑制Aβ诱导的神经细胞凋亡及炎症反应对治疗AD尤为重要。木犀草苷是一种在植物中广泛存在黄酮类化合物。木犀草苷可抑制过氧化氢诱导的人脐静脉内皮细胞(HUVECs)氧化损伤[3],还可减少缺氧缺糖诱导的大鼠皮质神经细胞凋亡[4],具有治疗脑血管疾病的潜在价值。但木犀草苷能否影响AD 发生发展还未知。有丝分裂原活化蛋白激酶激酶激酶3(mitogen-activated protein kinase kinase kinase 3,MEKK3)是一种丝氨酸/苏氨酸蛋白激酶,参与调控细胞生长、凋亡、炎症反应等生命活动。研究显示,MEKK3在1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的帕金森病模型细胞中表达增加,敲减MEKK3可通过阻碍核转录因子κB(nuclear factor kappa B,NFκB)信号通路的激活,抑制帕金森病模型细胞促炎细胞因子表达,减轻细胞损伤[5]。AD与帕金森病均属于神经退行性疾病,因此,推测MEKK3 可能也参与AD的发展进程。本研究利用Aβ25-35诱导PC12细胞建立AD模型,主要观察木犀草苷对AD模型细胞凋亡、炎性因子表达的影响,并以MEKK3为切入点,探究木犀草苷影响AD模型细胞凋亡、炎性因子表达的机制,为其用于治疗AD提供一定的实验依据。
1 材料与方法
1.1 细胞、主要试剂与仪器
PC12细胞(上海弘顺生物科技有限公司);木犀草苷(规格50 mg,上海邦景实业有限公司);胎牛血清(FBS,浙江天杭生物科技股份有限公司);Aβ25-35(美国Sigma 公司);DMEM培养液、LipofectamineTM2000 试剂盒、细胞计数试剂盒-8(CCK-8)、膜联蛋白V(Annexin V)-异硫氰酸荧光素(FITC)/碘化丙啶(PI)细胞凋亡试剂盒、二辛可宁酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(北京索莱宝科技有限公司);MEKK3小分子干扰RNA(si-MEKK3)及其阴性对照(si-NC)、MEKK3 过表达载体质粒(pcDNA-MEKK3)及其阴性对照(pcDNA)购自广州锐博生物科技有限公司;兔源一抗[MEKK3、甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)]、山羊抗兔二抗(英国Abcam公司);肿瘤坏死因子-α(tumor necrosis factor α,TNFα)、白细胞介素(interleukin,IL)-6、IL-1β酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(南京建成生物工程研究所)。HERAcell 240i CO2细胞培养箱(美国Thermo Fisher Scientific 公司);iMark680 多功能酶标仪(美国Bio-Rad 公司);FACSCalibur 流式细胞仪(美国Becton-Dickinson公司);BX61光学显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养
复苏PC12细胞,用含10%FBS的DMEM培养液制成单细胞悬液,接种至25 cm2培养瓶中,于CO2培养箱(37 ℃、5%CO2)中培养。
1.2.2 细胞分组
实验一:PC12 细胞分为对照组,模型组及模型+木犀草苷低、中、高剂量组。模型+木犀草苷低、中、高剂量组先分别用含6.25、12.5、25 mg/L[4]木犀草苷的培养液孵育细胞24 h,再用含25µmol/L[6]Aβ25-35的培养液孵育24 h;模型组先用不含木犀草苷的培养液孵育细胞24 h,再用含25µmol/L Aβ25-35的培养液孵育24 h;对照组用不含木犀草苷及Aβ25-35的培养液孵育细胞48 h。实验二:将PC12 细胞接种至6 孔板中(1.0×105个/孔),培养24 h 后,利用LipofectamineTM2000 试剂盒分别转染si-MEKK3、si-NC、pcDNA-MEKK3、pcDNA。转染12 h,Western blot 检测MEKK3 蛋白表达验证转染效果。转染后的PC12 细胞接种至培养板中,先用不含木犀草苷的培养液孵育细胞24 h,再用含25µmol/L Aβ25-35的培养液孵育24 h,分别记为模型+si-MEKK3 组、模型+si-NC 组、模型+pcDNA-MEKK3 组、模型+pcDNA-NC 组。实验三:将转染pcDNA-MEKK3、pcDNA 的PC12 细胞先用含25 mg/L 木犀草苷的培养液孵育细胞24 h,再用含25 µmol/L Aβ25-35的培养液孵育24 h,分别记为模型+木犀草苷+pcDNA-MEKK3 组、模型+木犀草苷+pcDNA组。
1.2.3 CCK-8法检测细胞增殖抑制率
接种PC12 细胞至96 孔板中(2.5×104个/孔),培养12 h后,按照上述1.2.2分组干预。干预后,加CCK-8(10µL/孔),孵育2 h。将96孔板置于酶标仪卡槽,设置波长为450 nm,测定各孔光密度(OD)值。增殖抑制率(%)=(1-OD实验组/OD对照组)/OD对照组×100%。
1.2.4 流式细胞术检测细胞凋亡率
接种PC12细胞至6孔板中(1.0×105个/孔),培养12 h后,按照上述1.2.2分组干预。干预后,收集各组细胞,用磷酸盐缓冲液(PBS)清洗2 次,300×g离心5 min,弃上清液。加Binding Buffer 重悬细胞,并调整细胞密度为1.0×106个/mL。取100µL细胞悬液,加Annexin V-FITC(5µL/管),室温避光孵育10 min。再加5µL PI,室温避光孵育5 min。加500µL Binding Buffer,混合均匀,在1 h内用流式细胞仪检测。
1.2.5 ELISA法检测TNF-α、IL-6、IL-1β水平
接种PC12细胞至6孔板中(1.0×105个/孔),培养12 h后,按照上述1.2.2 分组干预。干预后,收集各组细胞,500×g离心5 min。取上清液,采用ELISA 试剂盒检测TNF-α、IL-6、IL-1β水平。
1.2.6 Western blot检测MEKK3蛋白表达
接种PC12细胞至6孔板中(1.0×105个/孔),培养12 h后,按照上述1.2.2 分组干预。干预后,收集各组细胞,加PBS 清洗2次,300×g离心5 min,弃上清液。用RIPA 试剂提取总蛋白并测定(BCA法)蛋白浓度。行SDS-PAGE分离总蛋白,并转至PVDF 膜,用5%脱脂奶粉封闭2 h。于4 ℃冰箱中分别用MEKK3(1∶500)、GAPDH(1∶1 000)一抗孵育12 h,再于室温下用山羊抗兔二抗(1∶2 000)孵育2 h。滴加显影液,避光显影,曝光拍照,Image J 软件分析蛋白条带灰度值,以MEKK3 与GAPDH 灰度值的比值表示MEKK3 蛋白相对表达量。
1.3 统计学方法
采用SPSS 22.0软件进行数据分析。计量资料符合正态分布,以均数±标准差(±s)表示;多组间比较用单因素方差分析,组间多重比较用LSD-t检验;2 组间比较行独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 木犀草苷对AD模型细胞增殖与凋亡的影响
与对照组比较,模型组PC12 细胞增殖抑制率、凋亡率升高(P<0.05);与模型组比较,模型+木犀草苷低、中、高剂量组PC12细胞增殖抑制率、凋亡率依次降低(P<0.05),见图1,表1。
Tab.1 Effects of cynaroside on proliferation inhibition rate and apoptosis rate of AD model cells表1 木犀草苷对AD模型细胞增殖抑制率与凋亡率的影响(n=9,%,±s)
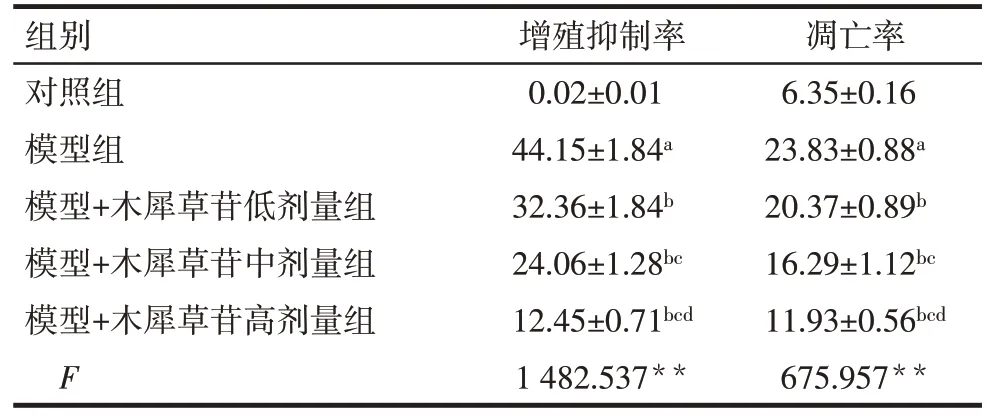
Tab.1 Effects of cynaroside on proliferation inhibition rate and apoptosis rate of AD model cells表1 木犀草苷对AD模型细胞增殖抑制率与凋亡率的影响(n=9,%,±s)
**P<0.01;a与对照组比,b与模型组比,c与模型+木犀草苷低剂量组比,d与模型+木犀草苷中剂量组比,P<0.05。
组别对照组模型组模型+木犀草苷低剂量组模型+木犀草苷中剂量组模型+木犀草苷高剂量组F增殖抑制率0.02±0.01 44.15±1.84a 32.36±1.84b 24.06±1.28bc 12.45±0.71bcd 1 482.537**凋亡率6.35±0.16 23.83±0.88a 20.37±0.89b 16.29±1.12bc 11.93±0.56bcd 675.957**

Fig.1 Effect of cynaroside on apoptosis of AD model cells detected by flow cytometry图1 流式细胞术检测木犀草苷对Aβ25-35诱导的PC12细胞凋亡的影响
2.2 木犀草苷对AD模型细胞炎性因子表达的影响
与对照组比较,模型组TNF-α、IL-6、IL-1β 水平升高(P<0.05);与模型组比较,模型+木犀草苷低、中、高剂量组TNF-α、IL-6、IL-1β 水平依次降低(P<0.05),见表2。
Tab.2 Effects of cynaroside on the expression of inflammatory cytokines and MEKK3 protein in AD model cells表2 木犀草苷对AD模型细胞炎性因子表达和MEKK3蛋白表达水平的影响(n=9,±s)

Tab.2 Effects of cynaroside on the expression of inflammatory cytokines and MEKK3 protein in AD model cells表2 木犀草苷对AD模型细胞炎性因子表达和MEKK3蛋白表达水平的影响(n=9,±s)
**P<0.01;a与对照组比,b与模型组比,c与模型+木犀草苷低剂量组比,d与模型+木犀草苷中剂量组比,P<0.05。
组别对照组模型组模型+木犀草苷低剂量组模型+木犀草苷中剂量组模型+木犀草苷高剂量组F TNF-α/(ng/L)100.06±5.79 400.08±14.63a 332.88±20.38b 244.86±12.78bc 148.91±11.88bcd 721.179**IL-6/(ng/L)64.78±4.99 442.40±32.12a 303.79±15.73b 222.45±14.55bc 126.42±9.40bcd 621.541**组别对照组模型组模型+木犀草苷低剂量组模型+木犀草苷中剂量组模型+木犀草苷高剂量组F IL-1β/(ng/L)93.60±5.55 275.42±20.46a 235.50±13.86b 176.98±12.97bc 125.28±8.96bcd 286.230**MEKK3 0.15±0.02 0.67±0.04a 0.51±0.03b 0.39±0.04bc 0.22±0.02bcd 411.612**
2.3 木犀草苷对AD 模型细胞中MEKK3 蛋白表达的影响
与对照组比较,模型组MEKK3 蛋白水平升高(P<0.05);与模型组比较,模型+木犀草苷低、中、高剂量组MEKK3 蛋白水平依次降低(P<0.05),见图2,表2。

Fig.2 Western blot detection of the effect of cynaroside on the expression of MEKK3 protein in AD model cells图2 Western blot检测木犀草苷对AD模型细胞中MEKK3蛋白表达的影响
2.4 MEKK3转染效果验证
与si-NC 组比较,si-MEKK3 组MEKK3 蛋白表达量降低,差异有统计学意义(0.15±0.01vs.0.05±0.01,t=21.213,P<0.05);与pcDNA 组比较,pcDNAMEKK3 组MEKK3 蛋白表达量升高,差异有统计学意义(0.15±0.01vs.0.49±0.04,t=24.739,P<0.05),见图3。

Fig.3 Western blot detection of the effect of transfection on MEKK3 protein expression图3 Western blot检测转染对MEKK3蛋白表达的影响
2.5 敲减MEKK3 对AD 模型细胞损伤及炎性因子表达的影响
与模型+si-NC组比较,模型+si-MEKK3组PC12细胞增殖抑制率、凋亡率、炎性因子(TNF-α、IL-6、IL-1β)水平降低(P<0.01),见图4,表3。
Tab.3 Effects of knockdown of MEKK3 on proliferation inhibition rate,apoptosis rate and expression of inflammatory factors in AD model cells表3 敲减MEKK3对AD模型细胞增殖抑制率、凋亡率及炎性因子表达的影响(n=9,±s)

Tab.3 Effects of knockdown of MEKK3 on proliferation inhibition rate,apoptosis rate and expression of inflammatory factors in AD model cells表3 敲减MEKK3对AD模型细胞增殖抑制率、凋亡率及炎性因子表达的影响(n=9,±s)
**P<0.01。表4、5同
组别模型+si-NC组模型+si-MEKK3组t增殖抑制率/%44.19±1.96 14.56±0.83 41.762**凋亡率/%23.65±1.58 13.35±0.97 16.667**TNF-α/(ng/L)399.83±23.91 198.54±19.89 19.416**IL-6/(ng/L)448.76±20.57 144.50±22.08 30.248**IL-1β/(ng/L)272.70±35.62 133.54±10.81 11.215**

Fig.4 The effect of knockout MEKK3 on apoptosis of AD model cells detected by flow cytometry图4 流式细胞术检测敲减MEKK3对AD模型细胞凋亡的影响
2.6 过表达MEKK3 对AD 模型细胞损伤及炎性因子表达的影响
与模型+pcDNA 组比较,模型+pcDNA-MEKK3组PC12 细胞增殖抑制率、凋亡率、炎性因子(TNFα、IL-6、IL-1β)水平升高(P<0.01),见图5,表4。
Tab.4 Effects of overexpression of MEKK3 on proliferation inhibition rate,apoptosis rate and expression of inflammatory factors in AD model cells表4 过表达MEKK3对AD模型细胞增殖抑制率、凋亡率及炎性因子表达的影响(n=9,±s)

Tab.4 Effects of overexpression of MEKK3 on proliferation inhibition rate,apoptosis rate and expression of inflammatory factors in AD model cells表4 过表达MEKK3对AD模型细胞增殖抑制率、凋亡率及炎性因子表达的影响(n=9,±s)
组别模型+pcDNA组模型+pcDNA-MEKK3组t增殖抑制率/%42.35±2.05 60.18±3.72 12.593**凋亡率/%21.74±1.50 36.28±2.15 16.639**TNF-α/(ng/L)387.96±25.39 562.30±40.15 11.010**IL-6/(ng/L)439.55±31.42 641.07±45.19 10.984**IL-1β/(ng/L)280.14±22.90 435.80±30.57 12.226**
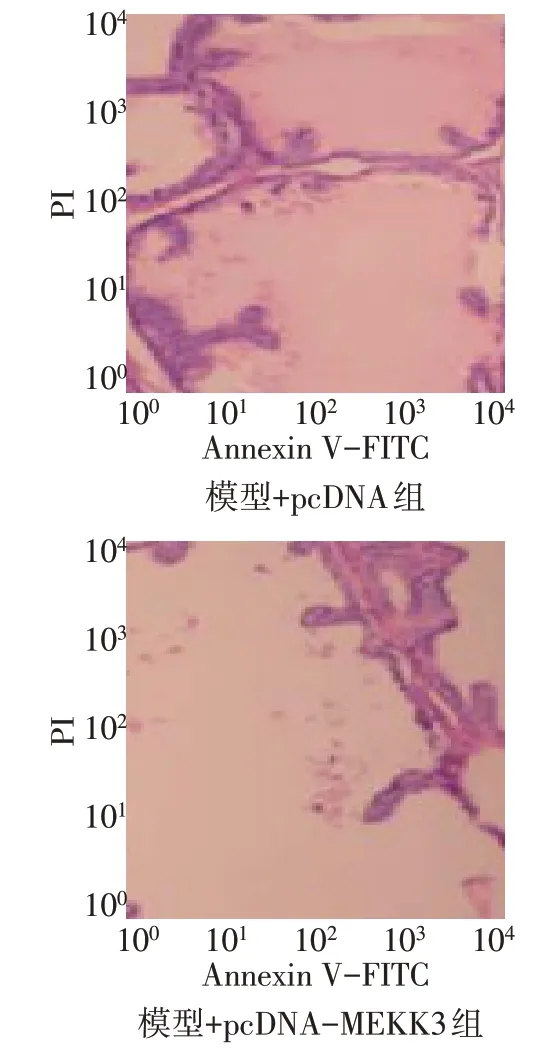
Fig.5 Effects of overexpression of MEKK3 on apoptosis of AD model cells detected by flow cytometry图5 流式细胞术检测过表达MEKK3对AD模型细胞凋亡的影响
2.7 上调MEKK3 恢复木犀草苷对AD 模型细胞损伤及炎性因子表达的影响
与模型+木犀草苷+pcDNA 组比较,模型+木犀草苷+pcDNA-MEKK3 组PC12 细胞增殖抑制率、凋亡率、炎性因子(TNF-α、IL-6、IL-1β)水平升高(P<0.05),见图6,表5。
Tab.5 Effects of up-regulation of MEKK3 to restore on inhibition rate of proliferation,apoptosis rate and expression of inflammatory factors in AD model cells表5 上调MEKK3恢复木犀草苷对AD模型细胞增殖抑制率、凋亡率及炎性因子表达的影响 (n=9,±s)

Tab.5 Effects of up-regulation of MEKK3 to restore on inhibition rate of proliferation,apoptosis rate and expression of inflammatory factors in AD model cells表5 上调MEKK3恢复木犀草苷对AD模型细胞增殖抑制率、凋亡率及炎性因子表达的影响 (n=9,±s)
组别模型+木犀草苷+pcDNA组模型+木犀草苷+pcDNA-MEKK3组t增殖抑制率/%12.48±0.78 33.27±1.87 30.782**凋亡率/%11.67±0.62 21.07±0.83 27.220**TNF-α/(ng/L)142.99±17.36 348.56±19.04 23.935**IL-6/(ng/L)126.56±9.61 347.98±20.81 28.979**IL-1β/(ng/L)133.38±15.76 238.75±17.50 13.423**

Fig.6 Effects of up-regulation of MEKK3 on cell apoptosis in AD model cells mediated by cynaroside detected by flow cytometry图6 流式细胞术检测上调MEKK3对木犀草苷介导的AD模型细胞凋亡的影响
3 讨论
AD 以渐进性记忆障碍、人格改变、智力减退等认知功能障碍为主要特征,其危害仅次于肿瘤、心血管疾病、脑卒中。目前,AD发病机制尚未完全阐明,其中Aβ在AD 患者大脑中沉积,可影响神经细胞骨架完整性,且通过干扰线粒体功能发挥细胞毒性致细胞损伤[7]。PC12细胞为大鼠肾上腺髓质嗜铬细胞瘤分化细胞株,具有神经细胞特性,因此常用Aβ 诱导PC12 细胞建立AD 模型[8]。本研究结果显示,PC12 细胞经Aβ25-35诱导后,细胞增殖活性降低,凋亡增加,PC12细胞发生损伤,模型建立成功。
目前AD 缺乏有效的治疗药物,针对AD 发病机制不同靶点的药物开发尚处于试验阶段。天然植物活性成分因毒性低、作用靶点多、疗效强等优点成为AD治疗药物的重点研究对象。木犀草苷具有抗菌、抗炎、抗肿瘤等功效[9-10]。研究显示,木犀草苷可抑制脂多糖诱导的HUVECs 分泌炎性因子和黏附因子,减轻HUVECs损伤[11]。本研究结果显示,木犀草苷可提高Aβ25-35诱导后PC12细胞增殖活性,并减少细胞凋亡,提示木犀草苷可减轻Aβ25-35诱导PC12细胞损伤,具有治疗AD的潜在价值。炎症是AD发病机制之一,Aβ大量堆积可诱发神经细胞产生过度炎症反应,分泌大量炎性因子,如TNF-α、IL-6、IL-1β,这些炎性因子进一步损伤神经细胞,加快AD发展进程[12]。在本实验中,木犀草苷可抑制Aβ25-35诱导PC12 细胞分泌TNF-α、IL-6 和IL-1β,提示木犀草苷可减轻Aβ25-35诱导PC12细胞炎性损伤,这也可能是其减轻Aβ25-35诱导PC12细胞损伤的机制之一。
MEKK3 属于丝裂原活化蛋白3 激酶家族成员,可通过激活细胞外信号调节激酶、NF-κB、p38 等多种信号通路调控细胞凋亡及炎症反应过程。研究显示,MEKK3 的异常表达与人类肿瘤、心脑血管疾病等多种疾病的发生发展密切相关[13-14]。据报道,在糖尿病小鼠中,MEKK3 可通过诱导p38 MAPK/NFκB通路的激活,加重2型糖尿病的认知缺陷,进而导致糖尿病脑病[15];此外,创伤性脑损伤小鼠皮质和海马中MEKK3 表达增加,下调MEKK3 可减轻氧糖剥夺/再灌注诱导的原代皮层神经元和神经胶质细胞凋亡及神经炎症[16]。在本研究中,Aβ25-35诱导PC12细胞中MEKK3 蛋白表达增加,敲减MEKK3 可抑制Aβ25-35诱导PC12 细胞凋亡、炎性因子表达,而过表达MEKK3 表现出相反作用,提示MEKK3 也具有作为AD 治疗分子靶点的潜力。同时,本研究结果显示,木犀草苷可抑制Aβ25-35诱导PC12细胞中MEKK3蛋白表达,而上调MEKK3可减弱木犀草苷对Aβ25-35诱导PC12 细胞增殖活性、凋亡、炎性因子表达的影响,这提示木犀草苷可能通过下调MEKK3 表达,抑制Aβ25-35诱导的PC12细胞损伤。
综上,木犀草苷可抑制Aβ25-35诱导的PC12细胞凋亡和炎性因子表达,有可能成为治疗AD 的药物,其作用机制可能与下调细胞中MEKK3 表达有关。但本研究仅通过体外细胞实验进行了探究,尚需进一步在体内观察木犀草苷治疗AD 的疗效性和安全性。
