血清lncRNA HOTAIR和miR-206表达水平与急性呼吸窘迫综合征患者病情严重程度及预后的关系▲
2023-07-17李开宇闫秀林赵志刚
李开宇 闫秀林 赵志刚
(大同市第三人民医院重症医学科,山西省大同市 037004)
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种严重威胁人类生命健康的呼吸系统重症疾病,主要临床表现为呼吸衰竭、顽固性低氧血症、呼吸窘迫,伴有胸闷、咳嗽、痰血,起病急、进展快,治疗困难,预后差[1-2]。ARDS的致病因素较多,包括药物中毒、外伤、胰腺炎等[3]。既往研究显示,ARDS患者死亡多发生在发病后2~3周[4],目前临床尚无有效的治疗方案来提高ARDS患者的生存率。因此,探讨ARDS病情严重程度及预后的相关预测指标有助于临床医生进行早期干预,改善患者的预后。HOX转录反义基因间RNA(HOX transcript anti-sense intergenic RNA,HOTAIR)是一种长度为2 148 nt的长链非编码RNA(long non-coding RNA,lncRNA),位于12q13.13染色体上,介于同源盒C(homebox C,HOXC)11和HOXC12基因之间,属于致癌性lncRNA,在多种肿瘤中表达上调[5]。Wang等[6]的研究结果显示,在经脂多糖处理的MLE-12细胞和ARDS小鼠模型中HOTAIR表达水平升高,在MLE-12细胞及ARDS小鼠模型中敲除HOTAIR基因后可减弱脂多糖诱导的炎症反应,从而缓解ARDS病情。miR-206位于人类染色体6q12上,是一种含有21个核苷酸序列的多功能miRNA,广泛参与肺功能的调节,例如其可以下调脑源性神经营养因子表达,导致气道平滑肌的神经功能障碍,进而导致肺部炎症性疾病,其还可以靶向抑制间隙连接蛋白43表达,调节肺泡气血屏障的通透性[7]。研究表明,miR-206在支气管、肺发育不良患者及急性肺损伤大鼠模型的外周血中表达下调,过表达miR-206能够抑制纤维连接蛋白1(fibronectin 1,FN1)表达,抑制大鼠Ⅱ型肺泡上皮细胞增殖并促进其凋亡[8]。本课题组通过ENCORI数据库发现,HOTAIR与miR-206具有互补序列,提示二者可能可以相互结合。有学者发现,靶向调控HOTAIR/miR-206/FN1轴是治疗心肌梗死的潜在方法[9],表明HOTAIR与miR-206存在靶向关系,并可能在相关疾病的诊治中发挥作用。本研究通过检测ARDS患者血清HOTAIR、miR-206的表达水平,分析二者与ARDS患者病情严重程度及入院28 d内生存情况的关系,初步探讨HOTAIR、miR-206在ARDS中的具体调控机制,同时为早期识别预后不良的高危患者提供新的生物学标志物。
1 资料与方法
1.1 临床资料 选取2019年10月至2021年10月在我院治疗的110例ARDS患者作为研究对象。纳入标准:(1)体征、病史及各项辅助检查结果均符合ARDS诊断标准[10];(2)入院时发病时间≤24 h;(3)患者及家属均知情同意;(4)全程在本院接受治疗且配合本次研究;(5)无激素治疗史。排除标准:(1)合并病毒性肝炎、严重瓣膜病、心源性或神经源性肺水肿、支气管哮喘、心律失常、感染、血液系统疾病、肺部肿瘤等的患者;(2)临床诊断不明确的患者;(3)自动出院或不能配合本次研究的患者;(4)确诊ARDS 24 h内即死亡的患者;(5)严重精神障碍的患者。其中,男性58例、女性52例,年龄30~76(57.77±8.62)岁,体质指数18~26(23.08±2.46)kg/m2。本研究经大同市第三人民医院医学伦理委员会批准。
1.2 方法
1.2.1 收集患者入院时的一般资料与临床资料:一般资料包括年龄、性别、发病原因、合并基础疾病、体质指数、吸烟史(吸烟史定义为每日吸烟1支以上,并持续1年以上)、饮酒史(饮酒史定义为每日乙醇摄入量超过40 g或每周饮酒量超过280 g,并持续1年以上)。查阅患者的电子病历,收集其临床资料,包括入院时心率、舒张压、收缩压、病因、呼吸频率、基础疾病、氧合指数[PaO2/吸入氧比例(fraction of inspiration oxygen,FiO2)]、急性生理与慢性健康评价Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHEⅡ)评分、血清白蛋白水平、动脉血pH值、空腹血糖水平、呼气末正压通气(positive end-expiratory pressure ventilation,PEEP)。其中,APACHEⅡ总分范围为0~71分,评分越高表明病情越严重,总分<15分为非重症、≥15分则为重症。使用弘盛GT6800监护仪(济宁弘盛医疗器械有限公司)测量患者入院时的PEEP。
1.2.2 实时荧光定量PCR检测患者血清HOTAIR和miR-206的表达水平:采集患者入院次日早晨空腹外周血10 mL,4 ℃下以3 000 r/min离心10 min,取上层血清。采用总RNA提取试剂盒(TaKaRa公司,批号:9112)从血清中提取总RNA,使用核酸测定仪(北京凯奥科技发展公司,型号:K5500)检测RNA纯度和浓度,然后取2 μg总RNA作为模板,经过PrimeScriptTM1st Strand cDNA Synthesis试剂盒(TaKaRa公司,货号:6110A)逆转录得到cDNA,使用TB Green®Premix Ex TaqTMⅡ(Tli RNase H Plus)(TaKaRa公司,货号:RR820A)配置反应体系,选用GADPH作为内参,通过LightCycler480实时荧光定量PCR仪扩增目的基因。取血清样品,利用miRNA抽提试剂盒(康为世纪生物科技股份有限公司,批号:CW0627S)提取miRNA,取2 μg miRNA按照miRNA反转录试剂盒[天根生化科技(北京)有限公司,货号:KR211-02]说明书的操作标准将样本miRNA反转录为cDNA,以U6为内参,使用miRcute增强型miRNA cDNA第一链合成试剂盒[天根生化科技(北京)有限公司,货号:FP411-01]检测血清miR-206的表达水平。反应体系为SYBR Mixture 10.0 μL,cDNA 2.0 μL,正、反向引物(10 μmol/L)各2.0 μL,ddH2O 4.0 μL。反应条件为95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸20 s,共计40个循环。根据2-ΔΔCt法分别计算HOTAIR和miR-206基因的相对表达量,各引物序列见表1。

表1 引物序列
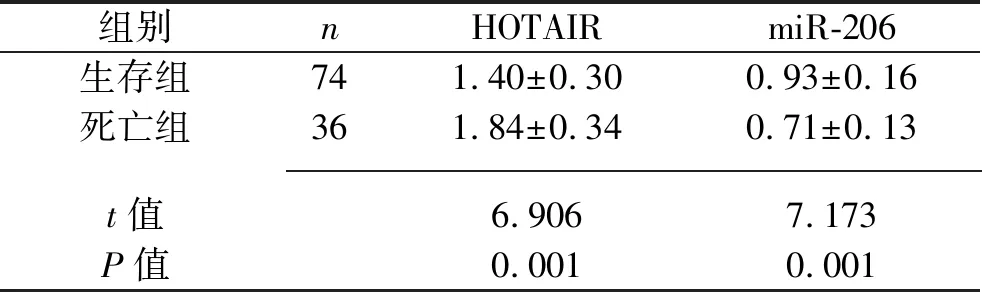
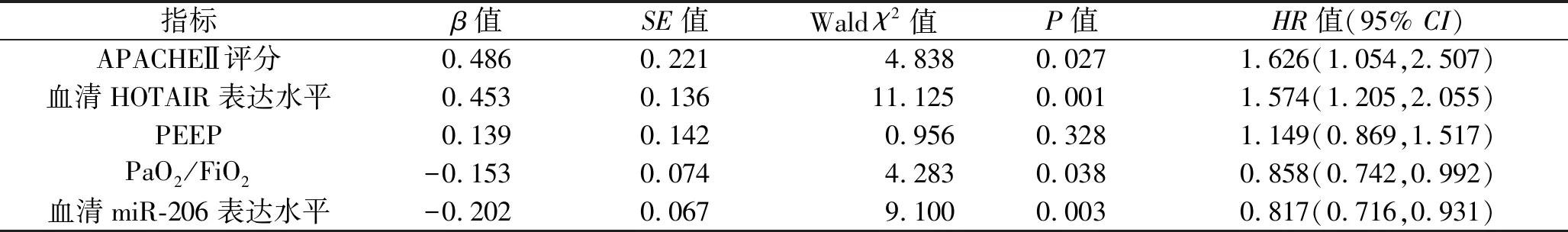
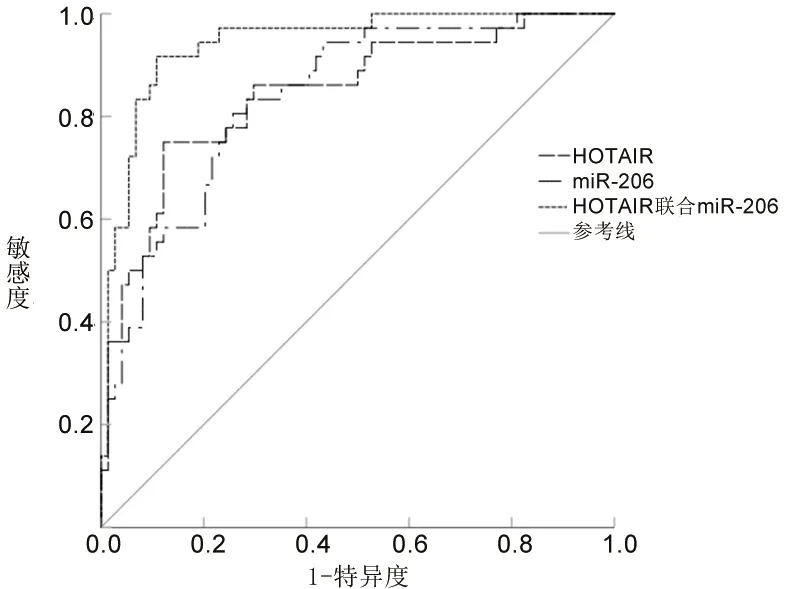
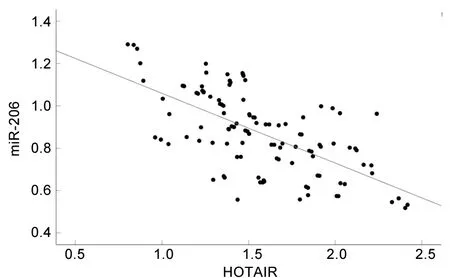
1.2.3 分组:参照参考文献[4],根据入院时的PaO2/FiO2将ARDS患者分为ARDS轻度组(200 mmHg 1.3 统计学分析 采用SPSS 23.0软件进行统计学分析。计数资料以例数(百分比)表示,比较采用χ2检验或Fisher精确检验法。符合正态分布的计量资料以(x±s)表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t法。采用COX回归模型分析ARDS患者入院28 d内死亡的影响因素。采用受试者工作特征(receiver operating characteristic,ROC)曲线分析血清HOTAIR、miR-206表达水平预测ARDS患者入院28 d内死亡的效能。采用Pearson法对ARDS患者血清HOTAIR和miR-206表达水平进行相关性分析。以P<0.05表示差异有统计学意义。 2.1 不同病情严重程度ARDS患者一般资料与临床资料的比较 ARDS轻度组、ARDS中度组、ARDS重度组患者的APACHEⅡ评分、PEEP均依次升高(均P<0.05),但3组间的年龄、性别、吸烟史、饮酒史、发病原因、合并基础疾病、体质指数、心率、呼吸频率、收缩压、舒张压、空腹血糖水平、动脉血pH值、血清白蛋白水平比较,差异均无统计学意义(均P>0.05)。见表2。 表2 不同病情严重程度ARDS患者一般资料与临床资料的比较 2.2 不同病情严重程度ARDS患者血清HOTAIR和miR-206表达水平的比较 ARDS轻度组、ARDS中度组、ARDS重度组患者的血清HOTAIR表达水平依次升高,而血清miR-206表达水平依次降低(均P<0.05)。见表3。 表3 不同病情严重程度ARDS患者血清HOTAIR和miR-206表达水平的比较(x±s) 2.3 不同临床结局ARDS患者一般资料与临床资料的比较 与生存组相比,死亡组患者的APACHEⅡ评分、PEEP均升高,PaO2/FiO2降低(均P<0.05),两组患者的年龄、性别、吸烟史、饮酒史、发病原因、合并基础疾病、体质指数、心率、呼吸频率、收缩压、舒张压、空腹血糖水平、动脉血pH值、血清白蛋白水平的比较,差异均无统计学意义(均P>0.05)。见表4。 表4 不同临床结局ARDS患者一般资与临床资料的比较 2.4 不同临床结局ARDS患者血清HOTAIR和miR-206表达水平的比较 相比于生存组,死亡组患者的血清HOTAIR表达水平更高,血清miR-206表达水平更低(均P<0.05)。见表5。 表5 不同临床结局ARDS患者血清HOTAIR、miR-206表达水平的比较(x±s) 2.5 COX回归分析 将2.3及2.4中具有统计学意义的APACHEⅡ评分(实测值)、PEEP(实测值)、PaO2/FiO2(实测值)、血清miR-206表达水平(实测值)、血清HOTAIR表达水平(实测值)作为自变量,以ARDS患者的临床结局为因变量(死亡=1,存活=0),纳入COX回归模型进行分析。结果显示,APACHEⅡ评分、PaO2/FiO2、血清HOTAIR表达水平、血清miR-206表达水平均是ARDS患者入院28 d内死亡的影响因素(均P<0.05)。见表6。 表6 ARDS患者入院28 d内死亡影响因素的COX回归分析 2.6 血清HOTAIR和miR-206表达水平预测ARDS患者入院28 d内死亡的效能 ROC曲线分析结果显示,血清HOTAIR表达水平、血清miR-206表达水平及两者联合预测ARDS患者入院28 d内死亡的曲线下面积(area under the curve,AUC)分别为0.845(95%CI:0.765,0.926)、0.837(95%CI:0.760,0.913)、0.943(95%CI:0.899,0.987),特异度分别为87.80%、71.60%、89.20%,敏感度分别为75.00%、83.30%、91.70%,最大约登指数分别为0.628、0.549、0.809。见图1。 图1 血清HOTAIR和miR-206表达水平预测ARDS患者入院28 d内死亡的ROC曲线图 2.7 血清HOTAIR和miR-206表达水平的相关性分析 Pearson相关性分析结果显示,ARDS患者血清HOTAIR的表达水平与血清miR-206的表达水平呈负相关(r=-0.646,P<0.001),见图2。 图2 ARDS患者血清HOTAIR与miR-206表达水平的相关性分析 ARDS是一种以呼吸系统衰竭为特征的急性弥漫性肺损伤,常见于重症监护室患者,由直接肺损伤(肺炎、误吸等)或间接肺损伤(败血症、外伤等)引起,发病机制复杂,致残率与致死率均较高[11]。尽管目前ARDS的早期诊断和治疗手段已取得较大进步,但尚无直接针对ARDS病理机制的有效治疗方法,大部分患者的临床转归仍不理想。另外,ARDS患者虽然经治疗后肺功能可有不同程度的恢复,但是仍有超过50%的患者在患病两年后出现呼吸功能下降,25%~78%的患者在患病1年内出现认知功能障碍,部分患者伴有抑郁、焦虑等不良心理症状[12]。目前临床上主要采用APACHEⅡ评分和Murray肺损伤评分系统来评估ARDS患者的预后,但二者具有主观性,特异性较差,例如APACHEⅡ评分并不能特异性区分脓毒症、ARDS或急性肾损伤[13]。因此,亟须寻找特异性指标来准确识别高危ARDS患者,及时调整临床治疗策略,以改善ARDS患者的预后。 ARDS疾病进展与炎症反应密切相关,炎症反应可以引起肺泡上皮和内皮细胞通透性增加,导致肺水肿发生,加重肺部损伤[11]。研究表明,lncRNA可以通过调控mRNA的稳定性及表达水平,以及竞争性结合miRNA等途径,来参与ARDS患者免疫炎症反应、细胞组织修复、血管内皮损伤等病理过程[14]。Yao等[15]发现,lncRNA肺腺癌转移相关转录本1可以通过靶向调控miR-150-5p来参与ARDS小鼠模型的肺损伤,提示lncRNA可以靶向结合miRNA来调控ARDS的病理过程。HOTAIR是一种与细胞周期、炎症反应、基因沉默、神经元功能等相关的lncRNA,有研究表明,HOTAIR参与脂多糖诱导的多种炎症损伤信号通路的调控过程,如脂多糖诱导的小鼠软骨细胞炎症损伤[16]。有学者发现,HOTAIR在脂多糖诱导的急性肺损伤动物模型中表达上调,HOTAIR被敲除后可减轻脂多糖诱导的急性肺损伤,进一步的功能试验表明HOTAIR通过调节miR-17-5p来影响细胞的自噬和生物学活动,从而促进脂多糖诱导的急性肺损伤[17]。此外,还有学者发现HOTAIR在脂多糖处理的MLE-12细胞和ARDS小鼠模型中的表达上调[6]。本研究结果显示,ARDS轻度组、ARDS中度组、ARDS重度组患者的血清HOTAIR表达水平依次升高(均P<0.05),说明HOTAIR的表达水平可能与ARDS患者的病情严重程度有关,其表达水平越高,患者的病情越严重。Wang等[6]的研究发现,抑制HOTAIR可调节miR-30a-5p/磷酸二脂酶7A轴,减轻ARDS小鼠模型体内的炎症反应,这提示HOTAIR可能是通过靶向调控下游miRNA,间接调控与ARDS发生及发展相关的mRNA,从而参与ARDS的进展。生物信息学分析结果显示,HOTAIR与miR-206核酸序列存在结合位点。miR-206被证实是一种抑癌因子,可抑制多种肿瘤的发生与发展[18]。研究表明,miR-206广泛参与肺功能调节[19-20],还在炎症过程中扮演重要角色[21]。本研究结果显示,ARDS轻度组、ARDS中度组、ARDS重度组患者的血清miR-206表达水平依次降低(均P<0.05),说明miR-206可能参与ARDS的发展,且其表达水平可反映ARDS病情严重程度。 本研究还根据ARDS患者的临床结局进行分组,结果显示,相比于生存组,死亡组患者的血清HOTAIR表达水平更高,血清miR-206表达水平更低(均P<0.05),说明血清HOTAIR及miR-206的表达水平与ARDS患者的预后相关。进一步行COX回归分析,结果显示,血清HOTAIR表达水平升高及血清miR-206表达水平降低均是ARDS患者入院28 d内死亡的危险因素(均P<0.05),提示二者或许可以作为ARDS患者入院28 d内死亡的预测指标。本研究ROC曲线分析结果显示,血清HOTAIR表达水平及血清miR-206表达水平预测ARDS患者入院28 d内死亡的AUC分别为0.845、0.837,说明血清HOTAIR及miR-206表达水平单独预测ARDS患者入院28 d内死亡情况具有一定的价值,但诊断效能中等(AUC均<0.9),而二者联合预测ARDS患者入院28 d内死亡的AUC为0.943,且敏感度与特异度均较单独检测更高,说明血清HOTAIR与miR-206表达水平联合检测预测ARDS患者预后的效能更高。这提示,对于血清HOTAIR呈高表达、血清miR-206呈低表达的ARDS患者,临床医护人员应给予高度警惕,制订好治疗策略,以降低患者的死亡率。本研究进一步行相关分析发现,ARDS患者血清HOTAIR表达水平与血清miR-206表达水平呈负相关(P<0.05),提示HOTAIR、miR-206可能共同参与ARDS中的炎症反应。然而,HOTAIR是否能够靶向调控miR-206进而参与ARDS发病过程,还需要通过体外细胞实验进一步证实。 综上所述,血清HOTAIR、miR-206的表达水平与ARDS患者的病情严重程度及预后密切相关,血清HOTAIR表达水平升高及血清miR-206表达水平降低均是ARDS患者入院28d内死亡的危险因素,且ARDS患者血清HOTAIR表达水平与血清miR-206表达水平呈负相关,二者联合检测对ARDS患者的预后具有较好的预测价值,为ARDS发病机制的研究及治疗提供新的思路。但本研究纳入病例数较少,未来还需要加大样本量进行深入研究,且HOTAIR、miR-206在ARDS中的具体调控机制及应用价值还需要进一步探讨。2 结 果



3 讨 论
