固氮模块在耐辐射异常球菌底盘中的表达特性分析
2023-07-17邱雪萌郑娟薛威毋少宇祁陈韩月月燕永亮战嵛华
邱雪萌, 郑娟, 薛威, 毋少宇, 祁陈, 韩月月, 燕永亮, 战嵛华
(中国农业科学院生物技术研究所,北京 100081)
氮素是植物重要的营养元素之一,也是农作物产量及品质的限制因素,工业氮肥的过度施用造成了土壤板结、水体富营养化等环境问题[1-2]。自然界中,某些原核微生物在常温常压下通过固氮酶将空气中的氮素转化为铵,这一过程称为生物固氮[3],利用生物固氮减少农业生产对工业氮肥的依赖,最终实现主要农作物自主固氮是生物固氮领域的研究热点。然而,天然固氮体系易受氧气等环境因素的影响、固氮菌株宿主范围较窄,使得生物固氮至今难以大规模应用于农业生产[1-4]。科学家们对此提出了3种技术策略:扩大根瘤菌的宿主范围、构建高效联合固氮体系以及人工设计固氮装置[5]。
自1972年以接合转移的方法首次成功构建人工固氮大肠杆菌以来[6],随着生物固氮基因工程和合成生物学的发展,通过将固氮相关基因转移到不同的底盘生物中,并经过人工改造进一步提高固氮装置中固氮模块的表达,在构建自主固氮植物领域取得了一系列重要进展[7]。耐辐射异常球菌(Deinococcus radiodurans)R1是1株进化地位特殊的革兰氏阳性菌,具有极强的辐射抗性[8]。同时,耐辐射异常球菌因具有独特的生长特性以及表达新型工程功能蛋白的能力,已经作为新的底盘微生物在生物技术和生物修复中得以应用[9]。类芽孢杆菌(Paenibacillus polymyxa)WLY78是1株革兰氏阳性固氮菌,P. polymyxaWLY78含有1个由9个固氮基因(nifB, nifH, nifD, nifK,knife, nifN, nifX, hesA, nifV)组成的最小固氮基因簇,并且该固氮基因簇的9个基因为共转录表达,组成了1个转录单元,将此固氮基因簇转移到大肠杆菌中能使大肠杆菌成功表达固氮酶活性[10]。
本研究通过将革兰氏阳性类芽孢杆菌WLY78的固氮模块导入耐辐射异常球菌R1中获得重组耐辐射异常球菌R78,对该菌株在不同水平的表达特性进行探究,同时结合转录组分析,初步明确固氮基因簇在重组耐辐射异常球菌的表达特征,以期为进一步固氮模块设计和底盘优化奠定理论基础。
1 材料与方法
1.1 试验材料
1.1.1 菌株、质粒与培养条件 耐辐射异常球菌R1、质粒pRADZ3以及施氏假单胞菌(Pseudomonas stutzeri)A1501为本实验室保存,质粒pHY300PLK-78由中国农业大学赠予。高频转化宿主菌株DH5α购自北京康为世纪公司,高频转化宿主菌株JM109购自Solarbio公司。大肠杆菌采用LB培养基置于37 ℃培养,耐辐射异常球菌及其衍生菌株采用TGY培养基置于30 ℃培养。
1.1.2 试剂与耗材 限制性核酸内切酶购自NEB公司,质粒提取试剂盒以及琼脂糖凝胶DNA回收试剂盒购自Magen公司,细菌基因组DNA提取试剂盒购自Tiangen公司,细菌RNA提取试剂盒购自Analytik Jena公司,RNA反转录试剂盒购自TaKaRa公司,荧光定量PCR试剂购自Vazyme公司。试验所涉及的引物合成以及测序均由生工生物公司完成。
1.1.3 主要仪器 PCR仪(型号ABI Veriti™ Dx)和实时荧光定量扩增仪(型号ABI 7500)均购自美国Thermo Fisher公司,数字PCR仪(型号Naica)购自Stilla公司,超微量分光光度计(型号NanoPhotometer-NP80)购自德国Implen公司,紫外可见光分光光度计(型号U-3010)购自日本Hitachi公司,台式高速冷冻离心机(型号5424R)购自德国Eppendorf公司,全温培养器(型号THZC-1)购自北京天林恒泰公司,核酸蛋白提取仪(型号MP-FastPrep-24)购自美国Thermo Fisher公司,凝胶成像系统(型号GelDoc XR)购自美国Bio-Rad公司。
1.2 试验方法
1.2.1 重组耐辐射异常球菌R78的构建方法 通过酶切连接反应,用XbaⅠ、BamHⅠ 限制性内切酶以及T4 DNA连接酶将质粒pHY300PLK-78上完整的固氮基因簇(nifBnifHnifDnifKnifEnifNnifXhesAnifV)克隆到穿梭质粒pRADZ3中,获得重组质粒pRADZ3-78。采用热击转化的方法将验证后的pRADZ3-78质粒导入大肠杆菌JM109中,筛选获得重组大肠杆菌Escherichia coliZ3,通过对E. coliZ3进行固氮酶活性测定,并采用化学转化的方法[11]使pRADZ3-78质粒转入耐辐射异常球菌R1中,验证后获得重组耐辐射异常球菌R78。试验中所用PCR引物如表1所示。

表1 试验所用引物Table 1 Primers used in this study
1.2.2 生长曲线测定 将活化后的D. radioduransR1、D. radioduransR78菌株接种至含有相应抗生素的TGY液体培养基中,置于30 ℃、220 r·min-1过夜培养至稳定期,按照初始OD600=0.1转接菌株培养液于新鲜的培养基中,每种菌株设置3个平行重复。将菌液置于30℃、220 r·min-1继续培养,每隔3 h取样并测定样品的OD600,连续测定36 h。最后根据所得数据,以培养时间为横坐标,OD600值为纵坐标,绘制生长曲线图。
1.2.3 固氮酶活性测定 采用乙炔还原法在厌氧管中测定固氮酶活性[12]。将待测菌株进行固氮条件的胁迫培养,并收集厌氧管中的气体用气相色谱法检测并记录乙烯峰面积。通过绘制蛋白质标准曲线,测定并计算蛋白含量。同时,使用气象色谱仪标定1 nmol乙烯的量,根据以下公式计算固氮酶活性。
1.2.4 转录水平表达测定 收集6种不同铵氧条件(0 mmol·L-1+0.0% O2、0 mmol·L-1+0.5%O2、0 mmol·L-1+1.0% O2、0 mmol·L-121.0% O2、100 mmol·L-1NH+4+0.5% O2、100 mmol·L-1+21.0% O2)下培养的D. radioduransR78的菌体,利用细菌RNA提取试剂盒提取菌体中的总RNA,并利用Prime Script RT reagent Kit with gDNA Eraser试剂盒制备cDNA,通过qPCR分析D. radioduransR78中固氮基因在不同铵氧条件下的表达差异,进一步通过荧光染料法基于Naica Geode微滴生成扩增系统和Naica Prism3微滴阅读分析系统以及Crystal Miner数据分析进行数字PCR。试验所涉及的反应体系及反应程序参考相应试剂盒说明书。
1.2.5 翻译水平表达测定 收集6种不同铵氧条件下培养的D. radioduransR78菌体,使用Western Blot的方法检测NifH蛋白表达情况。将上述菌体使用超声破碎仪器在20%功率下,工作3 s,间隔3 s进行超声破碎提取菌株的总蛋白,将总蛋白离心后,分别收集蛋白上清液及沉淀,通过12%的SDS聚丙烯酰胺凝胶对蛋白样品进行分离,然后利用半干转移的方法进行蛋白的分离与转膜,经过2次抗体孵育以及HRP-DAB(horseradish peroxidase-diaminobenzidine)显色后,利用放射自显影仪器拍摄PVDF膜。
1.2.6 转录组测定 在高氮、好氧(100 mmol·L-1+21.0% O2)和无氮、厌氧条件(0 mmol·L-1+0.0% O2)下,30 ℃、220 r·min-1培养D.radioduransR78至对数初期,离心收集菌体并用液氮速冻。通过Illumina第二代高通量测序技术对转录组进行测序分析。
2 结果与分析
2.1 重组耐辐射异常球菌R78构建及验证
前期研究发现,将含有类芽孢杆菌(Paenibacillus polymyxa)WLY78固氮基因簇的质粒pHY300PLK-78导入大肠杆菌JM109能使大肠杆菌在一定程度上表达固氮酶活性,为探究P. polymyxaWLY78的固氮基因簇能否在D. radioduransR1中有效表达,首先将该固氮基因簇通过酶切、连接反应克隆到穿梭质粒pRADZ3中,通过PCR扩增与测序验证后获得重组质粒pRADZ3-78,并将该质粒转入大肠杆菌JM109,获得重组大肠杆菌E. coliZ3(图1A)。通过乙炔还原法测定了E. coliZ3在0 mmol·L-1NH+4+和0.0%O2含量条件下的固氮酶活性,并以施氏假单胞菌(P. stutzeri)A1501作为对照。结果(图2)显示,固氮条件下的E. coliZ3和A1501乙炔还原能力随时间的增加而增大,且在增加速率最快的时间段里(24~48 h)E. coliZ3固氮酶活性约为A1501的11%,表明pRADZ3-78固氮功能完整,可作为转化耐辐射异常球菌R1的功能模块。进一步通过化学转化的方法将pRADZ3-78导入耐辐射异常球菌R1中,PCR扩增验证后获得重组耐辐射异常球菌R78(图1B)。
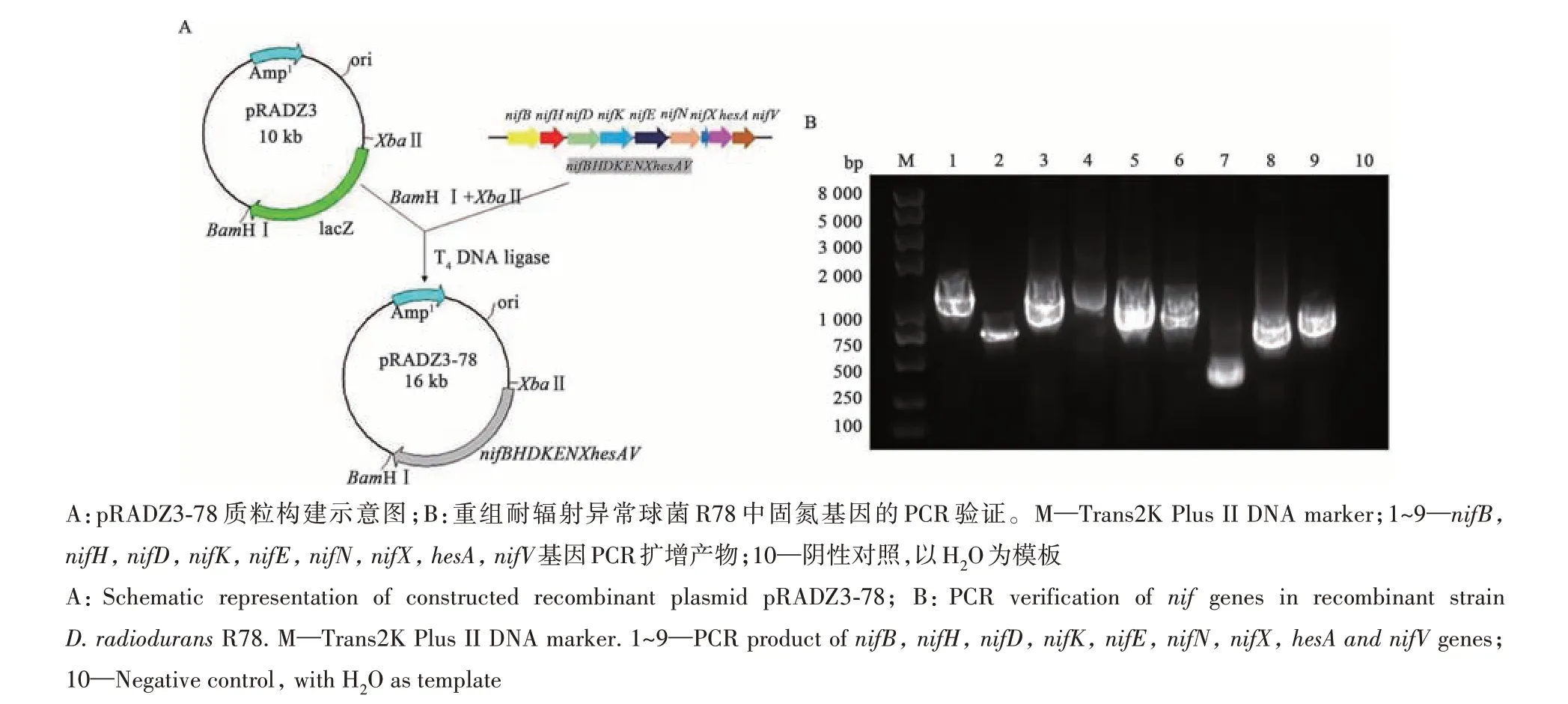
图1 重组耐辐射异常球菌R78构建及验证Fig. 1 Construction and verification of recombinant D. radiodurans R78 strain

图2 菌株的固氮酶活性Fig. 2 Nitrogenase activities of bacteria
2.2 重组耐辐射异常球菌R78表型测定
为探究固氮基因簇转入耐辐射异常球菌R1是否会影响其正常生长,测定了正常培养条件下的野生型D. radioduransR1和重组菌株D. radioduransR78的生长曲线,结果(图3)表明,固氮基因簇转入耐辐射异常球菌R1对其各个时期的菌株生长情况影响较小。同时,为探究固氮条件(厌氧或微好氧)下D. radioduransR1和D. radioduransR78的生长情况,利用紫外分光光度计测定了2种菌株在不同氧含量下于TGY培养基中的OD600变化情况(初始OD600=0.1),结果(表2)显示,氧气含量的变化对野生型菌株D. radioduransR1和重组菌株D. radioduransR78的生长情况都有影响,但是在厌氧和微好氧条件下,野生型菌株R1和重组菌株R78都能微弱生长,这保证了固氮酶能够在耐辐射异常球菌R1底盘中不失活,也表明后续的固氮活性测定以及固氮基因表达分析中能够选择厌氧和微好氧条件作为培养条件。

图3 野生型D. radiodurans R1和重组菌株D. radiodurans R78在TGY培养基的生长曲线Fig. 3 Growth curves of the wild-type strain D. radiodurans R1 and recombinant strain D. radiodurans R78 in TGY medium

表2 不同氧含量下野生型D. radiodurans R1和重组菌株D. radiodurans R78在TGY培养基中的生长Table 2 Growth of wild-type D. radiodurans R1 and recombinant strain D. radiodurans R78 in TGY medium under different oxygen contents
为探究固氮基因簇转入耐辐射异常球菌R1能否赋予其固氮活性,采用乙炔还原法测定重组菌株D. radioduransR78在6种不同铵氧条件下的固氮酶活性,结果(图4)显示,重组菌株D. radioduransR78在6种不同铵氧条件下均未表现出乙炔还原能力,表明该固氮基因簇不能在耐辐射异常球菌R1底盘中表达固氮酶活性,需要进一步分析D. radioduransR78中固氮基因的表达特性。

图4 重组耐辐射异常球菌R78和野生型施氏假单胞菌A1501的固氮酶活Fig. 4 Nitrogenase activities of recombinant strain D. radiodurans R78 and wild type P. stutzeri A1501
2.3 固氮相关基因的转录水平表达分析
为探究D. radioduransR78中固氮基因在转录水平的表达情况,利用琼脂糖凝胶电泳的方法对6种不同铵氧条件下D. radioduransR78的转录产物cDNA进行验证,结果(图5)显示,不同处理中重组菌株D. radioduransR78中的9个固氮基因在mRNA水平都有表达产物,并且表达水平差异不明显。为进一步探究固氮基因在转录水平上的表达差异,通过qPCR比较了不同铵氧条件下nifH基因的表达量,结果(图6)显示,不同铵氧条件下nifH基因的表达量都有微小的上调或者下调(0.57~1.10),其中无氮厌氧条件(0 mmol·L-1NH+4+0.0% O2)下nifH基因的表达量相对上调最大,此研究结果与已报道的将固氮基因簇转入大肠杆菌JM109底盘所得到的结果一致[10]。同时,采用数字PCR分析不同铵氧条件下D. radioduransR78中固氮基因nifH的绝对表达量,并与施氏假单胞菌A1501在固氮条件下nifH的绝对表达量进行比较,结果(表3)显示,与A1501在固氮条件(无氮微好氧)下相比,D. radioduransR78中nifH基因绝对表达量有2个数量级的降低,表明D. radioduransR78中固氮基因尽管可以在转录水平表达,但是表达水平较低,这可能是D. radioduransR78不能检测到固氮酶活性的原因。

图5 不同铵氧条件下耐辐射异常球菌R78中固氮相关基因的转录水平表达Fig. 5 Transcription level expression of nif genes in D. radiodurans R78 under different NH4+ and O2 conditions
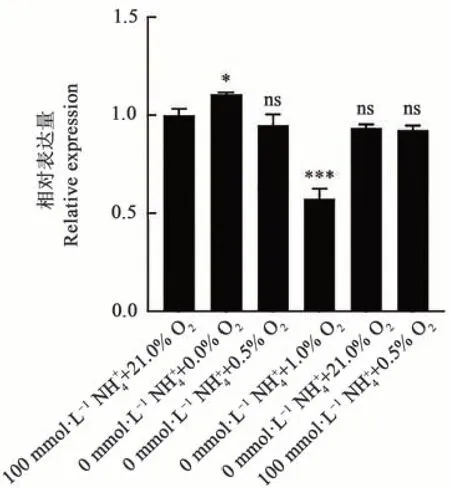
图6 耐辐射异常球菌R78中nifH基因在不同铵氧条件下的相对表达量Fig. 6 Relative expression of nifH of the D. radiodurans R78 in different NH+4 and O2 conditions

表3 数字PCR研究铵和氧对不同菌株固氮酶编码基因nifH转录的影响Table 3 Effects of NH+4 and O2 on nifH gene transcription in different strains by dPCR
进一步利用转录组测序,分析固氮条件(无氮厌氧,0 mmol·L-1NH+4+0.0% O2)和非固氮条件下(高氮好氧100 mmol·L-1NH+4+21.0% O2)D. radioduransR78中基因表达量变化情况,结果显示,相比于高氮好氧条件,无氮厌氧条件下显著上调表达(P-adjust<0.05且log2FC ≥1)的差异基因193个,显著下调表达(P-adjust < 0.05 且 log2FC≤-1)的差异基因有195个,其中,参与能量传递、氮代谢以及铁硫转运的相关基因的表达变化可能是影响重组菌株中固氮酶表达的限制因子(图7)。

图7 重组耐辐射异常球菌R78碳代谢途径中的差异表达基因Fig. 7 Differentially expressed genes in carbohydrate metabolism of recombinant strain D. radiodurans R78
2.4 固氮基因的翻译水平表达
为验证重组耐辐射异常球菌R78中的固氮基因在蛋白水平上的表达情况,采用Western Blot的方法检测了6种不同铵氧条件下D. radioduransR78中NifH蛋白的表达,并以无氮厌氧(0 mmol·L-1NH+4+0.0% O2)条件下30 ℃、220 r·min-1振荡培养2 h的野生型D. radioduransR1为阴性对照,以无氮微好氧(0 mmol·L-1NH+4+1.0% O2)条件下30 ℃、220 r·min-1振荡培养2 h的野生型A1501为阳性对照,结果如图8所示,在不同铵氧条件下,重组耐辐射异常球菌R78中NifH蛋白的表达量特别低,甚至没有表达。结合数字PCR结果,推测由于NifH极低水平的表达导致D. radioduransR78没有固氮酶活性。
3 讨论
生物固氮作为生态系统中有效氮的重要合成途径,能够提供大量可被利用的绿色氮源[13]。然而,天然固氮体系存在易受环境影响、具有较强的寄主特异性等限制,难以在农业生产中大规模应用。随着合成生物学的发展,以不同微生物为底盘构建人工高效联合固氮体系,最终实现真核生物自主固氮成为了生物固氮领域的研究前沿,也是世界性的农业科技难题[14]。固氮酶是一种对氧敏感的金属酶,在固氮微生物的基因组中,固氮相关的nif基因以1个或多个基因簇存在,这些nif基因在固氮酶的生物合成中发挥重要作用[15-17],此外,全基因组测序发现,几乎所有的固氮微生物都含有nifH、 nifD、 nifK、 nifE、 nifN以及nifB基因,这与在体外组装固氮酶组分FeMo-co所需的最小nif基因数量一致[18],这也为人工设计固氮装置提供了理论基础。
研究表明,将类芽孢杆菌WLY78的固氮基因簇转移到与其同属的大肠杆菌JM109中能够使大肠杆菌成功表达固氮酶活性,并且重组大肠杆菌固氮基因的转录不受铵和氧调控[10]。而耐辐射异常球菌R1作为进化地位特殊的新底盘微生物,与类芽孢杆菌WLY78同为含有σ70因子的革兰氏阳性菌株,因此,将类芽孢杆菌WLY78中的固氮基因簇转移到耐辐射异常球菌R1中,不仅有利于固氮基因启动子的选择,也为探究将固氮基因簇转移到远缘微生物底盘甚至进一步转移至真核微生物中提供了试验依据。
本研究将类芽孢杆菌 WLY78中的固氮基因簇转移到耐辐射异常球菌 R1中,获得重组耐辐射异常球菌R78,并利用PCR和Western Blot等方法,发现外源固氮基因簇能够在耐辐射异常球菌R78中正常转录,但不能完成固氮酶铁蛋白的翻译,从而不具有固氮酶活性。通过转录组测定及分析发现,相比于高氮好氧条件,无氮厌氧条件下重组耐辐射异常球菌R78中三羧酸循环途径、磷酸戊糖途径、氮代谢和铁硫转运系统相关基因下调显著,其中编码丙酮酸脱氢酶复合体的aceE和aceF基因均下调(分别为0.290和0.397倍),丙酮酸脱氢酶能够催化丙酮酸生成乙酰-CoA,而乙酰-CoA能够在NifV蛋白的催化下与α-酮戊二酸缩合形成R-高柠檬酸,R-高柠檬酸参与FeMo-co的合成过程,推测三羧酸循环途径相关基因表达量较低造成重组耐辐射异常球菌R78中能量代谢效率降低,导致固氮酶合成受到影响不能发挥功能。研究结果为进一步的固氮模块设计和底盘优化,并最终构建人工高效固氮装置提供理论指导。
