蕨麻cpSSR序列特征分析
2023-07-17田甜李军乔王鑫慈曲俊儒
田甜 李军乔 王鑫慈 曲俊儒

摘要 基于NCBI数据库中收录的蕨麻叶绿体基因组序列,利用REPuter软件和MISA软件分析其微卫星分布规律。结果显示,在叶绿体基因组中共检测到34个散在重复序列,22个分布在LSC区,10个分布在IR区,2个分布在SSC区。使用MISA 共注释到92个SSR位点,平均每1 820 bp出现1个SSR位点。SSR主要分布在LSC区(79.07%),重复序列主要以单碱基为主,占总数量的86.05%。微卫星长度平均为12 bp,大多数长度为10 bp,说明蕨麻中重复基元较短的微卫星变异速率较快。
关键词 蕨麻;叶绿体基因组;微卫星
中图分类号 Q 943 文献标识码 A
文章编号 0517-6611(2023)12-0094-04
doi:10.3969/j.issn.0517-6611.2023.12.021
Characterization Analysis of Microsatellite in Chloroplast of Potentilla anserina
TIAN Tian1,2,LI Jun-qiao1,2,WANG Xin-ci1,2 et al
(1.The College of Ecological Environment and Resources,Qinghai Minzu University,Xining,Qinghai 810007.2.Tibetan Plateau Juema Industry Research Institute,Xining,Qinghai 810007)
Abstract The chloroplast genome sequences of Potentilla anserina L. was used to analyze the distribution of microsatellite from Gen Bank Database.It was analyzed with bioinformatics software REPuter and MISA.The results showed that it owned a total of 34 dispersed repetitive sequence in the chloroplast genome of Potentilla anserina L.,mainly distributed in the large single-copy region and Inverted repeat,22 and 10 respective,the small single-copy region merely 2.Using the MISA found 92 microsatellites in the chloroplast genome of Potentilla anserina L.One SSR locus per 1 820 bp.Mainly distributed in the large single-copy region (79.07%),the most commom repeat type of the cpSSR is mononucleotide repeat which accountede for 86.05%.The average length of SSR is 12 bp,mainly concentrated in 10 bp,which suggested that the shorter length of SSR in Potentilla anserina L.is change faster.
Key words Potentilla anserina L;Chloroplast genome;SSR
基金项目 青海省重点研发与转化计划项目(2022-NK-120);青海民族大学2021年研究生创新项目(954M2021005)。
作者简介 田甜(1997—),女,贵州铜仁人,硕士研究生,研究方向:药用植物资源开发与利用。*通信作者,教授,博士生导师,从事药用植物资源开发与利用研究。
收稿日期 2023-01-08
蕨麻(Potentilla Anserina L.),是蔷薇科(Rosaceae)鹅绒委陵菜的一个变种,在我国西部地区尤其是青藏高原地区因块根膨大而被称为蕨麻,亦称“人参果”[1]。蕨麻地上和地下部分均有丰富的营养价值,尤其是地下块根部分,研究发现,蕨麻块根中含有黄铜、鞣质、多糖、皂苷等活性成分,具有降血糖、降血脂、抗凝血、抗氧化、健脾益胃等作用[2];地上部分含有粗蛋白质、粗脂肪、粗纤维等成分[3]。因此,蕨麻可作为青藏高原优质药食两用植物资源。刘素君等[4]通过提取蕨麻多糖,将其作用于人肝瘤SMMC-7721细胞的体外增殖抑制作用,结果表明,蕨麻多糖对其生长的抑制作用最高可達43.57%,同时对T-淋巴细胞和巨噬细胞的吞噬率有显著提高,说明蕨麻多糖在肿瘤的治疗上有很大作用;Chen等[5]研究发现,蕨麻可以有效增加免疫细胞数量,从而达到增强免疫力的效果。在日常饮食中,西部地区尤其是高原地区农牧民,经常用蕨麻熬粥,以此来提高免疫力和抗缺氧能力,且效果显著。目前,对于蕨麻的研究大多集中在成分提取、品种选育及药用价值等方面,较少有在分子水平上的研究报道[2-3,6-7]。2022年5月Tang等[8]对蕨麻叶绿体全基因组完成了测序(NCBI接收号:MW174249.1),并分析了序列结构,而笔者在此基础上,对叶绿体中的微卫星进行进一步分析,为后续物种的品种鉴定、种质遗传多样性及序列引物设计等奠定基础。
叶绿体微卫星(chloroplast microsatellite)又称叶绿体SSR(chloroplast simple sequence repeats,cpSSR),分布在葉绿体上的长度不超过200 bp的简单重复序列,它既有微卫星含有较多遗传信息的特点[9],又具备了叶绿体基因组进化速率适中且稳定遗传的优点[10],常被用于物种进化水平、群体迁移等相关研究[11-12],因此被广泛应用。王崇等[13]利用cpSSR对104个甘薯品种成功构建了指纹图谱;韩岩[14]利用7对cpSSR引物对三七居群进行了遗传多样性分析,明确了居群之间的遗传性;李航等[15]用cpSSR和nSSR标记明确了地方柑橘“枳雀”的亲本和来源。cpSSR在种质资源的开发与利用、物种遗传、品种鉴定以及序列引物设计等方面都发挥着巨大用处。笔者利用NCBI数据库中下载的蕨麻叶绿体基因组数据,分析其微卫星序列的分布、组成、长度等特征,以期为后续蕨麻cpSSR遗传多样性研究以及引物序列设计研究提供信息。
1 材料与方法
1.1 试验材料
从NCBI的GenBank数据库下载蕨麻(Potentilla anserina)的叶绿体基因组完整序列数据和注释文件(NCBI接收号:MW174249.1)[8],分别以.fasta和gb格式保存。
1.2 试验方法
使用REPuter[16]在线软件,参数设置如图1所示,分析蕨麻叶绿体基因组中的序列,对各散在重复序列位点所处的基因位置等分布信息进行分析;使用MISA(MIcroSAtellite identification tool,MISA,https://webblast.ipk-gatersleben.de/misa/)[17]分析蕨麻叶绿体基因组中的序列,设置参数:单碱基重复次数为12次以上,二碱基重复次数为6次以上,三碱基重复次数为4次以上,四碱基、五碱基以及六碱基重复次数都在3次以上。
2 结果与分析
2.1 蕨麻叶绿体基因组重复序列
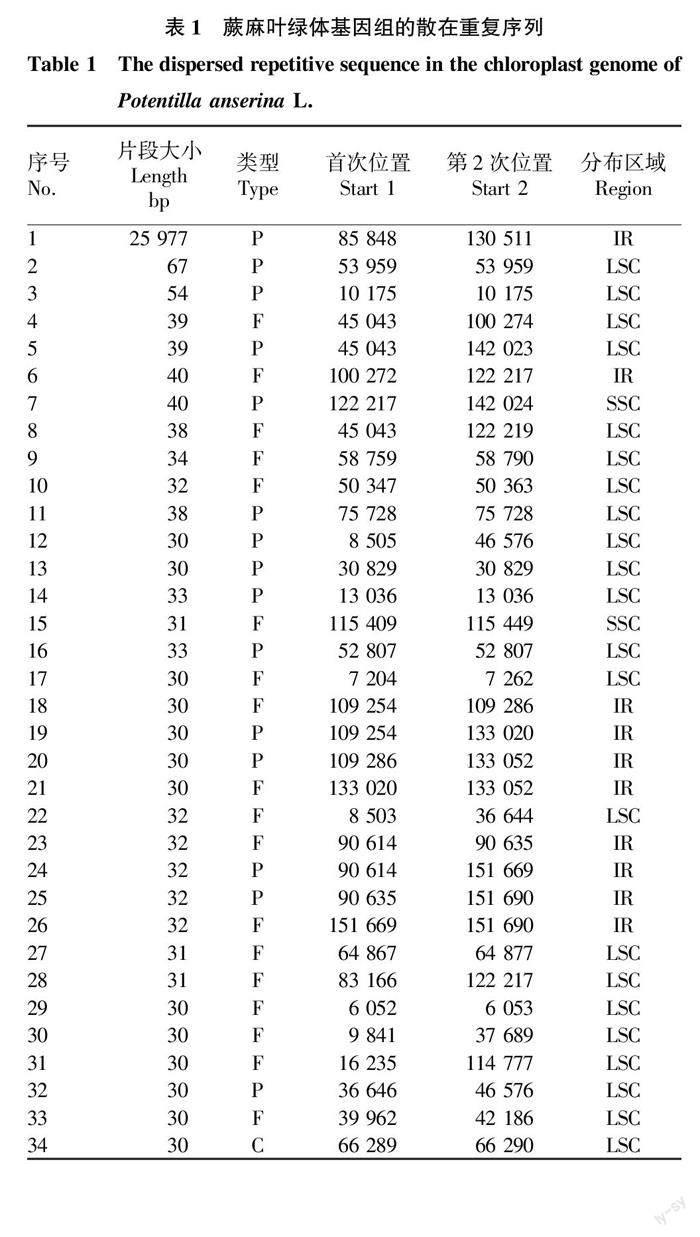
基于REPuter程序,检测到蕨麻叶绿体基因组上共有34个散在重复序列,分为Forward(F),Palindromic(P),Complement(C)3种类型,分别占比52.94%、44.12%和2.94%(表1)。
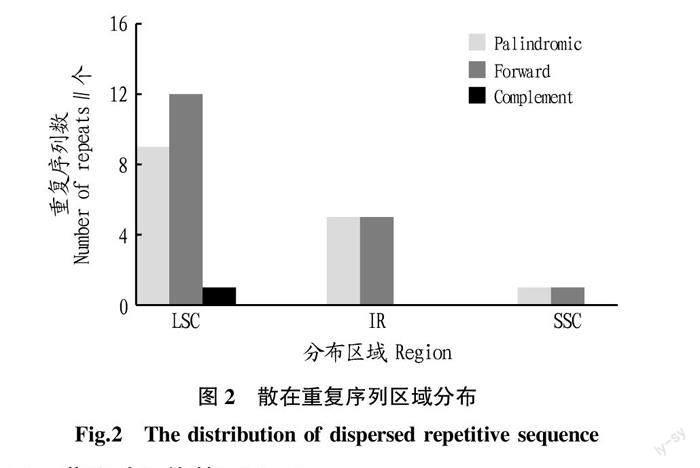
从图2可知,重复序列有22个在LSC区,占比64.71%;IR区有10个,占比29.41%;SSC区只有2个,占比5.88%。Palindromic在LSC区、IR区、SSC区分别有9、5和1个,Forward分别有12、5和1个;Complement在SSC区和IR区没有分布,只在LSC区分布有1个。可见,重复序列虽然在3个区域都有分布,但分布不均匀。
2.2 蕨麻叶绿体基因组SSR
2.2.1 SSR位点分布。
使用MISA识别蕨麻叶绿体基因组中的SSR位点,结果显示,在总长为156 488 bp的叶绿体基因组中,共检测出86个SSR位点(不含复合型的位点,若将其考虑在内,则共有92个SSR位点),总长为1 030 bp,占总基因组的0.66%,分布广泛,从177~155 708 bp均有分布,平均每1 820 bp出现1个SSR位点。其中,在LSC区、SSC区以及IR区分别分布有825、113和92 bp,分别占比80.10%、10.97%和8.93%。分析SSR数量比例结果显示(表2),蕨麻中SSR主要分布在LSC区,其次为SSC区,IR区分布最少。
2.2.2 SSR碱基组成与丰度。
在蕨麻叶绿体SSR中,单碱基重复基序最多,有74个为单碱基,占总重复的80.43%,主要基序组成是A和T,分别有27个(36.49%)和45个(60.81%),以C和G为基序的只有2个,仅占2.7%。其次为四碱基,有8个,占总重复的8.70%,其中以AAAT/ATTT基序最多,占比50%。二碱基和三碱基的数量相同,均为5个,分别占5.43%,主要以A和T基序组成,不含G和C。SSR中未发现五碱基基序及以上碱基序列组成。通过计算,所有类型的SSR中,单碱基丰度最高,为482.45个/Mb;最低为二碱基和三碱基,均为35.50个/Mb(表3)。
2.2.3 SSR长度与基序拷贝数分布。
由图3可知,蕨麻叶绿体微卫星长度平均为12 bp,最长为18 bp,最短为10 bp,12 bp的SSR数量最多,有24个,占比27.91%;其次为长度为10 bp的SSR数量,有21个,占比24.42%;最少为16和18 bp,分别仅有1个,占比1.16%。
蕨麻叶绿体微卫星拷贝数3~18不等,基序越长,则拷贝数越少,序列数也越少(图4)。单碱基拷贝数10~18均有分布,范围最大,序列数随着拷贝数的增大而减少,重复序列最多的是拷贝数为10的序列,共有22个(29.73%);拷贝数为18的序列最少,仅有1个(1.35%)。二碱基拷贝数范围比较窄,仅有6和7次拷贝,各有4和1个重复序列。三碱基和四碱基中拷贝数分别为4和3。从图4可看出,拷贝数与序列数量呈负相关。
3 讨论与结论
使用REPuter程序检测出蕨麻叶绿体基因组中有34个散在重复序列,大部分分布在LSC区(22个),而分布在IR
区(10个)的比分布在SSC区(2个)多,可能为进化过程中,为了提高遗传效率,生物体保留较少,但重要的遗传信息已达到高效遗传的目的[18],因此在IR区的分布比在SSC区更多。
使用MISA软件在总长为156 488 bp的蕨麻叶绿体基因组检测出中有86个叶绿体微卫星,平均每1 820 bp出现1个微卫星,分布密度为576个/Mb。相对于其他植物,如狗枣猕猴桃(A.kolomikta)中平均每3 840 bp出现1个,分布密度273个/Mb[19];小党参(C.minima)中平均每5 839 bp出现1个,分布密度180个/Mb,以及秦岭党参(C.tsinlingensis)中平均每4 601 bp,分布密度228个/Mb出现1个[20],蕨麻中叶绿体微卫星数量仍占优势。
蕨麻cpSSR主要以单碱基为主,重复基序越长,数量越少,这与序列的稳定性有关[21]。分析SSR基序发现,主要以单碱基为主,尤其以A/T基序最多。在其他碱基重复类型中同样以基序A和T最多。研究发现[22-23],植物叶绿体基因组中的CpG甲基化极和T进行转化,从而使G和C含量变少,而A和T基序变多,同时,热力学的稳定也需要较少的GC含量来维持。蕨麻叶绿体基因组中,单碱基A/T基序占比97.30%;二碱基和三碱基中都是以基序A和T组成,而四碱基中只有2个含有基序C和G,其他都是基序A和T。紫花凤梨(Tillandsia cyanea)[24]、蝴蝶兰(Phalaenopsis aphrodite)[25]、丹参(Asparagus officinalis)[26]等植物均以单碱基重复序列为主,且基序A和T为主要组成。
蕨麻叶绿体微卫星长度平均为12 bp,长度为12 bp的重复序列数最多,其次为10 bp,二者共有45个,占比52.33%。长度大于15 bp的只有4个,占比仅为4.65%。说明长度越长,微卫星丰度呈反向趋势。吴东洋等[19]研究认为,基序长度的变化可以反映出微卫星序列失去或获得重复基元的速率。一般认为,当基序长度大于等于20 bp时,序列具有较好的多态性[27]。该研究中蕨麻叶绿体SSR长度平均只有12 bp,且都在20 bp以下,这与微卫星变异速率有关[19]。
微卫星长度与其选择压力呈正相关,与拷贝数呈负相关。因此,在中长短长度的微卫星中,其选择压力较少,拷贝数越多,因而变异速率也更为快速,更倾向于扩张[28];长度较长的微卫星拷贝数较少,自身相对稳定,变异速率也就相应降低。
叶绿体微卫星有进化速率慢、稳定且分子量小的优点,可以为植物进化速率研究等提供便利条件,因此,掌握物种中微卫星的特征是前提。该研究分析蕨麻中叶绿体微卫星的特征,可以为后续微卫星引物开发奠定基础,为蕨麻种质图谱构建、分子育种及品种鉴定等方面的研究提供理论基础。
参考文献
[1] 李军乔,蔡光明,李灵芝.中国蕨麻[M].北京:科学出版社,2020:1-4
[2] 郭杰,王吉鸿,贾国军,等.蕨麻化学成分及药理活性研究[J].现代盐化工,2022,49(3):37-39.
[3] 谭亮,李军乔,李玉林,等.青海不同产地蕨麻营养成分分析及品质评价[J].食品与生物技术学报,2022,41(1):95-111.
[4] 刘素君,李世元,宋九华,等.鹅绒委陵菜多糖抗肿瘤作用研究[J].中国现代应用药学,2011,28(3):185-188.
[5] CHEN J R,YANG Z Q,HU T J,et al.Immunomodulatory activity in vitro and in vivo of polysaccharide from Potentilla anserina[J].Fitoterapia,2010,81(8):1117-1124.
[6] 张玲.蕨麻的化学成分及其皂苷类成分拮抗顺铂肾脏毒性的研究[D].苏州:苏州大学,2018.
[7] 闵光宁,贺志云,闵光涛,等.藏药蕨麻有效成分的降糖作用及作用机理的初步研究[Z].2017.
[8] TANG C Y,LI X Z,CHEN J B,et al.Characterization and phylogenetic relationship of the complete chloroplast genome of a Chinesetraditional medicinal plant Potentilla anserina L.[J].Mitochondrial DNA part B,2022,7(9):1653-1655.
[9] GINWAL H S,SHARMA R,CHAUHAN P,et al.Chloroplast microsatellites reveal genetic diversity and population structure in natural populations of Himalayan Cedar (Cedrus deodara (Roxb.) G.Don) in India[J].Silvae Genet,2020,69(1):86-93.
[10] LI B,LIN F R,HUANG P,et al.Complete chloroplast genome sequence of Decaisnea insignis:Genome organization,genomic resources and comparative analysis[J].Sci Rep,2017,7:1-10.
[11] 鄭鹏丽,程建如,周明芹.濒危植物对节白蜡遗传多样性的cpSSR分析[J].西南农业学报,2020,33(7):1399-1403.
[12] 赵月梅,杨振艳,赵永平,等.木犀科植物叶绿体基因组结构特征和系统发育关系[J].植物学报,2019,54(4):441-454.
[13] 王崇,王连军,杨新笋,等.104个甘薯品种的cpSSR指纹图谱构建及遗传多样性分析[J].热带作物学报,2021,42(6):1549-1556.
[14] 韩岩.基于cpDNA分子标记的三七居群遗传多样性研究[D].昆明:昆明理工大学,2018.
[15] 李航,杨晓明,丁德宽,等.基于cpSSR和nSSR标记的地方柑橘资源‘枳雀亲本分析[J].果树学报,2018,35(10):1161-1169.
[16] KURTZ S,CHOUDHURI J V,OHLEBUSCH E,et al.REPuter:The manifold applications of repeat analysis on a genomic scale[J].Nucleic Acids Res,2001,29(22):4633-4642.
[17] BEIER S,THIEL T,MüNCH T,et al.MISA-web:A web server for microsatellite prediction[J].Bioinformatics,2017,33(16):2583-2585.
[18] 梁璇,李鵬,许冬梅,等.紫苏叶绿体全基因组特征分析[J].山西农业科学,2021,49(3):265-272.
[19] 吴东洋,业宁,徐逸卿,等.狗枣猕猴桃叶绿体基因组微卫星特征分析[J].北方园艺,2018(9):30-35.
[20] 张丹,杜晨晖,裴香萍,等.党参线粒体和叶绿体微卫星标记的开发及应用[J].中国实验方剂学杂志,2021,27(23):153-162.
[21] 曲桑卓玛,田甜,李文麒,等.青甘韭cpSSR序列特征分析[J/OL].分子植物育种,2022-11-04[2022-11-05].http://kns.cnki.net/kcms/detail/46.1068.S.20221104.1542.005.html.
[22] 乔雨,石凤翎,张雨桐,等.蒙农红豆草花瓣转录组微卫星SSR特征分析[J].西北农林科技大学学报(自然科学版),2020,48(12):9-17.
[23] 任延靖,邵登魁.芜菁叶绿体基因组结构与进化关系分析[J].种子,2022,41(2):59-64,75.
[24] 金亮,葛亚英,李小白,等.紫花凤梨叶绿体基因组微卫星特征分析[J].分子植物育种,2022,20(20):6811-6817.
[25] 张君毅.蝴蝶兰叶绿体DNA微卫星分析与标记开发[J].江西农业学报,2011,23(12):31-33,37..
[26] 钱俊.丹参的叶绿体和线粒体基因组研究[D].北京:北京协和医学院,2014.
[27] TEMNYKH S,DECLERCK G,LUKASHOVA A,et al.Computational and experimental analysis of microsatellites in rice (Oryza sativa L.):Frequency,length variation,transposon associations,and genetic marker potential[J].Genome research,2001,11(8):1441-1452.
[28] XU X,PENG M,FANG Z A,et al.The direction of microsatellite mutations is dependent upon allele length[J].Nat Genet,2000,24(4):396-399.
