管叶槽舌兰新鲜及硅胶干燥根样内生菌多样性研究
2023-07-17张镇梁王美娜李健李素珍段晓娟乔琦
张镇梁 王美娜 李健 李素珍 段晓娟 乔琦

摘 要: 管葉槽舌兰(Holcoglossum kimballianum)是一种珍稀濒危兰科植物,其野生种群亟需保护。内生菌对兰科植物的生长发育至关重要,为评估管叶槽舌兰内生菌的多样性、分析采样方式对其内生菌的影响,该文采用高通量测序技术对迁地保育状态下新鲜与硅胶干燥的管叶槽舌兰根内生菌进行研究。结果表明:(1)新鲜及干燥管叶槽舌兰根内生菌物种组成明显不同,管叶槽舌兰内生真菌注释到6门46科51属,内生细菌注释到15门105科178属;干燥后管叶槽舌兰根内生真菌注释到6门88科116属,内生细菌注释到21门154科336属。(2)迁地保育状态的管叶槽舌兰根样内生菌具有丰富的多样性,并且内生细菌群落丰富度和多样性远比内生真菌群落高;经硅胶干燥后,内生真菌α多样性指数升高、β多样性指数降低,而内生细菌的α多样性指数降低、β多样性指数则升高。(3)差异显著性真菌黄盖小脆柄菇(Psathyrella candolleana)和刺盘孢属(Colletotrichum)的C. tofieldiae只存在于新鲜根样中,新鲜管叶槽舌兰差异显著性细菌是马赛菌属(Massilia),干燥根样中差异显著性细菌类群包括拜叶林克氏菌科(Beijerinckiaceae)、黄色杆菌科(Xanthobacteraceae)及慢生根瘤菌属(Bradyrhizobium)。(4)共发生网络分析显示,经干燥后管叶槽舌兰根样内生菌群落中占互作主导地位的优势物种和互作模式都发生了改变。综上认为,不同采样处理会影响管叶槽舌兰根内生菌的群落结构,在研究兰科植物根样内生菌时宜使用新鲜的根样。该研究结果为管叶槽舌兰野生种群保护及人工栽培提供了内生菌数据基础,也为兰科植物内生微生物采样方法提供了参考。
关键词: 管叶槽舌兰, 内生真菌, 内生细菌, 新鲜, 硅胶干燥, 多样性
中图分类号: Q93-33文献标识码: A文章编号: 1000-3142(2023)06-0991-15
Diversity study of endophytic communities in fresh and silica gel-dried root samples of Holcoglossum kimballianum (Orchidaceae)
ZHANG Zhenliang1,2, WANG Meina2, LI Jian2, LI Suzhen2, DUAN Xiaojuan2, QIAO Qi1*
( 1. Agricultural College/Peony College, Henan University of Science and Technology, Luoyang 471023, Henan, China; 2. Orchid
Conservation & Research Center of Shenzhen and the National Orchid Conservation Center of China, Shenzhen Key Laboratory
for Orchid Conservation and Utilization, Key Laboratory of National Forestry and Grassland Administration
for Orchid Conservation and Utilization, Shenzhen 518114, Guangdong, China )
Abstract: Holcoglossum kimballianum is a rare and endangered orchid, and its wild populations are in urgent need of conservation. Endophytic fungi and bacteria are important to the growth and development of orchids. In order to assess the diversity of H. kimballianum endophytes and the impact of sampling methods on the endophytes, high-throughput sequencing technology was used to study the diversity of endophytes in fresh and silica gel-dried roots of H. kimballianum in ex-situ conservation. The results were as follows: (1) The species compositions of endophytic fungi and endophytic bacteria were distinctly different in fresh and silica gel-dried roots of H. kimballianum. There were total of 6 phyla 46 families 51 genera of endophytic fungi and 15 phyla 105 families 178 genera of endophytic bacteria annotated in the roots of the H. kimballianum. After silica gel-dried, the endophytic fungi of the H. kimballianum had total of 6 phyla, 88 families, 116 genera, and the endophytic bacteria had total of 21 phyla, 154 families, 336 genera. (2) Endophytes in the roots of H. kimballianum in ex-situ conservation were of richness and diversity of endophytic bacterial community was much higher than that of endophytic fungal community. After silica gel-dried, the α diversity indices of endophytic fungi increased and the β diversity indices decreased, while the α diversity indices of endophytic bacteria decreased and the β diversity indices increased. (3) Significantly different fungi Psathyrella candolleana and Colletotrichum tofieldiae only existed in the endophytic fungal communities of fresh roots. The significantly different bacteria in roots of fresh Hocoglossum kimballianum was Marseilla, and the significantly different bacteria in the silica gel-dried roots included Beijerinckiaceae, Xanthobacteraceae and Bradyrhizobium. (4) Co-occurrence network analysis revealed that the dominant species and interaction patterns in the endophytic communities of the roots of Hocoglossum kimballianum were changed after silica gel-dried. In summary, different sampling treatments can affect the community structure of the endophytes in the roots of H. kimballianum, and it is advisable to use fresh root samples when studying the endophytes of orchids. The results provide an endophytic data basis for wild populations conservation and artificial cultivation of H. kimballianum, and also provide a reference for sampling methods of endophytic microorganisms in orchids.
Key words: Holcoglossum kimballianum, endophytic fungi, endophytic bacteria, fresh, silica gel-dried, diversity
生态系统中,植物与大量微生物相互作用,这些微生物在地下和地上植物器官的内部和外表面都有定殖(Compant et al., 2019;Escudero et al., 2019),这些与植物相关的微生物群落统称为植物微生物群(Marchesi et al., 2015)。细菌和真菌是植物微生物群的主要组成部分,它们对植物微生态系统的平衡起到重要作用。植物中的内生菌是指其生活史的一定阶段或全部阶段,生活于健康植物中的各种组织和器官的细胞间隙或细胞内的菌类。内生真菌对兰科植物非常重要,兰科菌根真菌属于内生真菌,它们是兰科植物生长发育各个阶段不可或缺的关键因素,能直接参与兰科植物根系甚至整个植株的生理代谢活动,从而保障兰科植物的生长、个体间竞争以及对病原体的防御(盖雪鸽等,2014;Li et al., 2021)。高越等(2019)从手参(Gymnadenia conopsea)根系中分离出角担菌属(Ceratobasidium),将该菌株与手参种子进行共培养,发现它能明显促进手参种子原球茎的形成且最终分化成幼苗。杨文科(2020)通过迁地共生萌发从白旗兜兰(Paphiopedilum spicerianum)原球茎中分离出胶膜菌属(Tulasnella),它能有效促进其种子萌发直到幼苗阶段。这都表明内生真菌在兰科植物的生长发育中具有极大的促进作用。据不完全统计,已报道的常见兰科植物菌根真菌有69属,分别隶属于担子菌门(Basidiomycota)、子囊菌门(Ascomycota)及毛霉门(Mucoromycota)的50科(王美娜等,2021)。
此外,兰科植物的内生菌中还存在大量有益的内生细菌,这些有益的内生细菌对兰科植物的生长发育也发挥着积极的促进作用,Tsavkelove等(2007)研究表明内生细菌能促进兰科植物种子萌发、光合形态建成、缓解非生物胁迫及生长发育等。目前,關于兰科植物根部细菌结构和功能的认知还非常有限(Kaur et al., 2021 )。从兰科植物中分离出的细菌通常属于变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和厚壁菌门(Firmicutes),不同的内生细菌类群对兰科植物具有不同程度的促进作用,Faria等(2013)研究发现,类芽孢杆菌属(Paemibacillus)能促进Cattleya loddigesii 幼苗的生长。从兰属(Cymbidium sp.)根中分离出的根瘤菌属(Rhizobium)能溶解磷酸钙。此外,Tarkka等(2008)研究表明,兰科植物菌根中存在菌根辅助细菌(mycorrhiza helper bacteria),能与菌根真菌特异性结合,刺激菌根真菌的孢子萌发和菌丝生长,促进菌根真菌在宿主植物中定殖和生长,加强菌根化,从而促进植物生长及增强抗逆性(陈耀丽等,2019;Wang et al., 2021)。因此,加强兰科植物内生细菌的研究,在兰科植物的相关微生物研究中显得非常重要。
管叶槽舌兰(Holcoglossum kimballianum)隶属于兰亚科(subfamily Orchidoideae)万代兰族(tribe Vandeae)槽舌兰属(Holcoglossum),分布在中国的云南以及缅甸、泰国,常附生在山地林中的树干上,海拔一般在1 000 m以上,具有较高的观赏价值,濒危等级为EN(濒危),其野生种群亟需保护。目前,对管叶槽舌兰的研究主要集中在系统发育、生物地理学和细胞学等方面,对其根部内生菌的研究鲜有报道。另外,Harrison等(2016)针对植物内生微生物的研究在采样时为方便野外作业经常采用硅胶干燥的方法,这有可能会引起根内微生物群落的极大变化。因此,本研究采用ITS和16S高通量测序技术的方法,对管叶槽舌兰新鲜及硅胶干燥根样中的内生真菌和内生细菌群落进行研究,拟探讨:(1)管叶槽舌兰根样内生菌类群的多样性;(2)管叶槽舌兰新鲜根样与干燥根样中内生菌群落的差异;(3)管叶槽舌兰根样内生细菌和真菌的比较。本研究为管叶槽舌兰的种植及种质资源保护提供了内生真菌和细菌方面的数据,同时为研究兰科植物根内微生物提供采样处理的依据。
1 材料与方法
1.1 样品采集和预处理
在深圳市兰科植物保护研究中心,采集迁地保护状态下的管叶槽舌兰生长健康的根,在不影响管叶槽舌兰正常生长的情况下,每个样品取3~5条长2~5 cm的根段,尽量由3株以上的管叶槽舌兰根样组成,采集的同一组根样分别做新鲜及干燥根样的预处理。新鲜根样预处理在根段取材后即刻进行,步骤如下:用流水冲洗根表面后,用5%次氯酸钠和75%酒精依次消毒2 min,加入无菌水,洗净弃废液,将预处理后得到的最后一次无菌水进行DNA提取和风险建库测试,未得到任何结果表明样品得到了很好的预处理。将新鲜根样置于-80 ℃冰箱以备提取微生物组DNA。将干燥根样在预处理后放入硅胶中干燥72 h,备用。每个处理重复8次。
1.2 根内微生物组DNA提取、PCR扩增、文库构建及HiSeq测序
使用QIAGEN PowerLyzer试剂盒对根内微生物组DNA进行提取。内生真菌选择带Barcode的特异引物(ITS5-1737F: GGAAGTAAAAGTCGTAACAAGG和ITS2-2043R:GCTGCGTTCTTCATCGATGC),内生细菌选择带Barcode的特异引物(fM1:CCGCGTGNRBGAHGAAGGYYYT和rC5:TAATCCTGTTTGCTCCCCAC)进行PCR扩增(Bellemain et al., 2010;Yu et al., 2013)。反应程序:98 ℃预变性1 min;进入30个扩增循环[98 ℃ 10 s,50 ℃(真菌)、55 ℃(细菌)30 s,72 ℃ 30 s];72 ℃延伸5 min。反应体系(30 μL):2 × Phusion Master Mix(New England Biolabs)15 μL,Primer(2 μmol·L-1)3 μL,gDNA 10 ng,补充H2O至30 μL。使用2%浓度的琼脂糖凝胶进行电泳检测,PCR产物胶回收纯化后使用TruSeq DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,利用Illumina HiSeq 2500 PE 250平台进行测序(北京诺禾致源生物科技有限公司)。
1.3 数据分析
测序数据截去Barcode和引物序列后,使用FLASH(Version 1.2.7)进行拼接,得到Raw Tags后使用fastp软件对Raw Tags进行过滤得到高质量的Clean Tags。参照Qiime(V1.9.1)的Tags质量控制流程和去除嵌合体处理后得到有效数据Effective Tags。利用Uparse软件(V 7.0.1001)以97%的一致性对所有样品的全部Effective Tags进行聚类得到OTUs,对出现频数最高的OTUs代表序列采用Qiime软件(V 1.9.1)中的Blast和Mothur方法与真菌数据库Unite和细菌数据库Silva进行物种注释分析,统计各样本的群落组成。以样本中数据量最少的为标准进行均一化处理后,基于Qiime软件计算α多样性指数及β多样性指数,并进行t-test差异显著性检验。利用R软件的VennDiagram包和Vegan包进行维恩图及无度量多维标定法(non-metric multi-dimensional scaling,NMDS)分析。为进一步挖掘分组样本间的差异显著性真菌和细菌类群,选用Metastat、LEfSe统计分析方法对分组样本的物种组成和群落结构进行差异显著性检验。对所有样品的相关性指数(斯皮尔曼相关系数SCC)进行计算后,用cutoff=0.6对相关系数的绝对值进行过滤,结合物种丰度构建共发生网络(Network)图。
2 结果与分析
基于Illumina HiSeq测序技术,从16个管叶槽舌兰根部ITS共获得2 834 046条有效Tags,有效Tags范围为164 665~187 236。从管叶槽舌兰根部16S共获得2 375 402条有效Tags,有效Tags范围为122 886~161 516。
2.1 内生菌群落物种组成和采样处理对其影响
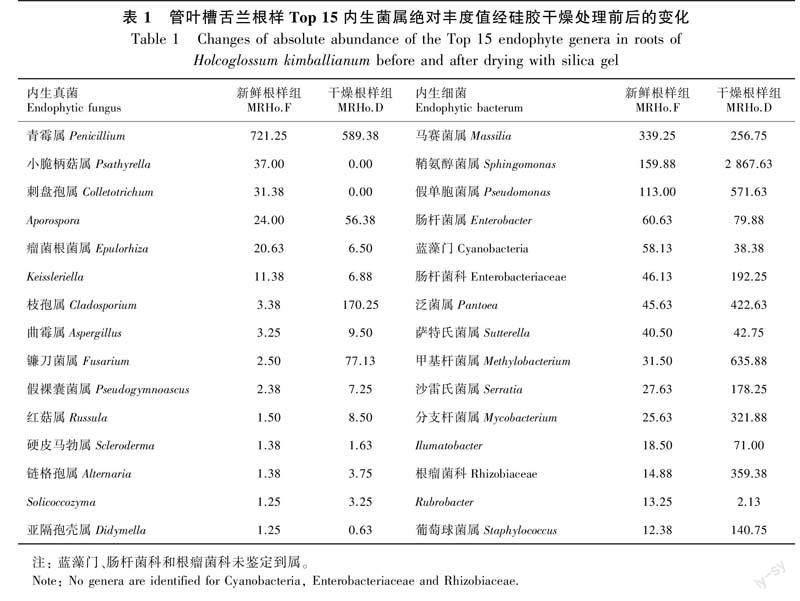
注释结果发现,新鲜管叶槽舌兰注释到的根内生真菌有6门46科51属,其中子囊菌门相对丰度为52.20%,担子菌门相对丰度为20.22%,球囊菌门(Glomeromycota)、罗兹菌门(Rozellomycota)、被孢霉门(Mortierellomycota)、毛霉门相对丰度在1%左右;而经硅胶干燥后的管叶槽舌兰注释到的根内生真菌有6门88科116属,其中子囊菌门相对丰度为57.84%,担子菌门相对丰度为3.68%,球囊菌门、被孢霉门、毛霉门、罗兹菌门的相对丰度在1%以下。在2个分组中,子囊菌门都占绝对优势。相比较而言,干燥后管叶槽舌兰根样内生真菌类群数量变多;新鲜管叶槽舌兰根样内生真菌群落中子囊菌门、球囊菌门占比低于硅胶干燥根样中的内生真菌群落,而兰科菌根真菌最多的担子菌门明显高于硅胶干燥根样中的内生真菌群落(图1:a)。经硅胶干燥后,管叶槽舌兰根内生真菌在科水平(图1:b)的相对丰度发生了改变,曲霉科(Aspergillaceae)在干燥后丰度明显降低,而枝孢霉科(Cladosporiaceae)在干燥后丰度明显升高,小丛壳科(Glomerellaceae)和胶膜菌科(Tulasnellaceae)的相对丰度在经硅胶干燥后的根样品中的丰度几乎为零。在属水平上(表1,图1:c),管叶槽舌兰根内生真菌的相对丰度发生了改变,青霉属(Penicillium)、Aporospora、瘤菌根菌属(Epulorhiza)经干燥后的丰度降低,而枝孢属(Cladosporium)、镰刀菌属(Fusarium)和Mycoacia在干燥后丰度明显升高,小脆柄菇属(Psathyrella)和刺盘孢属(Colletotrichum)的相对丰度经硅胶干燥后的丰度为零。从排名前15的硅胶干燥处理前后管叶槽舌兰根部内生真菌属水平绝对丰度值变化可以看出,青霉属、瘤菌根菌属、Keissleriella及亚隔孢壳属(Didymella)在干燥后丰度值降低,其余属如Aporospora、枝孢属、曲霉属(Aspergillus)、镰刀菌属、假裸囊菌属(Pseudogymnoascus)、红菇属(Russula)和链格孢属(Alternaria)等在干燥后丰度值增加,而小脆柄菇属和刺盘孢属在经硅胶干燥后的根部样品的丰度值为零。这与管叶槽舌兰根内生真菌在属水平的相对丰度变化趋势总体相似。
根据OTUs聚类结果(本文将未注释到的OTU包含在内一起计算,下同),绘制OTUs韦恩图(图1:g),结果显示新鲜管叶槽舌兰根样中内生真菌特有的OTUs有56个,主要是子囊菌门(16个OTUs)和担子菌门(12个OTUs);而经硅胶干燥后根样中内生真菌有123个特有OTUs,主要隶属于子囊菌門(47个OTUs),担子菌门仅有10个OTUs;2个分组共有的OTUs仅有61个,其中有21个OTUs属于子囊菌门,8个OTUs属于担子菌门。这表明干燥后的管叶槽舌兰根样中内生真菌群落在丧失掉新鲜根样中的一些真菌类群的同时,也产生了相当数量的新的真菌类群,这些新产生的真菌主要隶属于子囊菌门。
在内生细菌方面,新鲜管叶槽舌兰根内生细菌注释到15门105科178属,其中变形菌门相对丰度为18.21%,蓝藻门(Cyanobacteria)相对丰度为1.78%,厚壁菌门相对丰度为1.41%,放线菌门(Actinobacteria)相对丰度为1.14%,拟杆菌门(Bacteroidetes)、螺旋体门(Spirochaetes)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)的相对丰度低于1%;而经硅胶干燥后的管叶槽舌兰注释到的根内生细菌有21门154科336属,其中变形菌门相对丰度为48.71%,厚壁菌门(Firmicutes)相对丰度为8.31%,放线菌门相对丰度为5.67%,拟杆菌门(Bacteroidetes)相对丰度为3.41%,蓝藻门相对丰度为2.58%,螺旋体门、酸杆菌门、硝化螺旋菌门(Nitrospirae)、绿弯菌门的相对丰度低于1%(图1:d)。在2个分组中变形菌门丰度均占绝对优势。相比较而言,干燥后管叶槽舌兰根样内生细菌类群数量同样变多,经硅胶干燥后,占主要优势的变形菌门、厚壁菌门、放线菌门细菌相对丰度均有明显提高(图1:d)。管叶槽舌兰根内生细菌经硅胶干燥后在科水平(图1:e)的相对丰度发生了改变,鞘脂单胞菌科(Sphingomonadaceae)、拜叶林克氏菌科(Beijerinckiaceae)、肠杆菌科(Enterobacteriaceae)、红杆菌科(Rhodobacteraceae)、黄色杆菌科(Xanthobacteraceae)、假单胞菌科(Pseudomonadaceae)、瘤胃菌科(Ruminococcaceae)、根瘤菌科(Rhizobiaceae)等占比均明显升高,而伯克氏菌科(Burkholderiaceae)在干燥后明显降低。在属水平上(表1,图1:f),管叶槽舌兰根内生细菌的相对丰度发生了改变,鞘氨醇菌属(Sphingomonas)、假单胞菌属(Pseudomonas)、肠杆菌属(Enterobacter)、慢生根瘤菌属(Bradyrhizobium)、副球菌属(Paracoccus)和泛菌属(Pantoea)在干燥后丰度明显升高,而马赛菌属(Massilia)在干燥后明显降低。从排名前15的硅胶干燥处理前后管叶槽舌兰根内生细菌属水平绝对丰度值变化表中可以看出马赛菌属和Rubrobacter在干燥后丰度值降低,其余属如鞘氨醇菌属、假单胞菌属、肠杆菌属、泛菌属和分支杆菌属(Mycobacterium)等经干燥后丰度值都明显增加,这与管叶槽舌兰根内生细菌在属水平的相对丰度变化趋势相似。
根据OTUs聚类结果,绘制OTUs韦恩图(图1:h),结果显示新鲜管叶槽舌兰根样中内生细菌特有的OTUs有751个,主要是蓝藻门(33个OTUs);而经硅胶干燥后根样中内生细菌有579个特有OTUs,主要隶属于厚壁菌门(100个OTUs);2个分组共有的OTUs有532个,其中有127个OTUs属于变形菌门,50个OTUs属于蓝藻门,36个OTUs属于厚壁菌门,13个OTUs属于拟杆菌门,1个OTUs属于酸杆菌门,1个OTUs属于螺旋体门。通过结果分析表明,相对于真菌来说,管叶槽舌兰拥有更为丰富的内生细菌类群,同内生真菌一样,经硅胶干燥后,其内生细菌群落在丧失掉新鲜根样中的一些细菌类群的同时产生了相当数量的新的细菌类群,丧失的细菌主要隶属于蓝藻门,而新产生了大量的厚壁菌门。
2.2 内生菌群落多样性差异分析
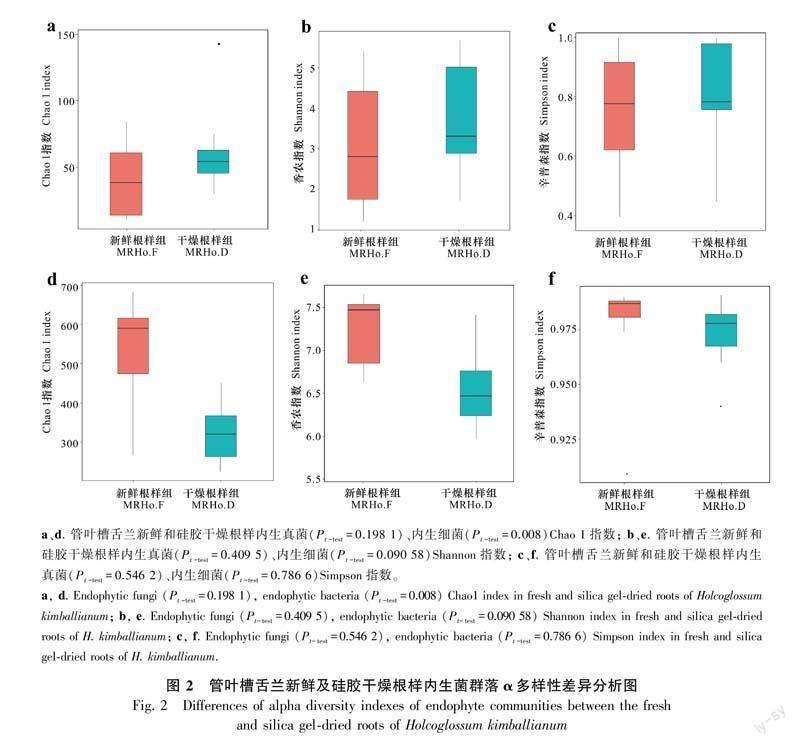
为对比新鲜与干燥管叶槽舌兰根样中的内生菌群落的丰富度和多样性,对2组样品内生菌群落的α多样性进行比较分析,包括Chao 1、Shannon、Simpson等指数,Chao 1是计算群落中含OTU数目的指数,常用来指示群落物种丰富度,Shannon和Simpson是综合考虑样本中物种的丰富度与均匀度指数,用来表示群落多样性。经分析发现,新鲜管叶槽舌兰根样中内生真菌群落的Chao 1指数、Shannon指数、Simpson指数分别为39.797、3.070、0.723;硅胶干燥后管叶槽舌兰根样中的内生真菌群落的Chao 1指数、Shannon指数、Simpson指数分别为62.348、3.715、0.785。新鲜管叶槽舌兰根样中内生真菌群落的Chao 1指数明显低于硅胶干燥后管叶槽舌兰根样中的内生真菌群落,新鲜管叶槽舌兰根样中内生真菌群落Shannon指数、Simpson指数略低于硅胶干燥后管叶槽舌兰根样中的内生真菌群落,水平相当。t-test检验表明,干燥前后3个α多样性指数均无显著性差异。这表明硅胶干燥前后管叶槽舌兰根样中的内生真菌群落多样性水平相当,但干燥后物种数量明显变多。新鲜管叶槽舌兰根样中内生细菌群落的Chao 1指数、Shannon指数、Simpson指数分别为524.492、7.103、0.976;硅胶干燥后管叶槽舌兰根样中的内生细菌群落的Chao 1指数、Shannon指数、Simpson指数分别为321.154、6.543、0.973。经硅胶干燥后管叶槽舌兰根样中的内生细菌群落Chao 1指数远低于新鲜管叶槽舌兰根样中内生细菌群落。新鲜管叶槽舌兰根样中内生细菌群落Shannon指数、Simpson指数高于硅胶干燥后管叶槽舌兰根样中的内生细菌群落。t-test检验表明,干燥前后3个α多样性指数除了Chao 1指数(Pt-test=0.008)外其他均无显著性差异。这表明硅胶干燥后管叶槽舌兰根样中的内生细菌群落物种数量和多样性明显减少。这一结果与管叶槽舌兰根样内生真菌群落的正好相反。
为研究新鲜与干燥管叶槽舌兰根样中的内生菌群落的差异程度,对2组样品内生菌群落的β多样性进行比较分析。基于Weighted Unifrac的β多样性分析发现,新鲜管叶槽舌兰根样中内生真菌的β多样性高于硅胶干燥后管叶槽舌兰根样中内生真菌群落的;而内生细菌基于Weighted Unifrac的β多样性分析发现,硅胶干燥后管叶槽舌兰根样中内生细菌群落的β多样性要高于新鲜管叶槽舌兰根样中内生细菌的,t-test检验发现,干燥前后β多样性指数无显著性差异。为进一步衡量硅胶干燥前后管叶槽舌兰根内生真菌与内生细菌群落间的差异,进行NMDS分析。基于Weighted Unifrac的NMDS分析发现,新鲜及干燥管叶槽舌兰根内生真菌与细菌群落具有明显分区。分析表明新鲜及干燥管叶槽舌兰根内生真菌与细菌群落的β多样性指数无显著性差异,而在物种组成上却具有明显不同。
2.3 差异显著性内生菌类群分析
为研究硅胶干燥前后管叶槽舌兰根样中内生真菌与细菌群落间是否具有显著性差异的物种,利用Metastat和LEfSe分析筛选具有显著性差异的物种。MetaStat分析表明,硅胶干燥前后,管叶槽舌兰根样中内生真菌群落的差异显著性真菌有担子菌门小脆柄菇属的黄盖小脆柄菇(Psathyrella candolleana)及子囊菌门刺盘孢属的Colletotrichum tofieldiae,这2个显著性差异物种只存在于新鲜管叶槽舌兰根样的内生真菌群落中(图4:a、b,表1);LEfSe分析发现,新鲜及干燥管叶槽舌兰根样均具有各自的差异显著性内生细菌类群。新鲜管叶槽舌兰根样的差异显著性内生细菌类群为马赛菌属,而干燥管叶槽舌兰根样的差异显著性内生细菌类群较多,在科和属水平上有拜叶林克氏菌科、黄色杆菌科及慢生根瘤菌属(图4:c、d)。
2.4 共发生网络(Co-occurrence Network)分析
对新鲜管叶槽舌兰根样中的内生真菌群落和硅胶干燥后管叶槽舌兰根样中的内生真菌群落进行共发生网络分析,结果显示新鲜管叶槽舌兰根样中内生真菌群落共发生网络中的物种主要分布在子囊菌门、担子菌门及Mortierellomycota。其中,占互作主导地位的优势属主要有瘤菌根菌属、假裸囊菌属(Pseudogymnoascus)、裂褶菌属(Schizophyllum)、假尾孢菌属(Pseudocercospora)、Vishniacozyma及Aporospora等(图5:a)。硅胶干燥后管叶槽舌兰根样中内生真菌群落共发生网络中的物种分布在子囊菌门、担子菌门、Mortierellomycot和毛霉门。其中,占互作主导地位的优势屬主要有Vishniacozyma、Stephanonectria、弯颈霉属(Tolypocladium)、小克银汉霉属(Cunninghamella)、Archaeorhizomyces及假霉样真菌属(Pseudallescheria)等(图5:b)。在内生细菌方面,新鲜管叶槽舌兰根样中内生细菌群落共发生网络中的物种主要分布在梭杆菌门(Fusobacteria)、厚壁菌门、放线菌门、蓝藻门、拟杆菌门、异常球菌-栖热菌门(Deinococcus-Thermus)、酸杆菌门和变形菌门。其中,占互作主导地位的优势属主要有:芽孢杆菌属、生丝微菌属(Hyphomicrobium)、不动杆菌(Acinetobacter)、梭杆菌属(Fusobacterium)、Psychroglaciecola、Parabacteroides、异常球菌属(Deinococcus)、双歧杆菌属(Bifidobacterium)等(图5:c)。硅胶干燥后管叶槽舌兰根样中内生细菌群落共发生网络中的物种则分布在厚壁菌门、放线菌门、装甲菌门(Armatimonadetes)、软壁菌门(Tenericutes)、拟杆菌门、蓝藻门、螺旋体门、纤维杆菌门(Fibrobacteres)、变形菌门、绿弯菌门、浮霉菌门(Planctomycetes)、酸杆菌门和栖热菌门。其中,占互作主导地位的优势属主要有热解糖梭菌属(Thermoanaerobacterium)、Mucilaginibacter、微球菌属(Micrococcus)、异常球菌属、Fimbriiglobus、Sphaerochaeta(图5:d)。
综上结果分析表明,同新鲜管叶槽舌兰根样中的内生菌群落相比,硅胶干燥后管叶槽舌兰根样的内生菌群落中占互作主导地位的优势物种、密切作用的菌类群、丰度及互作模式都发生了改变。同时,与内生真菌群落相比,无论是干燥前还是干燥后管叶槽舌兰根内生细菌共发生网络中密切互作的类群及节点均远远多于内生真菌群落,表明管叶槽舌兰根内生细菌群落具有比真菌更为活跃的相互作用。
3 讨论与结论
3.1 管叶槽舌兰的菌根真菌与菌根细菌
管叶槽舌兰根内生真菌主要隶属于子囊菌门、担子菌门、球囊菌门、毛霉门和Mortierellomycota。这一结果与前人研究的兰科植物根内生真菌群落结构的分析结果相同(蒋玉玲等,2018;艾叶等,2019)。本研究发现,新鲜管叶槽舌兰根样内占有较高丰度的曲霉科、小丛壳科和胶膜菌科,这3个真菌科被报道是兰科植物的菌根真菌科(Zelmer et al., 1996;Yuan et al., 2010),其中胶膜菌科是最常见的兰科植物菌根真菌科,与许多兰科植物形成广泛的菌根关系(Shao et al., 2020;Wang et al., 2022)。在属水平上,管叶槽舌兰根样内生真菌的优势属有青霉属、小脆柄菇属、刺盘孢属、Aporospora和瘤菌根菌属,这些真菌类群均被报道是兰科植物的菌根真菌(王美娜等,2021)。李明等(2006)采用根组织切片法调查碧玉兰(Cymbidium lowianum)的菌根真菌,初步鉴定包括青霉属、链霉属等。Yamato等(2005)对虎舌兰(Epipogium roseum)根内菌根真菌进行研究发现,优势属为小脆柄菇属和鬼伞属(Coprinus)。Chen等(2012)用分离培养和分子系统学方法对金钗石斛(Dendrobium nobile)和束花石斛(D. chrysanthum)根部内生真菌进行研究,发现刺盘孢属是两种石斛属的优势属。在金钗石斛、硬叶兜兰(Paphiopedilum wardii)和杏黄兜兰(P. armeniacum)的根中都分离到瘤菌根菌属,并将其回接到3种兰科植物的组培苗中,发现瘤菌根菌属能够促进无菌苗的生长,并且提高金钗石斛无菌苗的总生物碱和多糖的含量(陈晓梅等,2005;朱鑫敏等,2012)。Tan等(2012)从9种野生槽舌兰属植物的根内生真菌中分离出46株可培养的内生真菌,隶属于16属,包括链格孢属、枝孢属、瘤菌根菌属、镰刀菌属、刺盘孢属、亚隔孢壳属、Stephanonectria、Phomopsis、拟隐孢壳Cryptosporiopsis、Leptosphaeria、Pyrenochaeta、Clonostachys、Cosmospora、柱孢属Cylindrocarpon、Myrmecridium和Paraconiothyrium,其中9个属在本研究的管叶槽舌兰根样内生真菌中被注释到,表明本研究的管叶槽舌兰与同属植物中的内生真菌群落具有一定的相似性,瘤菌根菌属和镰刀菌属是9种野生槽舌兰属植物主要的内生真菌。由此推测,这些真菌类群是对管叶槽舌兰有益的菌根真菌。
管叶槽舌兰根内生细菌主要隶属于变形菌门、蓝藻门、厚壁菌门、放线菌门、拟杆菌门、螺旋体门、酸杆菌门和绿弯菌门。其中,变形菌门、厚壁菌門、蓝藻门和放线菌门等是最为常见的兰科植物内生细菌门,变形菌门有利于生长素的合成(Tsavkelova et al., 2007a)。Tsavkelova等(2003)在蝴蝶兰(Phalaenopsis aphrodite)、杓唇石斛(Dendrobium moschatum)和短序脆兰(Acampe papillosa)中都分离出的兼顾固氮性和光合作用的蓝藻门,厚壁菌门中的芽孢杆菌属能防止叶斑病,促进种子的萌发和植株生长,减少幼苗坏死(程萍等,2008; White et al., 2014)。在蝴蝶兰(Girija et al., 2018)和铁皮石斛(Yu et al., 2013)中均有报道螺旋体门和绿弯菌门,但其丰度较低。本研究发现,新鲜管叶槽舌兰根样内丰度较高的伯克氏菌科在干燥后的根样中丰度明显下降。Galdiano等(2011)从Cattleya walkeriana中分离出的肠杆菌科和伯克氏菌科等细菌发现,它们能促进生长并提高植株的存活率。在属水平上,管叶槽舌兰根样内生细菌的优势属主要有马赛菌属、鞘氨醇菌属、假单胞菌属、肠杆菌属和泛菌属,马赛菌属不仅能合成各种次级代谢产物和酶,还有溶磷、降解菲和耐受重金属等功能(Zheng et al., 2017;杨恩东等,2019)。鞘氨醇菌属、假单胞菌属和肠杆菌属是许多兰科植物的优势菌,Tsavkelova等(2007)将杓唇石斛根部分离的鞘氨醇菌属接种于杓唇石斛种子发现,鞘氨醇菌属极大提高了种子萌发率;鞘氨醇菌属还能固定氮,并增加幼苗的生长和生物量(Yang et al., 2014)。假单胞菌属被报道是Pterostylis vittata根系的优势属,可以产生激素来促进植物吸收营养物质(Wilkinson et al., 1989;黄腾飞,2012),并有助于真菌在植株根部的定殖,促进兰花菌根的形成(张萍和宋希强,2012)。童文君等(2014)对美花石斛(Dendrobium loddigesii)内生细菌进行分离鉴定发现,肠杆菌属为优势属。
综上所述,结合前人研究及本文结果推测,青霉属、小脆柄菇属、刺盘孢属和瘤菌根菌属等内生真菌是管叶槽舌兰的菌根真菌;而马赛菌属、鞘氨醇菌属、假单胞菌属、肠杆菌属等可能是管叶槽舌兰的“菌根细菌”。这些优势菌群可能在管叶槽舌兰的种子萌发、生长发育过程中起着重要的作用,在今后的研究中,可重点关注这些内生菌类群分离培养,及其与管叶槽舌兰的互利共生机理研究。
3.2 管叶槽舌兰根内生菌类群与多样性水平
管叶槽舌兰的根样内生真菌中共得到117个OTUs,Jacquemyn等(2016)采用454测序平台对火烧兰属(Epipactis)3个物种根内真菌进行研究共得到105个OTUs,3个物种OTUs范围为42~58,OTUs数量低于本研究管叶槽舌兰根内真菌OTUs的数量。Park等(2018)基于454测序平台对虾脊兰属(Calanthe)6个物种的根内真菌进行研究,在每个样本中得到的OTUs数量范围为22~57,远低于本研究OTUs数量的水平。本研究中,管叶槽舌兰根内真菌群落的α多样性指数Chao 1为39.797,Shannon指数为3.070,Simpson指数为0.723。Zeng等(2021)用Illumina MiSeq平台对白芨(Bletilla striata)、黄花白芨(B. ochracea)和小白芨(B. formosana)3种白芨属植物的根内真菌研究发现,内生真菌群落的α多样性指数Chao 1分别为94、73、39;Shannon指数为2.35、1.76、1.89;Simpson指数为0.26、0.32、0.30。本研究中,管叶槽舌兰根内真菌群落的Shannon指数和Simpson指数均高于3种白芨属兰科植物根内真菌群落的多样性水平,但它们的Chao l指数要比本研究中管叶槽舌兰根内真菌群落的高。Tan等(2012)基于分离培养和ABI 3730测序平台对9种野生槽舌兰属植物的根内生真菌研究发现,9种野生槽舌兰属植物的内生真菌Shannon多样性指数最高的是在短距槽舌兰(Holcoglossum flavescens)中(为1.913),野生管叶槽舌兰Shannon多样性指数是0.993 8,最低的是舌唇槽舌兰(H. lingulatum)(为0.950 3),本研究中的管叶槽舌兰根内真菌群落的Shannon指数均高于9种野生槽舌兰属植物根内真菌群落的多样性水平。通过分析表明,迁地保育状态的管叶槽舌兰有着与野生管叶槽舌兰和其他野生兰科植物相当的内生真菌数量或多样性水平。
管叶槽舌兰的根样中内生细菌共得到1 283个OTUs、Chao 1指数为524.492、Shannon指数为7.103、Simpson指数为0.976,吴庆珊等(2018)从3个样地金钗石斛(Dendrobium nobile)的根茎叶中共分离出1 082株内生细菌,可分为41个OTUs,共有OTUs有14个;陈泽斌等(2016)基于16S高通量测序从白芨中获得48个OTU,数量远低于本研究管叶槽舌兰根内细菌OTUs的数量。Ou等(2017)采用基于16S rRNA和nifH基因的元基因组焦磷酸测序技术,对中国5个地区的铁皮石斛相关菌群和重氮化菌群进行了研究,结果发现其OTUs范围在597~3 023之间,Shannon指数范围为4.35~6.49。相比较而言,本研究所得到的管叶槽舌兰根内细菌OTUs的数量处于中间水平,Shannon指数高于铁皮石斛的Shannon指数。谢泰祥等(2020)采用高通量测序技术分析福州鼓山野生建兰(Cymbidium ensifolium)根样内生细菌发现,建兰根内细菌群落的α多样性Chao 1指数为700.99、Shannon指数为6.10、Simpson指数为0.95,本研究中的管叶槽舌兰根内细菌群落的Chao l指数与野生建兰Chao l指数相当,Shannon指数及Simpson指数则是高于建兰的根内细菌群落。这表明迁地保育状态的管叶槽舌兰有着与其他野生兰科植物相媲美的内生细菌的丰富度和多样性水平。
3.3 新鲜样品与干燥样品对研究内生菌群落的影响
在处理微生物组样品时,如何减少从样品采集到预处理再到储存的过程中原始微生物群落的变化至关重要(Kim et al., 2017)。本研究对比了管叶槽舌兰新鲜与干燥根样中内生菌群落的变化。从新鲜管叶槽舌兰注释到根内生真菌有6门46科51属共117个OTUs,注释到根内生细菌15门105科178属共1 283个OTUs;而经硅胶干燥后的管叶槽舌兰注释到的根内生真菌有6门88科116属184个OTUs,注释到根内生细菌21门154科336属共1 111个OTUs,新鲜样品与干燥样品根部内生菌群落物种构成相差非常大。对管叶槽舌兰新鲜根样与干燥根样中内生菌群落进行α多样性与β多样性、共发生网络等分析发现,与新鲜根样相比干燥后的管叶槽舌兰根内生菌群落的OTUs数量、物种类群及丰度、α多样性、β多样性及互作模式均发生了改变。
本研究还发现,在新鲜根样中的菌根真菌类群如小丛壳科和胶膜菌科,它们在干燥根样中的相对丰度几乎为零。在属水平上,青霉属、瘤菌根菌属、Keissleriella及亚隔孢壳属在干燥后丰度值降低,而枝孢属、曲霉属、镰刀菌属、假裸囊菌属、红菇属和链格孢属等在干燥后丰度值增加。差异显著性物种分析也发现在两种采样处理中具有显著差异的担子菌门小脆柄菇属的黄盖小脆柄菇和子囊菌门刺盘孢属的Colletotrichum tofieldiae仅存在于新鲜管叶槽舌兰根样中的内生真菌群落。由此推测,瘤菌根菌属、镰刀菌属、小脆柄菇属和刺盘孢属是管叶槽舌兰的益生真菌。管叶槽舌兰菌根真菌在干燥的根样中丰度下降或消失的原因可能是管叶槽舌兰的菌根真菌对宿主有一定的依赖性,健康生长的管叶槽舌兰可为其菌根真菌提供养分以供其生长,而当宿主死亡后,这些菌根真菌失去营养来源而逐渐死亡。
在内生细菌方面,马赛菌属和Rubrobacter在干燥后丰度值降低,而鞘氨醇菌属、假单胞菌属、肠杆菌属、泛菌属和分支杆菌属等经干燥后丰度值都明显增加。这些细菌可能在干燥环境中获得适宜的培养条件從而丰度升高。干燥管叶槽舌兰根样的差异显著性内生细菌类群较为丰富,有拜叶林克氏菌科、黄色杆菌科及慢生根瘤菌属。新鲜管叶槽舌兰细菌群落中差异显著性细菌类群是马赛菌属。由此推测,马赛菌属、鞘氨醇菌属、假单胞菌属、肠杆菌属、分支杆菌属及慢生根瘤菌属是管叶槽舌兰的益生细菌。干燥可能会引起细菌脱水,进而使细菌活力下降(Berninger et al., 2018;Majidzadeh et al., 2022)。Moreira等(2021)对乳酸菌(LAB)培养物经过干燥处理,发现干燥会增加乳酸菌细胞的损伤,导致培养活力的丧失和细胞保护能力的改变。
综上结果表明,硅胶干燥的采样处理会显著改变内生菌群落OTUs数量、物种类群及丰度、α多样性、β多样性和互作模式,且会导致根内某些关键真菌及细菌类群尤其是菌根真菌和菌根细菌的丢失和变化,影响数据的完整性和准确性。因此,针对兰科植物根样内生菌的研究应使用新鲜的根样。
3.4 管叶槽舌兰根内生细菌和真菌的比较
本研究的管叶槽舌兰根样中内生真菌群落的OTUs有117个,Chao 1指数、Simpson指数和Shannon指数分别为39.797、0.723和3.070。而内生细菌群落有1 283个OTUs,Chao l指数、Simpson指数和Shannon指数分别为524.492、0.976、7.103。管叶槽舌兰根样内生细菌群落的丰富度和多样性要远比内生真菌群落的高,内生细菌可能有着远比已有认知对管叶槽舌兰更为重要的作用。兰科植物内生细菌与真菌的协作对宿主植物的生长具有重要意义(张芳芳等,2016),王小明等(2016)把铁皮石斛中分离得到的真菌和细菌进行组合,对铁皮石斛幼苗进行真菌+细菌联合接种,与未接种和单独接种处理相比,真菌+细菌组合对铁皮石斛幼苗生长的影响存在显著差异。张萍(2012)采用平板对峙法对铁皮石斛6株促生内生细菌与8株促生内生真菌进行促生组合的研究结果显示,某些细菌与真菌组合后处理苗的各个指标均有所提高,与单一接菌的处理苗均形成显著性差异,特定的真菌或细菌组合表现出协同效应或累加效应。推测管叶槽舌兰根部真菌和细菌的相互作用可能共同影响管叶槽舌兰的生长发育,其相互作用的机制有待进一步研究和验证。
管叶槽舌兰作为一种珍稀濒危的兰科植物,根系内生菌在管叶槽舌兰种子萌发、幼苗形成、生长发育过程中起着重要的作用。本研究结果可为进一步采用菌根技术实现管叶槽舌兰种质保育提供理论基础,对管叶槽舌兰的保护与生产栽培具有重要意义,同时,也为兰科植物内生微生物的采样方法提供参考。
参考文献:
AI Y, XIE TX, LIU JF, et al., 2019. Community structure and biological function of the root symbiotic fungi of Arundina graminifolia [J]. Mycosystema, 38(10): 1631-1642. [艾叶, 谢泰祥, 刘江枫, 等, 2019. 竹叶兰根系共生真菌群落结构及生物学功能初探 [J]. 菌物学报, 38(10): 1631-1642.
BELLEMAIN E, CARLSEN T, BROCHMANN C,et al., 2010. ITS as an environmental DNA barcode for fungi: an in silico approach reveals potential PCR biases [J]. BMC Microbiol, 10(1): 189-200.
BERNINGER T, GONZALEZ LO, BEJARANO A, et al., 2018. Maintenance and assessment of cell viability in formulation of non-sporulating bacterial inoculants [J]. Microb Biotechnol, 11(2): 277-301.
CHEN ZB, LI B, WANG DK, et al., 2016. Composition and diversity of endophytic bacteria in Bletilla striata [J]. J S Agric, 47(2): 227-233. [陈泽斌, 李冰, 王定康, 等, 2016. 白芨内生细菌组成及多样性分析 [J]. 南方农业学报, 47(2): 227-233.]
CHENG P, ZHENG YL, LI YJ,et al., 2008. Study on biocontrol of Dendrobium leaf spot caused by Fusarium [J]. Chin Agric Sci Bull, 24(9): 357-361. [程萍, 郑燕玲, 黎永坚, 等, 2008. 石斛兰镰刀菌叶斑病的生物防治研究 [J]. 中国农学通报, 24(9): 357-361.]
CHEN YL, YU LC, QIAN Y, et al., 2019. Isolation and identification of endophytic fungi and bacteria of Phalaenopsis deliciosa [J]. J Trop Biol, 10(4): 372-379. [陈耀丽, 俞龙春, 钱悦, 等, 2019. 大尖囊蝴蝶兰内生真菌和细菌的分离与鉴定 [J]. 热带生物学报, 10(4): 372-379.]
CHEN J, WANG H, GUO SX, 2012. Isolation and identification of endophytic and mycorrhizal fungi from seeds and roots of Dendrobium (Orchidaceae) [J]. Mycorrhiza, 22(4): 297-307.
COMPANT S, SAMAD A, FAIST H, et al., 2019. A review on the plant microbiome: ecology, functions, and emerging trends in microbial application [J]. J Adv Res, 19: 29-37.
CHEN XM, GUO SX, 2005. Effects of four endophytic fungi on the growth and polysaccharide and total alkaloid content of sterile seedlings of Dendrobium nobile [J]. Chin J Chin Mat Med, 30(4): 14-18. [陳晓梅, 郭顺星, 2005. 4种内生真菌对金钗石斛无菌苗生长及其多糖和总生物碱含量的影响 [J]. 中国中药杂志, 30(4): 14-18.]
ESCUDERO MC, BULGARELLI D, 2019. Tracing the evolutionary routes of plant-microbiota interactions [J]. Curr Opin Microbiol, 49: 34-40.
FARIA DC, DIAS ACF, MELO IS, et al., 2013. Endophytic bacteria isolated from orchid and their potential to promote plant growth [J]. World J Microbiol Biotechnol, 29(2): 217-221.
GAI XG, XING XK, GUO SX, 2014. Ecological research of orchid mycorrhizae: a review [J]. Mycosystema, 33(4): 753-767. [盖雪鸽, 邢晓科, 郭顺星, 2014. 兰科菌根的生态学研究进展 [J]. 菌物学报, 33(4): 753-767.]
GIRIJA D, RAJEEVAN PK, BALAKRISHNAN S, et al., 2018. 16S rRNA gene taxonomic profiling of endophytic bacteria associated with Phylaenopsis roots [J]. J Hortic Sci, 13(1): 103-107.
GAO Y, CHEN YH, XING XK, 2019. Symbiotic fungi inducing seed germination of medicinal Gymnadenia conopsea of Orchidaceae [J]. Mycosystema, 38(11): 1948-1957. [高越, 陈艳红, 邢晓科, 2019. 兰科药用植物手参种子的真菌共生萌发 [J]. 菌物学报, 38(11): 1948-1957.]
GALDIANO RF, PEDRINHO EAN, CASTELLANE TCL, et al., 2011. Auxin-producing bacteria isolated from the roots of Cattleya walkeriana, an endangered brazilian orchid, and their role in acclimatization [J]. Rev Brasil De Ciência Do Solo, 35(3): 729-737.
HARRISON JG, FORISTER ML, PARCHMAN TL, et al., 2016. Vertical stratification of the foliar fungal community in the worlds tallest trees [J]. Am J Bot, 103(12): 2087-2095.
JACQUEMYN H, WAUD M, LIEVENS B,et al., 2016. Differences in mycorrhizal communities between Epipactis palustris, E. helleborine and its presumed sister species E. neerlandica [J]. Ann Bot, 118(1): 105-114.
JIANG YL, MIAO Q, CHEN XH, et al., 2018. Root-associated fungi diversity of eight orchid species in Liaoning, China [J]. Chin J Ecol, 37(10): 3001-3009. [蔣玉玲, 苗青, 陈旭辉, 等, 2018. 辽宁省八种兰科植物根内生真菌多样性 [J]. 生态学杂志, 37(10): 3001-3009.]
KIM D, HOFSTAEDTER CE, ZHAO C,et al., 2017. Optimizing methods and dodging pitfalls in microbiome research [J]. Microbiome, 5(1): 52-66.
KAUR J , SHARMA J, 2021. Orchid root associated bacteria: linchpins or accessories? [J]. Front Plant Sci, 12: 661966.
LI TQ, YANG WK, WU SM, et al., 2021. Progress and prospects of mycorrhizal fungal diversity in orchids [J]. Front Plant Sci, 12: 646325.
LI M, SHI JH, 2006. Investigations of mycorrhizal fungi of Cymbidium lowianum [J]. J Yunnan Norm Univ (Nat Sci Ed), 26(3): 54-55. [李明, 施继惠, 2006. 碧玉兰菌根真菌的调查 [J]. 云南师范大学学报(自然科学版), 26(3): 54-55.]
LOZUPONE CA, HAMADY M, KELLEY ST, et al., 2007. Quantitative and qualitative beta diversity measures lead to different insights into factors that structure microbial communities [J]. Appl Environ Microbiol, 73(5): 1576-1585.
MOREIRA MTC, MARTINS E, PERRONE T, et al., 2021. Challenges associated with spray drying of lactic acid bacteria: Understanding cell viability loss [J]. Compr Rev Food Sci Food Saf, 20(4): 3267-3283.
MAJIDZADEH HR, GHIASVAND M, REZAEI E, et al., 2022. Assessing the viability of three Lactobacillus bacterial species protected in the cryoprotectants containing whey and maltodextrin during freeze-drying process [J]. Lett Appl Microbiol, 74(4): 505-512.
MARCHESI JR, RAVEL J, 2015. The vocabulary of microbiome research: a proposal [J]. Microbiome, 3: 31.
OKTALIRA FT, WHITEHEAD MR, LINDE CC, 2019. Mycorrhizal specificity in widespread and narrow-range distributed Caladenia orchid species [J]. Fungal Ecol, 42(C): e100869.
PARK MS, EIMES JA, OH SH, et al., 2018. Diversity of fungi associated with roots of Calanthe orchid species in Korea [J]. J Microbiol, 56(1): 49-55.
SHAO SC, WANG QX, BENG KC, et al., 2020. Fungi isolated from host protocorms accelerate symbiotic seed germination in an endangered orchid species (Dendrobium chrysotoxum) from southern China [J]. Mycorrhiza, 30(4): 529-539.
TSAVKELOVA EA, LOBAKOVA ES, KOLOMEITSEVA GL, et al., 2003. Associative cyanobacteria isolated from the roots of epiphytic orchids [J]. Microbiology, 72(1): 92-97.
TSAVKELOVA EA, CHERDYNTSEVA TA, KLIMOVA SY, et al., 2007. Orchid-associated bacteria produce indole-3-acetic acid, promote seed germination, and increase their microbial yield in response to exogenous auxin [J]. Arch Microbiol, 188(6): 655-664.
TARKKA MT, FREY-KLETT P, 2008. Mycorrhiza helper bacteria [C]//Mycorrhiza VA. 3rd ed. Berlin: Springer: 113-132.
TAN XM, CHEN XM, WANG CL, et al., 2012. Isolation and identification of endophytic fungi in roots of nine Holcoglossum plants (Orchidaceae) collected from Yunnan, Guangxi, and Hainan provinces of China [J]. Curr Microbiol, 64(2): 140-147.
TONG WJ, ZHANG L, XUE QY, et al., 2014. Isolation of endophytic bacteria in Dendrobium loddigesii collected from different locations and comparison on their plant-growth-promoting potential [J]. J Plant Resour Environ, 23(1): 16-23. [童文君, 张礼, 薛庆云, 等, 2014. 不同产地美花石斛内生细菌分离及促生潜力比较 [J]. 植物资源与环境学报, 23(1): 16-23.]
WHITE JF, TORRES MS, SULLIVAN RF, et al., 2014. Occurrence of Bacillus amyloliquefaciens as a systemic endophyte of vanilla orchids [J]. Microsc Res Technol, 77(11): 874-885.
WEN T, ZHAO ML, LIU T, et al., 2020. High abundance of Ralstonia solanacearum changed tomato rhizosphere microbiome and metabolome [J]. BMC Plant Biol, 20(1): 1-11.
WILKINSON KG, DIXON KW, SIVASITHAMPARAM K, 1989. Interaction of soil bacteria, mycorrhizal fungi and orchid seed in relation to germination of Australian orchids [J]. New Phytol, 112(3): 429-435.
WU QS, LEI X, LEI YM, 2018.Analyses on composition and diversity of endophytic bacteria in Dendrobium nobile [J]. J Plant Resour Environ, 27(1): 79-90. [吳庆珊, 雷珣, 雷友梅, 等, 2018. 金钗石斛内生细菌的组成及多样性分析 [J]. 植物资源与环境学报, 27(1): 79-90.]
WANG XJ, WU YH, MING XJ, et al., 2021. Isolating ecological-specific fungi and creating fungus-seed bags for epiphytic orchid conservation [J]. Glob Ecol Conserv, 28: e01714.
WANG T, WANG XJ, GANG YQ, et al., 2022. Spatial pattern of endophytic fungi and the symbiotic germination of tulasnella fungi from wild Cymbidium goeringii (Orchidaceae) in China [J]. Curr Microbiol, 79(5): 139.
WANG MN, HU Y, LI HJ, et al., 2021. New insights into orchids mycorrhizal fungi research [J]. Guihaia, 41(4): 487-502. [王美娜, 胡玥, 李鶴娟, 等, 2021. 兰科植物菌根真菌研究新见解 [J]. 广西植物, 41(4): 487-502.]
XIE TX, ZHANG QH, ZHOU J, et al., 2020. Microbial communities in rhizosphere and root-endosphere of wild Cymbidium ensifolium [J]. Fujian J Agric Sci, 35(5): 560-568. [谢泰祥, 张清华, 周杰, 等, 2020. 野生建兰根际与根内共生细菌种群结构差异分析 [J]. 福建农业学报, 35(5): 560-568.]
YANG WK, 2020. Isolating effective fungi to facilitate seed germination of Paphiopedilum spicerianum and application in conservation practice [D]. Kunming: Yunnan University. [杨文科, 2020. 促进白旗兜兰种子共生萌发有效真菌的分离与应用 [D]. 昆明: 云南大学.]
YILMAZ P, PARFREYLW, YARZA P, et al., 2014. The SILVA and “all-species living tree project (LTP)” taxonomic frameworks [J]. Nucl Acids Res, 42(D1): D643-D648.
YU J, ZHOU XF, YANG SJ, et al., 2013. Design and application of specific 16S rDNA-targeted primers for assessing endophytic diversity in Dendrobium officinale using nested PCR-DGGE [J]. Appl Microbiol Biotechnol, 97(22): 9825-9836.
YUAN L, YANG ZL, LI SY,et al., 2010. Mycorrhizal specificity, preference, and plasticity of six slipper orchids from South Western China [J]. Mycorrhiza, 20(8): 559-568.
YANG ED, CUI DX, WANG WY, 2019. Research progress on the genus Massilia [J]. Microbiol Chin, 46(6): 1537-1548. [杨恩东, 崔丹曦, 汪维云, 2019. 马赛菌属细菌研究进展 [J]. 微生物学通报, 46(6): 1537-1548.]
ZHU XM, HU H, LI SY,et al., 2012. Interaction between endophytic Fungi and seedlings of two species of Paphiopedilum during symbiotic culture [J]. Plant Divers, 34(2): 171-178. [朱鑫敏, 胡虹, 李树云, 等, 2012. 内生真菌与两种兜兰共培养过程中的相互作用 [J]. 植物分类与资源学报, 34(2): 171-178.]
ZHANG FF, 2015. Screen and growth-promoting effect of endophytic bacteria from Phalaenopsis pulcherrima roots [D]. Haikou: Hainan University. [张芳芳, 2015. 五唇兰根部内生细菌筛选及其促生效应研究 [D]. 海口: 海南大学.]
ZHANG FF, SONG XQ, ZHU GP, 2016. Diversity of culturable endophytic bacteria isolated from the root tissues of Phalaenopsis pulcherrima in two different habitats [J]. Plant Sci J, 34(1):135-142. [张芳芳, 宋希强, 朱国鹏, 2016. 不同生境下五唇兰根部可培养内生细菌多样性研究 [J]. 植物科学学报, 34(1): 135-142.]
ZHANG P, 2012. Study on endophytic bacteria of Dendrobium catenatum Lindley (Orchidaceae) [D]. Haikou: Hainan University. [张萍, 2012. 铁皮石斛内生细菌研究 [D]. 海口: 海南大学.]
ZHENG BX, BI QF, HAO XL, et al., 2017. Massilia phosphatilytica sp. nov., a phosphate solubilizing bacteria isolated from a long-term fertilized soil [J]. Int J Syst Evol Microbiol, 67(8): 2514-2519.
ZHANG P, SONG XQ, 2012. Advances in diversity and promotion mechanism of endophytic bacteria associated with Orchids [J]. J Trop Subtrop Bot, 20(1): 92-98. [张萍, 宋希强, 2012. 兰科植物内生细菌物种多样性及其促生机理研究进展 [J]. 热带亚热带植物学报, 20(1): 92-98.]
ZENG XH, NI ZY, DIAO HX, et al., 2021. Root endophytic fungal community and carbon and nitrogen stable isotope patterns differ among Bletilla Species (Orchidaceae) [J]. J Fungi (Basel), 7(2): 69.
ZELMER CD, CUTHBERTSON L, CURRAH RS, 1996. Fungi associated with terrestrial orchid mycorrhizas, seeds and protocorms [J]. Mycoscience, 37(4): 439.
(责任编辑 蒋巧媛)
收稿日期: 2022-11-10
基金项目: 国家自然科学基金(32001245); 深圳市可持续发展专项(KCXFZ20211020164200001); 深圳市科技计划项目(JCYJ20210324123013037)。
第一作者: 张镇梁(1997-),硕士研究生,研究方向为植物保护,(E-mail)2399308611@qq.com。
*通信作者: 乔琦,博士,教授,研究方向為植物保护生物学,(E-mail)nxyqiao@163.com。
