基于全基因组重测序筛选南阳黑猪脂肪沉积相关候选基因
2023-07-15普布占堆鲁云风
李 盼 普布占堆 张 浩 鲁云风 张 博*
(1.中国农业大学 动物科学技术学院,北京 100193; 2.南阳师范学院 生命科学与技术学院,河南 南阳 473061)
猪肉是我国主要的肉类消费品,猪肉的肌内脂肪含量高低已成为消费者挑选猪肉的重要考虑因素[1]。在猪生产中,脂肪沉积是一个复杂而重要的经济性状,其中背膘厚度是衡量脂肪沉积的良好指标,多项研究表明它与生长速率、肉质和繁殖性能呈显著相关[2-4]。肌内脂肪含量也可以影响其他肉质性状,如肉的风味、嫩度、剪切力、大理石纹评分、系水力等,在猪的育种工作中具有不可替代的重要地位[5]。目前,大量研究利用现代分子育种技术探讨肌内脂肪沉积和基因之间的关系,发现瘦素基因[6]、脂肪酸结合蛋白基因家族[7]和脂肪细胞分化决定因子等与脂质生成密切相关[8]。
南阳黑猪是分布于河南省南阳地区西部一带的优良地方品种,具有我国地方猪种的共有特性,如脂肪沉积多、生长速度较快、繁殖性能好和抗病性强等,并且受到的人工选育较少,群体内脂肪沉积性状的表型差异较大[9-10]。研究表明南阳黑猪的矿物质含量、大理石条纹、肉色和肌内脂肪含量均显著高于商品猪[11-13]。因此,南阳黑猪是研究脂质沉积的理想模型。鲁云风等[14-16]经育种实践发现南阳黑猪种群中同胞个体间存在背膘厚等脂肪表型分化的现象,并对脂肪酸相关指标差异极显著的个体进行了转录组分析,鉴定了与脂肪酸代谢相关的候选基因。苗志国等[17]发现南阳黑猪与长白猪相比具有较低的激素敏感脂肪酶(HSL)活性,而脂肪酸合成酶(FAS)、肉碱棕榈酰转移酶Ⅰ(CPT-Ⅰ)和脂蛋白脂酶(LPL)活性及FAS/HSL比值则显著性高于长白猪,表明南阳黑猪优良肉品质的形成与脂肪代谢相关酶活性间存在重要相关性。此外,Wang等[18]分别对脂肪表型差异明显的南阳黑猪进行了转录组和蛋白组学分析,鉴定到多个关键脂肪沉积候选基因和蛋白。
由于肌内脂肪形成的复杂性,现有研究仍不足以阐释肌内脂肪形成的具体机制。随着生物信息学和测序技术的快速发展,全基因组重测序已成功用于检测一些人类疾病的因果变异[19],也应用于动物遗传机制研究[20]。采用全基因组重测序技术可以在全基因组范围内筛选到大量的SNPs、InDels、SVs和CNVs等,这些变异可能是导致动物遗传进化变异的主要决定因素,对动物遗传进化分析及分子辅助育种研究具有重要的作用[21-23]。此外,遗传变异会引起动物表型差异,挖掘潜在的基因组变异信息对揭示动物个体间的表型差异和动物的遗传改良具有重要意义。然而,目前对南阳黑猪在全基因组水平上的进一步研究却鲜少报道。
本研究通过对南阳黑猪种群不同个体脂肪表型(胴体性状和肉质性状)统计分析,筛选出背膘厚度差异显著的同胞或半同胞个体,利用高通量测序技术对猪背最长肌进行全基因组重测序,深度挖掘两组间存在的SNP、InDel、SV和CNV 4种变异位点,并通过生物信息学分析明确影响脂肪沉积的功能基因,为进一步推进南阳黑猪分子育种改良工作提供理论支持和数据参考。
1 材料与方法
1.1 试验材料
样本信息与Wang等[18]转录组测序样本相同,所用试验群体均来自河南省南阳市内乡南阳黑猪场,选择体重相近、胎次相同和饲养条件相同的3组(6头)全同胞或半同胞南阳黑猪,每组同胞个体间脂肪表型差异较大。生长至190日龄时对此6头猪进行屠宰,并根据系谱信息和测定标准统计胴体性状和肉质性状表型数据。取其背最长肌中段最后肋与第一腰椎间肌肉组织测定肉品质指标,其余样品利用DNA提取试剂盒(天根生化科技(北京)有限公司)提取基因组DNA,Nanodrop 2000(美国)检测DNA的纯度(OD260/OD280),检测合格后-80 ℃冰箱保存备用。
1.2 测定指标及方法
1.2.1胴体性状
南阳黑猪屠宰操作规程参照《瘦肉型猪胴体性状测定技术规范》(NY/T 825—2004)。测定指标包括宰前活体重、胴体直长、胴体斜长、胴体重、背膘厚度、肋骨数、屠宰率和眼肌面积。
1.2.2肉质性状
根据《猪肌肉品质测定技术规范》(NY/T 821—2004)所述方法测定肉品质,测定指标包括肌内脂肪含量、肉色、剪切力、pH45 min、pH24 h、大理石纹、48 h滴水损失和蒸煮损失。
1.3 全基因组重测序
1.3.1建库测序
把检测合格的DNA样品利用超声波随机打断,DNA片段经末端修复、加测序接头、纯化和PCR扩增完成整个文库制备。最后,对质检合格的文库通过Illumina HiSeq 4000测序。
1.3.2测序数据的质量控制、注释和多态位点检测
对测序得到的原始测序reads进行数据质控,对接头序列及polyN、polyA等序列过滤,然后使用BWA(v0.7.16)软件[24]将质控后的reads与猪参考基因组(Sscrofa11.1)序列进行比对。
其次,通过变异检测软件GATK[25]检测全基因组范围内SNP和Indel位点,通过染色体结构变异分析软件DELLY[26]检测全基因组范围内SV位点,通过拷贝数变异分析软件Control-FREEC[27]检测全基因组范围内CNV位点,再根据质量值、深度、重复性等因素做进一步的过滤筛选,最终得到高可信度的SNP、Indel、SV和CNV数据集,并采用ANNOVAR[28]软件对其进行注释。
此外,将检测到的SNP、Indel、SV和CNV进行功能注释,再用vcftool(v 0.1.16)软件计算差异变异位点,并对所得到的差异基因进行GO(http:∥geneontology.org/)和KEGG(https:∥www.kegg.jp/)富集分析。
1.4 数据统计与分析
数据使用Excel 2016进行整理,使用SPSS 23.0软件进行统计样本t检验,结果以“平均值±标准差”表示。P<0.01表示差异极显著,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 南阳黑猪高-低脂肪组肌肉品质分析
基于Wang等[18]对南阳黑猪脂肪相关表型的测定结果进行高-低脂肪组的选择,分别从高-低脂肪组选取3头用于后续全基因组重测序分析并对其胴体性状和肉质性状表型数据进行统计。如表1所示,胴体性状中高脂肪组的肌内脂肪含量((4.96±0.62)%)显著高于低脂肪组((3.61±0.11)%)(P<0.05),平均背膘厚((43.74±2.33) mm)极显著高于低脂肪组((28.36±4.17) mm)(P<0.01),其余各项指标在两组之间数值相近无显著差异(P>0.05)。在肉质性状测定结果中,在高-低脂肪组之间背最长肌剪切力存在极显著差异(P<0.01),其中剪切力、pH45 min、蒸煮损失和48 h滴水损失在两组之间存在显著差异(P<0.05),其余各项指标在两组之间无显著差异。

表1 南阳黑猪胴体和肉质指标分析
2.2 南阳黑猪高-低脂肪组全基因组重测序数据分析
南阳黑猪高脂肪组和低脂肪组全基因组重测序原始数据已提交到基因表达综合数据库(PRJNA894135),共产生213.25 Gb数据,过滤后得到208.00 Gb有效数据,平均有效率为97.56%,Q30均在93.07%以上,与猪参考基因组(Sscrofa11.1)比对后的比对率达到97.81%以上(表2),表明本次试验获得的序列能够在染色体中均匀分布、随机性好、数据质量较高,可以用于后续突变检测及相关分析。

表2 南阳黑猪高-低脂肪组测序信息
2.3 南阳黑猪高-低脂肪组SNP位点变异检测及注释
根据与参考基因组的比对结果,在南阳黑猪高脂肪组和低脂肪组的基因组上找到大量的遗传变异。在高脂肪组和低脂肪组2个组间分别检测得到12 662 411和13 164 680个SNPs,其中转换类型的SNP数量最多,在两组的杂合率分别为66.92%和63.73%。通过对南阳黑猪高脂肪组和低脂肪组进行SNP注释,经过分析发现两组的SNP变异主要集中在基因间区,比例分别为58.16%和58.19%,其次为内含子区域,比例分别为37.38%和37.43%,而发生在基因的剪切位点的SNP最少,只有497和524个。除此之外,南阳黑猪高脂肪组和低脂肪组发生在蛋白编码区内的SNP位点数量分别为87 176和91 225,其中同义突变比例分别为60.52%和60.31%,非同义突变比例分别为38.79%和39.01%(表3)。
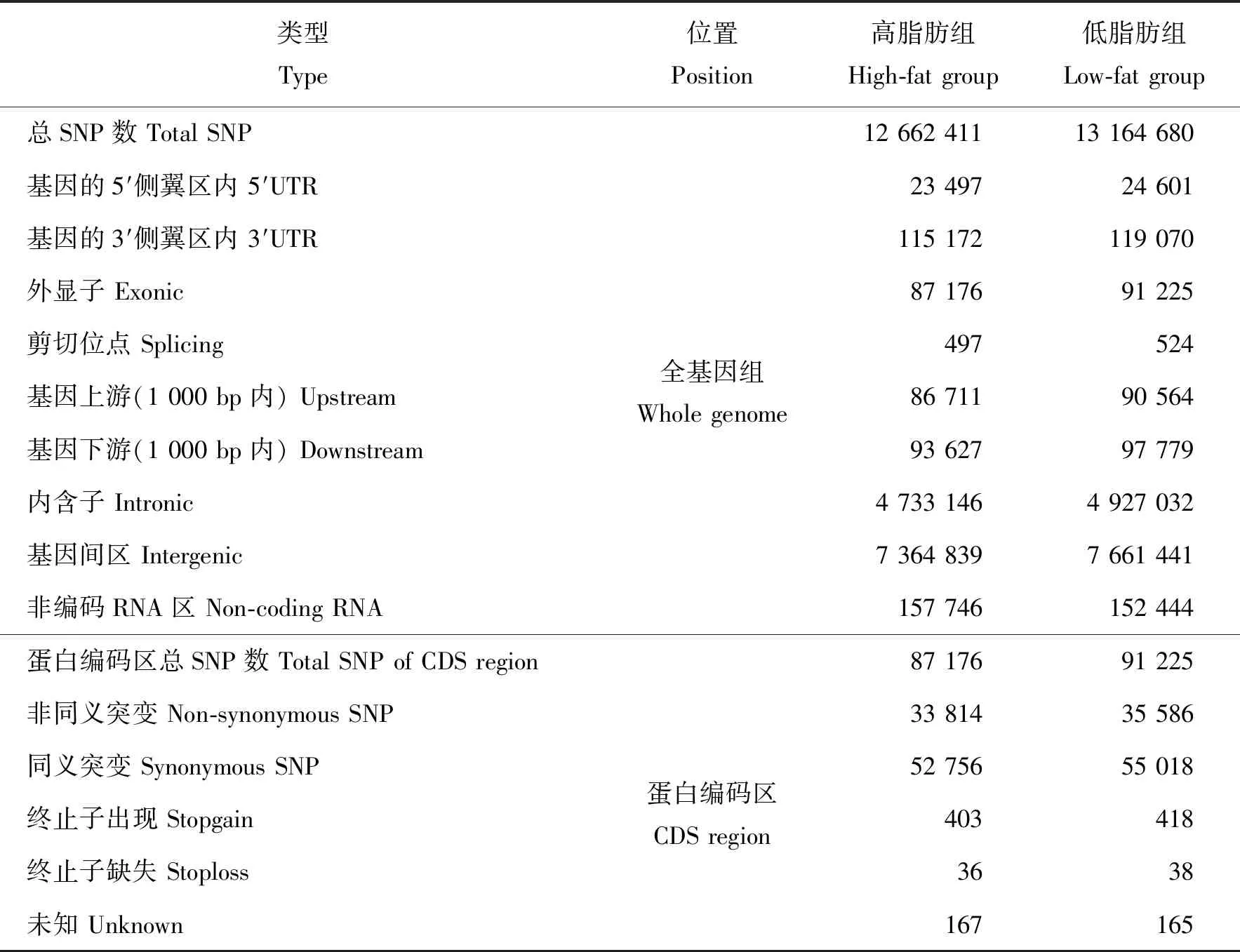
表3 南阳黑猪高-低脂肪组中基因SNP变异位点分布统计
2.4 南阳黑猪高-低脂肪组InDel变异检测及注释
通过对南阳黑猪高脂肪组和低脂肪组进行InDel变异检测,在2个组间分别检测得到2 873 762和2 929 060个InDels,经分析发现2组的InDel变异分布区域与SNP结果类似,主要集中在基因间区和内含子区域,在基因间区的比例分别为58.02%和57.94%,在内含子区域的比例分别为37.96%和38.06%。另外,南阳黑猪高脂肪组和低脂肪组在蛋白编码区共检测到4 773和4 896个InDels,其中移码插入的占比最多,比例分别为63.75%和63.34%,而移码缺失的比例分别为18.06%和18.12%(表4)。InDel长度的不同会对基因组造成不同程度的影响。如图1所示,在全基因组水平上或者在外显子区内,不同长度的InDel的分布有着明显的差异,其突变模式主要以1个碱基的InDel为主。

图1 全基因组(a)和外显子区(b)InDels长度分布
2.5 南阳黑猪高-低脂肪组SV变异检测及注释
SV变异主要包括缺失(Deletion, DEL)、易位(Translocation,TRA)、重复(Duplication,DUP)、倒位(Inversion, INV)、插入(Insertion, INS)。在2组中分别检测到26 670和29 688个SVs,5种变异类型中DEL数量最多,分别为18 063和20 187个,分别占总SV变异数的67.73%和68.00%。其次是INS,分别为5 684和6 474个,分别占总SV变异数的21.31%和21.81%,而SV变异类型TRA、DUP和INV的占比较少。因此,南阳黑猪高-低脂肪组SV变异主要发生的变异类型为DEL和INS。此外,对SV变异位点进行注释,发现SV的分布区域也主要集中在基因间区和内含子区域,两组在基因间区的比例分别为54.54%和54.53%,在内含子区的比例分别为34.39%和34.96%(表5)。

表5 南阳黑猪高-低脂肪组中基因SV变异位点在全基因组的分布统计
2.6 南阳黑猪高-低脂肪组CNV变异检测及注释
CNV变异的变异类型包括缺失CNV和重复CNV。在两组中分别检测到910和989个CNVs,缺失CNV数和重复类型的CNV数比例相近,分别约占总CNV数的一半。对南阳黑猪高脂肪组和低脂肪组中基因CNV变异位点注释结果显示,发现CNV的分布区域主要集中在基因间区和外显子区域,两组在基因间区的比例分别为42.86%和43.88%,在外显子区的比例分别为45.38%和43.68%(表6)。
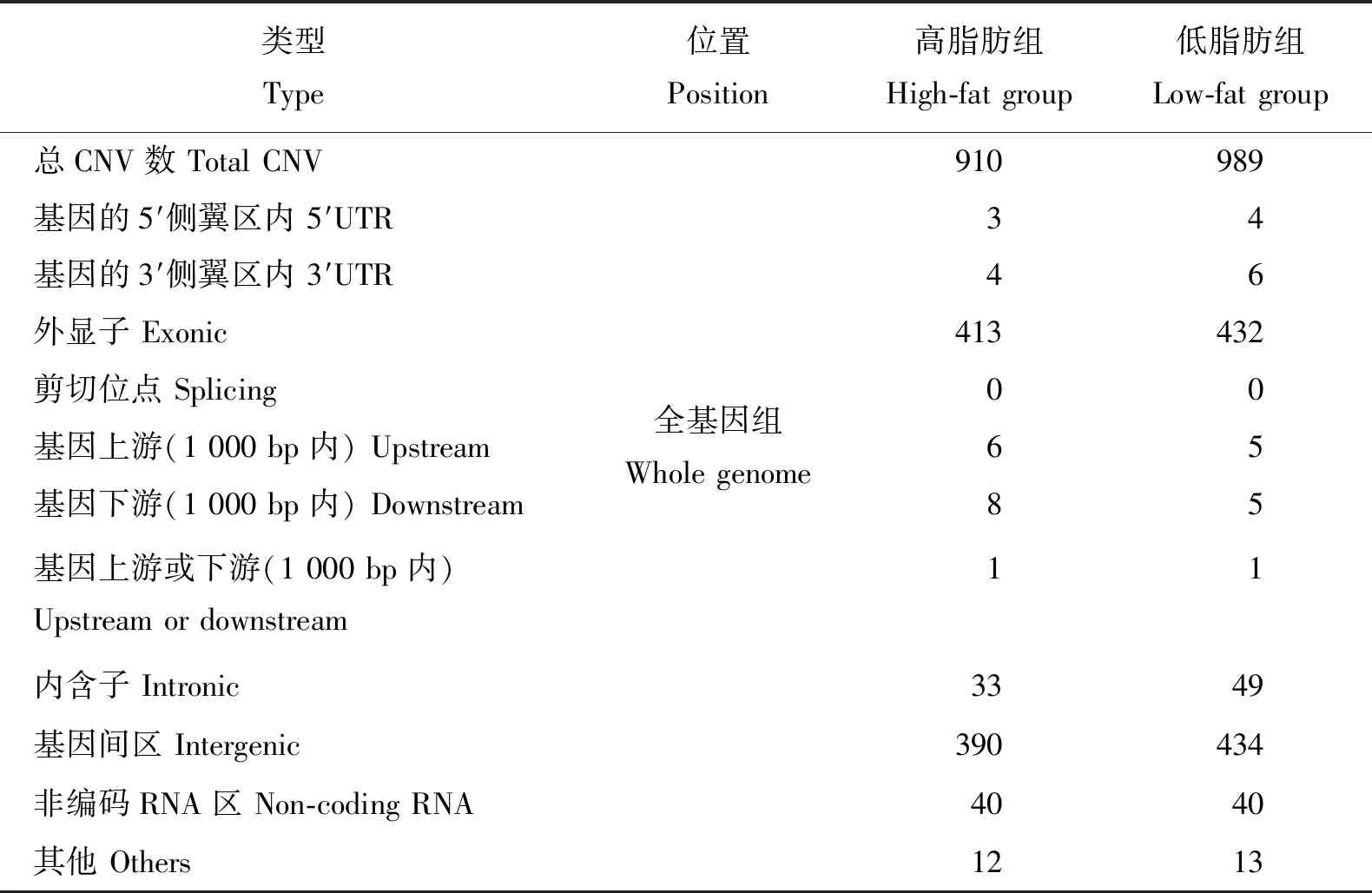
表6 南阳黑猪高-低脂肪组中基因CNV变异位点分布统计
2.7 关键变异基因的功能分析
通过与猪参考基因组比对,筛选高-低脂肪组中存在SNP非同义突变和 InDel移码突变的基因,从而确定两组中可能存在差异表达且影响功能的基因。通过生物信息学分析,两组之间共注释到有功能注释的组间差异基因209个。GO分析结果表明这些基因在生物学过程(BP)中主要富集在肽基-丝氨酸的磷酸化(Peptidyl-serine phosphorylation)、RNA聚合酶启动子的调控(RNA polymerase II promoter)、核糖体组装(Nucleosome assembly)等,细胞组分(CC)主要富集在高尔基体(Golgi apparatus)和突触前部(Presynapse)。分子功能(MF)主要富集在DNA糖基化酶活性(DNA glycosylase activity)、WW结构域的结合(WW domain binding)、DNA酶的活性(DNAlyase activity)、ATP酶的活性(ATPase activity)和蛋白酶的活性(Protein kinase activity)等(图2(a));KEGG分析表明这些基因主要集中在mTOR信号通路(mTOR signaling pathway),甲状腺信号通路(Thyroid hormone signaling pathway),神经营养蛋白分子信号通路(Neurotrophin signaling pathway)以及ABC 转运蛋白信号通路(ABC transporters)等(图2(b))。

图2 南阳黑猪高-低脂肪组间变异基因GO(a)和KEGG(b)注释分类图
2.8 南阳黑猪转录组和重测序联合分析
利用Wang等[18]转录组测序结果(样本来源与数量与该研究相同)与本研究基因组重测序结果进行联合分析,480个转录组差异基因与209个重测序差异基因共交集到8个基因(图3),包括CTNNA3、FASTKD1、HAT1、COMMD4、PLP1、CREB5、NHSL2和ITGA6,其中2个基因(PLP1和ITGA6)涉及脂肪细胞分化,具体功能信息如表7所示。
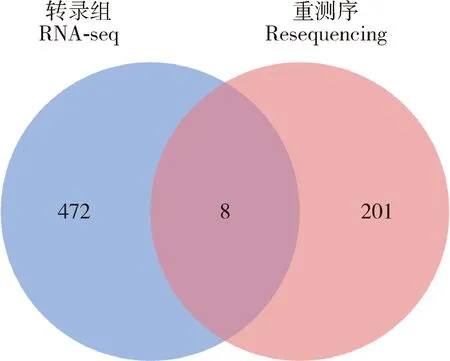
图3 南阳黑猪高-低脂肪组转录组和 重测序组间差异基因韦恩图

表7 南阳黑猪高-低脂肪组转录组和重测序组间关键变异基因功能注释结果
3 讨 论
南阳黑猪作为我国优良地方猪种,以高脂肪沉积和高遗传分化而闻名,是研究我国地方猪脂肪沉积相关遗传机制的良好研究材料[17]。在本研究中,为分析影响南阳黑猪群体内脂肪表型分化的关键基因,以Wang等[18]测定的肌内脂肪含量作为核心选择指标,并对其进行胴体性状和肉质性状的统计分析。胴体性状作为猪肉用性能的重要指标,直接影响着经济效益。与引进品种猪相比,地方猪种具有独特的种质特性,如松辽黑猪[29]、豫西黑猪[30]和关中黑猪[31]等地方猪种的背膘厚均高于引进品种猪。本研究显示在高-低脂肪组之间的宰前活重、胴体重、眼肌面积和屠宰率等指标无显著差异的情况下,高脂肪组平均背膘厚呈明显升高的趋势,进一步证实了南阳黑猪群体脂肪相关表型变异较大的特点[32]。肌肉的嫩度、多汁性、适口性等肉质性状与肌内脂肪含量呈显著正相关[33]。Kim等[34]研究发现肌内脂肪含量的增加有利于提高pH24 h和减少滴水损失,其他相关研究也发现肌内脂肪含量与大理石纹评分和pH45 min呈正相关,与滴水损失和蒸煮损失呈负相关[35-36]。本研究表明,高脂肪组的剪切力极显著低于低脂肪组(P<0.01),这与先前报道的肌内脂肪含量越高,则肉质剪切力越弱相一致[37]。高脂肪组的48 h滴水损失和蒸煮损失均显著低于低脂肪组(P<0.05),高脂肪组的pH45 min高于低脂肪组,说明南阳黑猪高脂肪组肉质优于低脂肪组。除剪切力、水分含量和pH45 min外,高脂肪组与低脂肪组间其他品质没有显著差异,侧面印证了本研究对南阳黑猪高脂肪组和低脂肪组分组的可靠性,保证了高-低脂肪组之间基因多态性主要与脂肪沉积相关,能在一定水平上反映南阳黑猪高-低脂肪组在基因组水平上的差异。
越来越多研究发现全基因组重测序可鉴定出与动物个体生产性状密切相关的变异位点,这些关键变异位点对动物生产及分子育种均具有重要意义[38-39]。本研究中通过全基因组重测序挖掘影响南阳黑猪脂肪沉积的功能基因和变异位点,结果显示,高-低脂肪组与参考基因组之间均发生SNP、InDel、SV和CNV4种类型的变异,共检测到2 827 091个SNPs、5 802 822个InDels、56 358个SVs及1 898个CNVs,但4种遗传变异在基因组上的位置和数目差异并不显著。低脂肪组获得的SNP、InDel、SV和CNV,仅为高脂肪组的1.040倍、1.019倍、1.113倍和1.086倍,这说明高-低脂肪组间遗传背景相似,引起南阳黑猪同胞脂肪沉积能力不同的原因可能是由一小部分基因所调控的。另外,所检测到的SNP数量明显多于其他类型变异的数量,这说明南阳黑猪种群的基因变异主要以SNP变异为主。在SNP变异中,高-低脂肪组的转换/颠换比例分别为2.62和2.55,这说明在南阳黑猪种群中同种类型碱基置换的突变模式比不同类型间更容易发生。多项研究表明SNP、InDel和SV大多发生在基因内部甚至是外显子区域、启动子区域等重要位置,这种变异往往能够引起基因功能发生重大变化[40-41]。在本研究中,分别对南阳黑猪高-低脂肪组的变异位点进行注释,发现SNP、InDel和SV主要分布在基因间区和基因内的内含子区,而CNV主要分布在基因间区和基因内的外显子区,本研究变异位点分布特点与邢凯[42]对松辽黑猪重测序结果相似。一般情况下,移码突变和错义突变会影响基因的功能和表达,甚至会直接影响到动物的表型性状。通过生物信息学分析,本研究共发现有功能注释的组间差异基因209个,然后通过GO和KEGG分析进一步探索了脂肪沉积相关的基因及其参与途径。进一步整合Wang等[18]转录组数据,最终鉴定出2个与脂肪沉积相关的差异基因(PLP1和ITGA6),这些基因的多态性变化可能是影响南阳黑猪脂肪沉积的关键。蛋白脂蛋白(Proteolipid protein 1,PLP1)基因是中枢神经系统的主要髓磷脂蛋白,它在髓鞘多层脂蛋白的形成和维持中起着至关重要的作用[43]。整合素α6 (Integrin subunit alpha 6,ITGA6)基因主要参与到PI3K-Akt信号通路,局灶性粘附,ECM受体相互作用,细胞粘附分子和棕色脂肪细胞分化等通路中,有报道显示ITGA6是血小板上层粘连蛋白的受体,参与精卵融合和胚胎发育相关信号传导,还可通过连接细胞骨架和细胞内的各种信号分子介导细胞外基质相互作用[44],推测ITGA6基因可能参与肌肉发育和脂肪沉积等途径。目前国内外关于这些基因在脂肪沉积中的具体分子作用机制尚不清楚,有必要进一步探究这些基因在猪脂肪沉积中的具体调控作用。
4 结 论
本研究通过比较南阳黑猪高脂肪组和低脂肪组胴体性状和肉质性状,发现两组之间呈显著差异的性状主要与脂肪相关,如肌内脂肪含量、平均背膘厚、剪切力、pH45 min和水分含量,其他肉品质性状在两组中没有显著差异。全基因组重测序共筛选到有功能注释的组间差异基因209个,主要参与2个细胞组成部位,6 类分子功能和5个生物学过程。整合前期课题组南阳黑猪高-低脂肪组转录组数据,共交集到8个差异基因,其中PLP1和ITGA6与脂肪沉积相关。本研究将为后续南阳黑猪的脂肪沉积相关的育种研究工作奠定了坚实的基础。
