三七根际耐皂苷木霉菌的分离鉴定及其拮抗促生活性评价
2023-07-15罗丽芬王烜东李梦琪朱书生
李 玥 罗丽芬 王烜东 李梦琪 朱书生 杨 敏
(云南农业大学 植物保护学院/农业生物多样性与病虫害控制教育部重点实验室/ 云南生物资源保护与利用国家重点实验室,昆明 650201)
三七[Panaxnotoginseng(Burk.) F. H. Chen]为五加科人参属多年生草本植物,常以根茎入药,性温,具有补血益气和消肿止痛等功效,是我国特有的传统名贵中药材[1]。因其具有特殊功效,自古以来备受青睐,迄今已有400余年的驯化栽培历史,云南省文山州和广西壮族自治区靖西市为其历史上的道地产区[2]。目前,云南为三七的主产区,种植面积和产量均占全国的98%以上[3]。然而,三七连作障碍问题日益突出,根腐病发病率大幅度增加,严重影响三七的产量和品质,导致道地产区无地可种,三七种植逐渐向非道地产区转移,连作障碍已经成为三七产业可持续发展的重要限制因素[4-5]。大部分种植户为提高三七产量,在栽培过程中主要通过大量施用化学农药控制病害,导致三七农药残留超标,严重影响药材品质[6]。因此如何解决或缓解连作障碍成为三七种植中亟待解决的难题。
三七连作障碍是多种因素共同作用的结果,包括土壤理化性质的恶化、养分失衡、土传病害、自毒作用和菌群失衡等[7]。前期研究发现,三七生长过程中通过根系分泌或残体降解释放到根际土壤中的皂苷类等物质一方面会对三七根系产生自毒作用,导致植株生长受阻[8];另一方面低浓度的皂苷可促进三七根腐病病原菌如恶疫霉菌(Trichodermaviride)、茄腐镰刀菌(Fusariumsolani)及毁灭柱孢菌(Cylindrocarpondestructans)等的生长,使其能够在根际大量扩繁和定殖[9-10]。课题组前期研究发现三七在生长过程中,通过根系分泌或残体降解释放到根际土壤中的代谢物驱动根际微生物结构和功能失衡[11],导致病原菌增加而有益菌降低,使三七发生严重的根腐病和连作障碍。
木霉菌(Trichodermaspp.)是一种广泛存在于土壤和植物根部等环境中的真菌,对多种植物具有良好的促生活性,能够诱导植株抵抗环境中的生物和非生物胁迫,还能拮抗病原菌达到防治植物病害的效果[12-13]。自Weindling[14]发现木霉菌具有拮抗病原微生物的功能以来,诸多研究者对木霉菌的功能及生防机制开展了广泛的研究,研究结果表明木霉菌可以通过竞争生态位点、重寄生、产生抗菌活性物质和诱导寄主植物产生抗性等多种机制发挥生防功能[15]。近年来,木霉菌作为一种重要的生防制剂已经成为化学农药替代化和减量化的主要产品,也是公认的最有前途的生防因子之一[16]。广泛用于植物病害防治的木霉菌主要有哈茨木霉(T.harzianum)、绿色木霉(T.viride)和康宁木霉(T.koningii),主要应用于辣椒、番茄和黄瓜等作物上[17],对三七等连作障碍严重的研究较少。课题组前期通过对种植前后的三七根际微生物高通量测序数据分析发现,三七种植后根际木霉菌的相对丰度明显降低,且三七根系分泌的特有物质皂苷对木霉菌菌丝生长具有明显的抑制活性[18]。这可能会极大影响木霉菌在三七根际的定殖效果,导致已有的具有优良促生拮抗活性的木霉菌株在三七根腐病防治中的应用受到限制。但是,目前还未见兼具耐皂苷和拮抗三七根腐菌的木霉菌的相关研究。因此,本研究从植物-根际微生物互作的角度出发,分离筛选出耐皂苷且具有拮抗活性的木霉菌株,并通过盆栽试验明确其促生效果及其对根腐病的防治效果,以期为通过调节木霉菌丰度缓解三七连作障碍提供理论支撑,同时也为三七根腐病的绿色防治提供生防资源。
1 材料与方法
1.1 供试材料
供试土样:供试三七土样均采自云南省昆明市寻甸县。取一年生健康三七植株,抖落根围土壤,用无菌毛刷轻刷三七根系收集土壤,获得三七根际土壤用于后续试验。采集种植过五年三七的连作土壤充分混匀后装于花盆中待用。
供试植株:将三年生三七种子播种于装有灭菌土的花盆中,每盆播种10粒种子,出苗后保持正常的水肥管理,待其生长6个月后用于木霉菌促生防病效果评价。
供试菌株:恶疫霉菌D-1(P.cactorumD-1)、尖孢镰刀菌Z4(F.oxysporumZ4)、茄腐镰刀菌F3(F.solaniF3)、雪腐镰刀菌M(MonographellacucumerinaM)和毁灭柱孢菌RS6(C.destructansRS6)均由云南农业大学生物多样性与病害控制实验室从三七根腐病病株中分离获得,并经过形态和致病性鉴定。
供试培养基:孟加拉红琼脂(Rose bengal agar,RBA)培养基成分:葡萄糖10 g、蛋白胨5 g、磷酸二氢钾1 g、硫酸镁0.5 g、琼脂20 g、孟加拉红0.033 g、氯霉素0.1 g,蒸馏水1 L,pH 7.0~7.2;马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基成分:马铃薯200 g、葡萄糖20 g、琼脂18 g,蒸馏水1 L,pH 6.5~7.0;水琼脂(Water aga,WA)培养基成分:琼脂18 g,蒸馏水1 L,pH 6.8~7.2。
1.2 供试试剂及仪器
真菌基因组DNA快速抽提试剂盒和DNA Marker购自生工生物工程(上海)有限公司,2×TaqPCR Master Mix购自北京擎科生物科技有限公司,其余试剂均为国产分析纯。供试仪器:BX43F光学显微镜(Olympus公司,日本),ZHWY-111B摇床(智诚分析仪器制造有限公司,上海),2720 Thermal cycler PCR仪(赛默飞世尔科技(中国)有限公司,上海),5804R 低温高速离心机(Eppendorf公司,德国),JY300C电泳仪、JYDF电泳槽和JY04S-3C凝胶成像仪(君意东方电泳设备有限公司,北京),DFD-700水浴锅(中兴伟业仪器有限公司,北京),Alpha 1-2 LD plus冷冻干燥仪(Christ公司,德国),DF-20磨粉机(林大机械有限公司,浙江),SY3100DH超声波清洗机(声源超声波仪器有限责任公司,上海),Rotavapor R-200旋转蒸发仪(Buchi公司,瑞士),SLI-700恒温培养箱(爱朗仪器有限公司,上海)。
1.3 方法
1.3.1木霉菌的分离及纯化
称取5 g一年生健康三七根际土,加入盛有45 mL灭菌水的200 mL锥形瓶中,置于摇床上(180 r/min)振荡30 min,静置10 min后得到的上清液即为稀释度为10-1g/mL的土壤悬浮液。用移液枪吸取1 mL土壤悬浮液至装有9 mL无菌水的试管中,使其充分混匀后再按梯度稀释到10-3和10-4g/mL;分别吸取各梯度的稀释液100 μL均匀涂布于RBA平板上,于25 ℃恒温培养箱中培养3 d,挑取平板上菌落边缘的少量菌丝至PDA平板上纯化培养3次,对纯化培养得到的菌株进行编号。挑取形态不同疑似木霉菌的菌株进行培养,待长出菌落后,挑取菌落边缘菌丝转移至另一平板的中央进行反复纯化培养。
1.3.2木霉菌孢子对三七根系分泌物敏感性测定
将分离到的木霉菌株接种于PDA平板上25 ℃黑暗条件下培养,培养10 d后产孢。将一定量的无菌水加入到长满产孢菌丝的培养皿中,用灭菌的涂布器轻轻将孢子和菌丝刮下,用灭菌纱布过滤后再使用500目细胞筛过滤得到木霉菌孢子悬浮液。使用血球计数板在光学显微镜下将孢子悬浮液浓度调整为1.0×106CFU/mL。
将一年生三七植株从土壤中取出,在不伤及根系的前提下,用清水清洗去除根系上附着的土壤颗粒;用灭菌水冲洗3遍,将植株根系放入盛有100 mL无菌水的灭菌组培瓶中,每瓶装入8株三七苗,并使蒸馏水的体积刚好能浸没根系,使用封口膜将瓶口封好。将装有三七苗的组培瓶置于摇床上,培养24 h后取出根系,将收集到的根系分泌物用0.22 μm的有机相滤膜过滤后,于冷冻干燥仪中进行冷冻干燥,得到粉末状根系分泌物固体[19-20]。
将三七根系分泌物粉末溶于无菌水后得到三七根系分泌物,按V(三七根系分泌物)∶V(木霉菌孢子悬浮液)=1∶1比例进行混合,得到终浓度为含0.5和2.5 mg/mL三七根系分泌物的孢子悬浮液;以加入等量无菌水与木霉菌孢子液混合为对照,充分混匀后吸取100 μL均匀涂布于WA平板上。每组处理设置3个重复,将其置于25 ℃黑暗条件下培养18 h后,置于光学显微镜下观察孢子萌发情况。随机选取4个视野进行观察,对视野中的木霉菌孢子总数及萌发孢子数进行计数。孢子萌发率=萌发孢子数/孢子总数×100%。
1.3.3木霉菌对三七皂苷的敏感性测定
参照Yang等[8]方法提取三七粗皂苷。取一年生的三七根部200 g,在40 ℃下烘干36 h,使用打粉机将烘干的三七根研磨至粉状,用800 mL 80%的甲醇提取液超声提取40 min后,进行离心。收集上清液,进行旋转蒸发。所得到的浓缩液冷冻干燥成粉末状固体,并置于4 ℃冰箱保存备用。
参照Zhou等[21]方法将三七粗皂苷样品利用甲醇溶解后添加到已灭菌且冷却至55 ℃左右的PDA培养基中,制成终浓度为1、10、100和1 000 μg/mL的含粗皂苷的PDA平板,以含1%甲醇的PDA平板为对照。挑取木霉菌菌饼(直径4 mm)分别接种于含不同浓度梯度粗皂苷的PDA平板上进行培养。每个处理设置5个重复,置于25 ℃下黑暗培养48 h后采用“十字交叉法”测量木霉菌菌落直径。
菌丝生长抑制率=(对照菌落直径- 处理菌落直径)/对照菌落直径×100%
1.3.4耐皂苷木霉菌的鉴定
将纯化后的耐皂苷木霉菌株25 ℃黑暗培养3和7 d后参考Gams等[22]方法对菌落形态观察记录,并在光学显微镜下观察分生孢子梗和分生孢子的形态特征,初步确定菌株的分类地位。
采用真菌基因组DNA快速抽提试剂盒提取木霉菌基因组DNA。使用真菌通用引物ITS1和ITS4进行菌株rDNA-ITS区的PCR扩增,引物由生工生物工程(上海)公司合成。扩增体系:2×TaqPCR MasterMix10 μL,ITS1引物(10 pmol/μL) 1 μL,ITS 4引物(10 pmol/μL) 1 μL,DNA模板3 μL,ddH2O 10 μL;扩增条件:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测后送至昆明擎科生物科技有限公司进行测序。测序结果上传至NCBI数据库进行BLAST序列比对和同源性分析,其他参考序列从GenBank(https:∥www.ncbi.nlm.nih.gov/genbank)下载;并用MEGA 11软件以邻接法构建系统发育树,设置1 000次Bootstraps检验,进行菌株分子生物学鉴定。
1.3.5耐皂苷木霉菌对三七主要根腐病病原菌拮抗活性测定
挑选2株对三七根系分泌物和粗皂苷均不敏感的木霉菌株作为耐皂苷菌株进行活化,并对三七主要根腐病病原菌恶疫霉菌D-1、毁灭柱孢菌RS6、茄腐镰刀菌F3、尖孢镰刀菌Z4和雪腐镰刀菌M分别进行活化;待生长5 d后,用5 mm灭菌打孔器分别在木霉菌株与根腐病病原菌的菌落边缘打取菌饼;将两者同时接种在同一PDA平板上,2个菌饼之间的距离约为5.5 cm。在一侧接种病原菌,另一侧接种空白PDA菌饼为对照。每个处理设置6个重复,于25 ℃恒温培养箱中黑暗培养3 d后测量根腐病病原菌的菌落半径,并计算木霉菌株对病原菌的抑制率。
抑制率=(对照菌落半径-处理菌落半径)/ 对照菌落半径×100%
1.3.6耐皂苷木霉菌对三七生长的影响效果测定
选取植株长势均一的三七盆栽,使用等量的水充分浇透后放置一晚,次日灌根。将2株耐皂苷木霉菌株大量扩繁产孢后,参照1.3.2中制备孢子悬浮液的方法,制成浓度为5.0×106CFU/mL的木霉菌液进行灌根,每盆灌菌液50 mL,以灌等量无菌水为对照。每个处理设置6个重复,每隔7 d灌1次,共灌4次。将植物置于用聚乙烯网遮荫的大棚中,允许10%~30%的光透射,以模拟三七自然生长条件。最后一次灌菌处理后30 d采集三七植株样品,将三七整株洗净后称量植株地上部和地下部的鲜重,40 ℃烘干至恒重后称量其干重。
1.3.7耐皂苷木霉菌株在根际土中的定殖效果测定
参照赵微等[23]方法将2株耐皂苷木霉菌株分别接种于含10 μg/mL利福平的PDA培养基中25 ℃暗培养2 d。挑取菌落形态与初始菌株相似的单菌落,依次接种于含50、80、100和200 μg/mL利福平的PDA培养基中培养,直至筛选出能在含200 μg/mL利福平的PDA平板上稳定生长的木霉菌株作为标记菌株。
将标记菌株在含200 μg/mL利福平的PDA平板上培养14 d进行产孢,并参照1.3.2中制备孢子悬浮液的方法制成浓度为5.0×106CFU/mL的木霉菌孢子悬浮液,并灌50 mL至连作土中,以灌等量无菌水为对照;放置3 d后移栽三七苗,每盆移栽8株,每一处理设置12个重复。将其置于用聚乙烯网遮荫的大棚中,允许10%~30%的光透射,移栽成活后每隔10 d统计一次存苗率,30 d后统计连作土中三七的根腐发病率,以评价2株耐皂苷菌株对三七连作障碍的缓解效果;同时采集三七根际土对标记的木霉菌株进行定殖检测,根际土中木霉菌的分离方法同1.3.1,得到10-1和10-2g/mL土壤悬浮液后涂布于含200 μg/mL利福平的PDA平板上,25 ℃黑暗培养2 d后进行木霉菌落计数。
1.4 数据分析
利用Excel 2019进行数据处理及图表制作,采用SPSS 26.0软件中Duncan氏新复极差法和独立样本t检验对试验数据进行显著性检验。
2 结果与分析
2.1 耐三七根系分泌物的木霉菌筛选
经分离纯化从一年生健康三七根际土壤中共获得6株木霉菌株,分别命名为T3、T4、T5、T19-1、T20和T25。6株木霉菌株对三七根系分泌物具有不同程度的敏感性(表1),供试浓度的根系分泌物对T3和T20菌株的孢子萌发无显著抑制活性;其余4株木霉菌的孢子萌发均受到高浓度(2.5 mg/mL)根系分泌物的显著抑制。

表1 三七根系分泌物对木霉菌孢子萌发率的影响
2.2 耐三七皂苷的木霉菌筛选
所分离到的6株木霉菌株对三七粗皂苷表现出不同程度的敏感性,抑制率均随培养基中皂苷浓度的增加而升高(表2)。其中菌株T5虽在皂苷浓度为1和10 μg/mL时能显著促进菌丝的生长,但当皂苷浓度为100和1 000 μg/mL时,则显著抑制了菌丝生长,表现出较强的敏感性。浓度为1 000 μg/mL皂苷对菌株T4和T25抑制率分别为14.63%和13.86%;对高浓度皂苷敏感性较弱的为T3和T20菌株,浓度为100 μg/mL皂苷对其抑制率分别为1.63%和1.24%,浓度为1 000 μg/mL皂苷对其抑制率分别为4.56%和7.59%。因此,结合木霉菌对三七根系分泌物及三七皂苷的敏感性结果,选择T3和T20菌株作为耐皂苷木霉菌株进行后续试验。

表2 三七皂苷对木霉菌的抑制率
2.3 耐皂苷木霉菌的鉴定
2.3.1形态学鉴定
T3菌株和T20菌株2株耐皂苷木霉菌在PDA培养基上均生长迅速,3 d便可长满整个培养皿。T3菌株菌落正面呈羊毛毡状,初期为白色,后为绿色,背面后期逐渐由白色变为浅绿色;分生孢子梗细长弯曲,安瓿瓶状,次级分枝对生,可产生大量分生孢子;分生孢子绿色,椭圆形或卵圆形,簇生于小梗顶端(图1(a)~(d))。T20菌株菌丝为绒毛状,菌落形态呈现放射状向四周生长,有规则状轮纹,初为白色,后为淡黄色,且菌饼中央伴有菌丝消退现象;分生孢子梗透明呈瓶梗状多为对称生长,分生孢子浅绿色,椭圆形或卵圆形(图1(e)~(h))。

(a)~(b)PDA培养基上T3菌株菌落的正面和背面形态;(c)~(d)T3菌株的分生孢子梗和分生孢子;(e)~(f)PDA培养基上T20菌株菌落的正面和背面形态;(g)~(h)T20菌株的分生孢子梗和分生孢子。 (a)-(b) Frontal and reverse colony morphologies of T3 strain on PDA medium; (c)-(d) Conidiophores and conidia of T3 strain; (e)-(f) Frontal and reverse colony morphologies of T20 strain on PDA medium; (g)-(h) Conidiophores and conidia of T20 strain.
2.3.2分子生物学鉴定
将T3和T20菌株测序结果输入NCBI数据库进行BLAST比对分析,并通过与NCBI数据库中已登录菌株的ITS序列进行聚类分析发现:T3菌株与T.viride(KC403962.1)位于同一进化分支,T20菌株与T.viridescens(KU896372.1)位于同一进化分支,相似性为100%(图2)。结合形态学特征将T3菌株鉴定为绿色木霉(T.viride),T20菌株鉴定为渐绿木霉(T.viridescens)。

图2 基于ITS序列以邻接法构建三七根际耐皂苷木霉菌及相关近缘种的系统发育树
2.4 耐皂苷木霉菌对三七主要根腐病病原菌的拮抗活性
平板对峙试验结果显示(表3),木霉T3和T20菌株对5种供试三七主要根腐病病原菌均有较好的抑制活性,其中对恶疫霉菌D-1的抑制效果最好,抑制率分别达到61.76%和70.59%。T3菌株对雪腐镰刀菌M的抑制活性最低,抑制率为45.83%,对其余病原菌的抑制率为45.98%~51.29%;T20菌株对尖孢镰刀菌Z4的抑制活性最低,抑制率为36.78%,对其余病原菌的抑制率为45.83%~46.99%。

表3 绿色木霉T3菌株和渐绿木霉T20菌株对三七主要根腐病病原菌的抑制率
2.5 耐皂苷木霉菌对三七的促生效果
使用绿色木霉T3菌液灌根4次后,植株地上部和地下部的单株生物量与浇灌无菌水相比均有所增加,地下部鲜重单株平均增加0.103 g。使用渐绿木霉T20菌液灌根4次后,植株地上部和地下部的生物量也都有所增加,但显著不差异。表明耐皂苷T3和T20菌株对三七植株尤其是地下部分具有一定的促生效果(表4)。
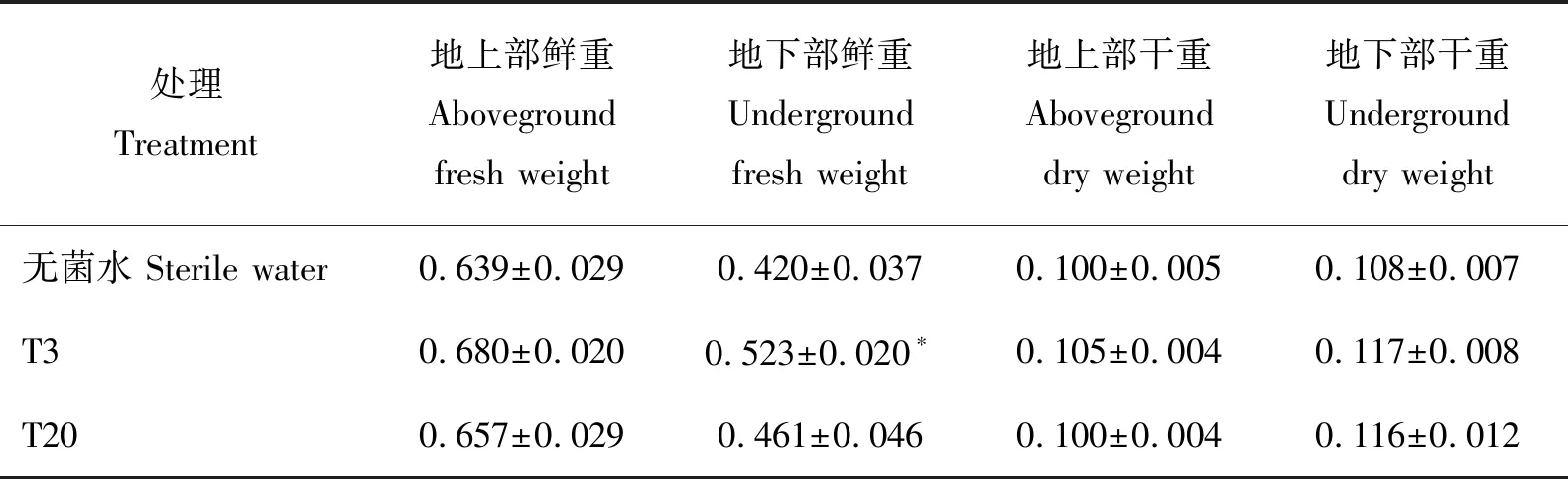
表4 绿色木霉T3菌株和渐绿木霉T20菌株对三七植株生物量的影响
2.6 耐皂苷木霉菌在根际土中的定殖能力及其对三七连作障碍的缓解效果
2.6.1木霉菌在连作土中的三七根际定殖效果
耐皂苷木霉菌T3和T20菌株能在三七根际定殖,但定殖数量随着时间增长表现为降低的趋势(图3)。与培养10 d相比,培养20 d后菌株的定殖量变化不大,但培养到30 d时随着三七的大量死亡以及根腐病的大量发生,根际耐皂苷木霉T3和T20菌株的定殖量也大幅降低,但在根际土中仍有一定的定殖量,且T20菌株降幅比T3菌株小。

图3 三七连作土中耐皂苷木霉T3和T20菌株的定殖量
2.6.2木霉菌对三七连作障碍的缓解效果
由表5可以看出,随三七在连作土中生长时间的延长,存苗率逐渐降低,加入耐皂苷木霉菌后可以明显降低根腐病发生,减轻连作障碍。其中T3菌株在灌根10和30 d后的存苗率均高于对照,存苗率分别为92.21%和28.10%;根腐病发病率显著降低,为35.12%。T20菌株在灌根10和30 d后存苗率均显著高于对照,存苗率分别为97.73%和33.93%,根腐病发病率也明显降低。
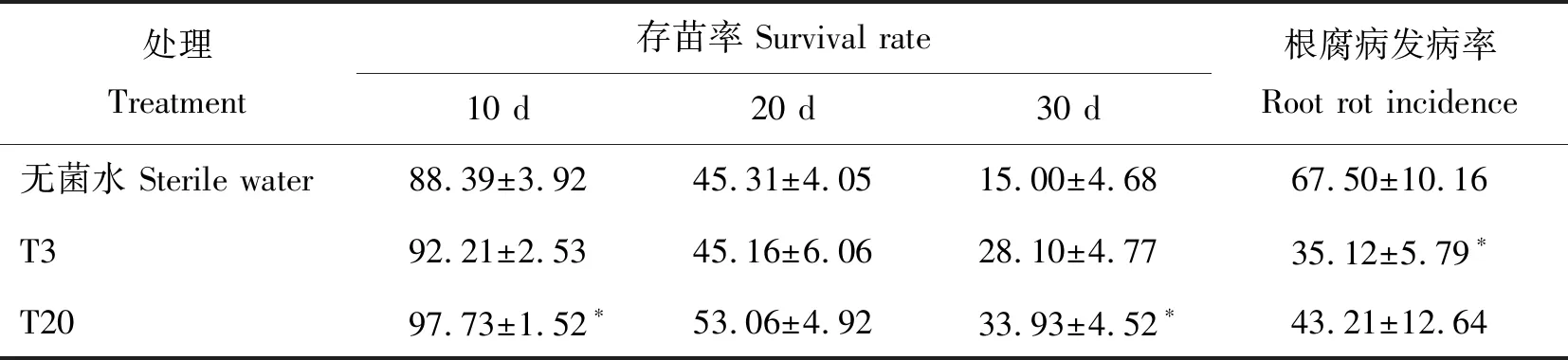
表5 T3和T20菌株对连作土中三七存苗率和发病率的影响
3 讨 论
从土壤中分离筛选抑菌微生物作为作物病害生态防控的生防资源是近年来的研究热点,也是今后绿色植保的重要发展方向之一。本研究发现,从三七根际分离获得的耐皂苷木霉菌株不仅能促进一年生三七的生长,还能明显拮抗主要根腐病病原菌菌丝生长,对缓解三七连作障碍具有较好的应用前景。
木霉菌是一种应用广泛的植物生防促生真菌,能够通过与植物形成共生体、分泌多种酶类和代谢产物提高植物对生物和非生物胁迫的抗性[24]。蒋妮等[25]发现棘孢木霉(T.asperellum)菌株F2采用灌根与叶面喷施相结合的方法能够较好预防三七灰霉病的发生;Chen等[26]发现盖姆斯木霉(T.gamsii)对三七根腐病具有一定的防治效果。上述已报道的2株木霉菌株虽对部分三七病原菌具有较好的拮抗活性,但未对其能否促进植株生长进行测定。Li等[27]研究结果表明木霉菌株能够显著促进三年生三七植株地下部的生长,降低根腐病发病率,但未对其能否缓解连作障碍及其在根际的定殖效果进行评价。本研究筛选获得的2株木霉菌绿色木霉T3和渐绿木霉T20不仅对引起三七根腐病的主要病原菌具有较强的拮抗活性,还能降低连作土中三七根腐病发病率,促进三七植株的生长,具有较好的应用潜力。后续试验亟需对绿色木霉T3和渐绿木霉T20的代谢产物抑菌活性等方面开展深入研究,明确其生防机制,为菌株的进一步开发利用奠定基础。此外,Li等[28]研究发现接种哈茨木霉显著降低了白菜根肿病菌(Plasmodiaphorabrassicae)和致病性链格孢菌(Alternaria)的丰度,同时显著增加了土壤中芽胞杆菌的数量。因此后续研究还需对外源接种木霉菌对三七根际微生物群落的调控作用进行深入研究,以解析木霉菌缓解三七连作障碍的微生态机制。
植物根系分泌物为根际微生物提供所需能源的同时,还直接影响着根际微生物的数量和种群结构[29]。课题组前期研究发现,三七根系分泌物能够促进根腐病病原菌在根际增殖,而抑制木霉菌和芽孢杆菌等有益菌的生长[18]。本研究发现,三七根际分离到的6株木霉菌株中,仅有2株的孢子萌发未受到三七根系分泌物的显著抑制,表明大部分三七根际木霉菌对三七根系分泌物较敏感。皂苷是三七根系分泌物中的特有成分,且能通过残体降解的方式以较高的浓度存在于三七根际土壤中[8]。本研究进一步测定了供试6株木霉菌株对皂苷的耐受性,结果显示,不同木霉菌株对三七皂苷表现出的敏感性有所差异,部分菌株在低浓度皂苷下可利用其生长,但随着皂苷浓度的升高,抑制效果逐渐增强,其中绿色木霉T3菌株和渐绿木霉T20菌株在较高的皂苷浓度下生长几乎不受影响,表明三七根际存在少数耐皂苷的木霉菌株。已有研究也显示,根系分泌的人参皂苷在低浓度下(0.2~20.0 mg/L)下能抑制哈茨木霉菌的菌丝生长[30-31],但也存在部分具有皂苷耐受性的木霉菌株。李翟等[32]从人参根际土中分离到1株可对20 mg/L的人参总皂苷溶液表现出显著正趋化作用的绿色木霉菌株,这一结果与本研究结果一致。但是,本研究结果也表明,在连作土中接种木霉菌30 d后,随着三七植株的大量死亡,木霉菌在三七根际的定殖量也大幅下降,与前期研究发现相较于未感病的三七根际土,发生根腐病的三七根际土中木霉菌的相对丰度显著降低的结果一致[33-34],因此,需要及时外源添加木霉菌以达到持续有效缓解三七连作障碍的效果。同时,后续研究还需对筛选获得的耐皂苷菌株对皂苷的耐受机制开展研究,以深入解析耐皂苷木霉菌株在三七根际的定殖机制,从而更好地发挥木霉菌在三七病害生态防控中的作用。
4 结 论
本研究从健康三七根际土壤中分离获得2株耐皂苷木霉菌绿色木霉T3和渐绿木霉T20,其不仅对三七具有较好的促生效果,还能明显抑制三七主要根腐病病原菌生长,对三七连作障碍具有一定的缓解效果,具有良好的生防潜力。
