外源茉莉酸对燕麦在不同干旱胁迫下转录组的影响
2023-07-15张志芬付晓峰崔思宇刘俊青杨海顺
张志芬 付晓峰 崔思宇 福 英 刘俊青 杨海顺
(1.内蒙古自治区农牧业科学院 特色作物研究所,呼和浩特 010031; 2.兴安盟农牧科学研究所 作物育种与栽培研究室,内蒙古 乌兰浩特 137400)
干旱问题是影响作物生长并导致减产最为普遍的非生物胁迫因子之一[1],燕麦主要种植在干旱和半干旱地区,干旱是限制燕麦产量的主要因素。干旱导致燕麦结实率下降[2],株高变矮,叶片数、主茎数、穗数减少,叶片失绿发黄导致籽粒产量显著下降[3]。干旱胁迫下(土壤相对含水量为45%),燕麦内源激素脱落酸(ABA)、茉莉酸(JA)和水杨酸(SA)含量均显著升高,生长素(IAA)含量显著降低,脯氨酸(Pro)、可溶性糖、腐胺(Put)和亚精胺(Spm)含量也均显著升高[4],外源腐殖酸可以通过调控内源激素的含量来影响燕麦的衰老过程[5]。由此可见,基于激素调控的燕麦抗旱性研究具有重要意义。
植物遭受干旱胁迫,激素作为信号分子大量累积,并诱导机体发生复杂的生物化学反应来激活自身免疫系统,以应对环境的胁迫;茉莉酸(jasmonic acid,JA)是一种已被公认的新型植物生长调节剂[6]。在干旱胁迫下,番茄幼苗根和叶中内源性ABA、JA和游离多胺的浓度以及多胺氧化酶(PAO)活性均显著高于对照组[6]。干旱胁迫后小麦各器官内源JA和ABA含量显著增加,而赤霉素(GA)和细胞分裂素(CTK)含量显著降低[7]。施用外源JA可以提高作物的产量,如外源MeJA可以显著改善干旱胁迫下小麦籽粒灌浆参数,如有效灌浆持续时间和理论最大粒重都显著升高,促使更多同化产物向籽粒转运,可以部分弥补干旱胁迫造成的减产[7-8]。外源JA对非生物胁迫下作物光合特性、渗透调节物质等生理特征有显著影响[9-14]。中度和重度干旱条件下,外源MeJA可影响甜菜相对含水量和水分利用效率,以及脯氨酸积累[15];可增强玉米根系水通道蛋白的表达,进而提高幼苗根系吸水能力,从而缓解干旱胁迫造成的叶片水分含量下降和水势降低,提高玉米幼苗的抗旱性[14]。
转录组测序已被广泛用于解析作物抗旱机制[16],可以通过生理指标与转录组联合分析推测抗逆机制,初步筛选出抗逆相关代谢通路的关键基因,为抗逆基因的克隆和验证奠定基础。王志恒等[17]基于转录组学探究甜高粱响应干旱与盐胁迫的生理学差异及其分子机制,为甜高粱抗逆栽培和育种提供依据。目前,基于转录组揭示燕麦抗旱机理的研究鲜见报道。本研究以燕麦为材料,通过转录组测序利用GO和KEGG分析不同模拟干旱胁迫下,外源JA主要影响的代谢通路,旨在探究外源JA对不同干旱胁迫处理的燕麦生长发育过程中代谢途径的影响,以期为筛选燕麦响应干旱的关键基因提供参考。
1 材料与方法
1.1 材料及处理
选用抗旱品种‘蒙燕1号’为材料,采用盆栽进行培养,基质为陶粒,室温培养,出苗7 d后,进行轻度(QD,PEG-6000,0.017 mol/L)、重度(ZD,PEG-6000,0.034 mol/L)干旱胁迫处理,以蒸馏水为对照(CK);同时进行干旱胁迫添加1.0 mmol/L JA处理,轻度干旱胁迫加JA(QDA)和重度干旱胁迫加JA(ZDA),对照加JA(CKA),每个处理设置3个重复,每个重复种植6盆,处理7 d,对QD、ZD、CK以及QDA、ZDA、CKA处理燕麦叶片进行转录组测序。
1.2 RNA测序及分析
Trizol法提取总 RNA,质检合格后建库测序,对原始数据进行质控后得到clean reads用于后续分析。根据HISAT2的比对结果,我们利用Stringtie[18]重构转录本,并利用RSEM[19]计算每个样本中所有基因的表达量,筛选FDR<0.05、|log2FC|>1的基因为显著差异基因。参考基因组为2020年6月23日公开发布的六倍体皮燕麦基因组,网址为https:∥wheat.pw.usda.gov/jb/?data=/ggds/oat-ot3098-pepsico[20]。
1.3 实时荧光定量 PCR(RT-qPCR)分析
为验证RNA-seq检测到DEGs,对8个重点基因进行RT-qPCR分析。燕麦Pepsico2_Contig1856.path1(过氧化物酶体(S)-2-羟基酸氧化酶GLO1)为内参基因,该基因不同处理表达量均较高,而且相对稳定,引物序列见表1,用2-ΔΔCT方法计算试验样本中各基因相较于对照样本中各基因的相对表达量变化,使用GraphPad Prism 7.0计算标准差(SD)及P。

表1 RT-qPCR 所用引物
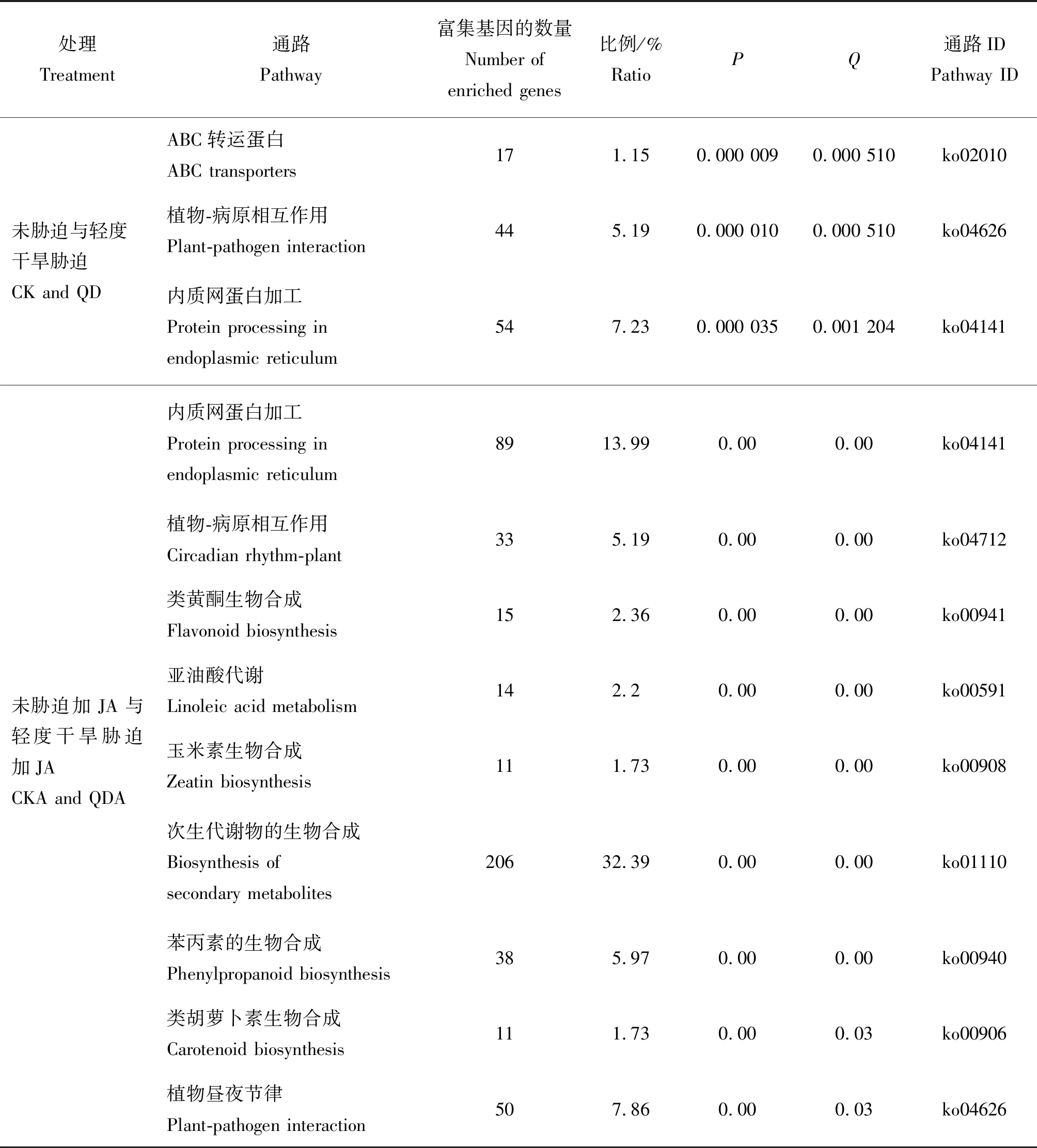
表2 CK与QD、CKA与QDA的DEGs在KEGG显著富集的代谢途径
2 结果与分析
2.1 转录组分析
由图1可知,基于差异分析结果,筛选FDR<0.05、|log2FC|>1的基因为显著差异基因(DEGs),CK与QD相比较共获得624个DEGs,CK与ZD共获得13 053个DEGs,QD与ZD共获得10 850个DEGs。CK与CKA相比较共获得6 621个DEGs,其中1 955个上调,4 666个下调;QD与QDA,共获得2 507个DEGs,其中1 574个基因上调,933个基因下调;ZD与ZDA共获得679个DEGs,其中223个上调,456个下调,CK与CKA处理的基因表达量显著高于其他2组,-log10(FDR)为0~100,QD与QDA-log10(FDR)为0~30,ZD与ZDA-log10(FDR)为0~20。
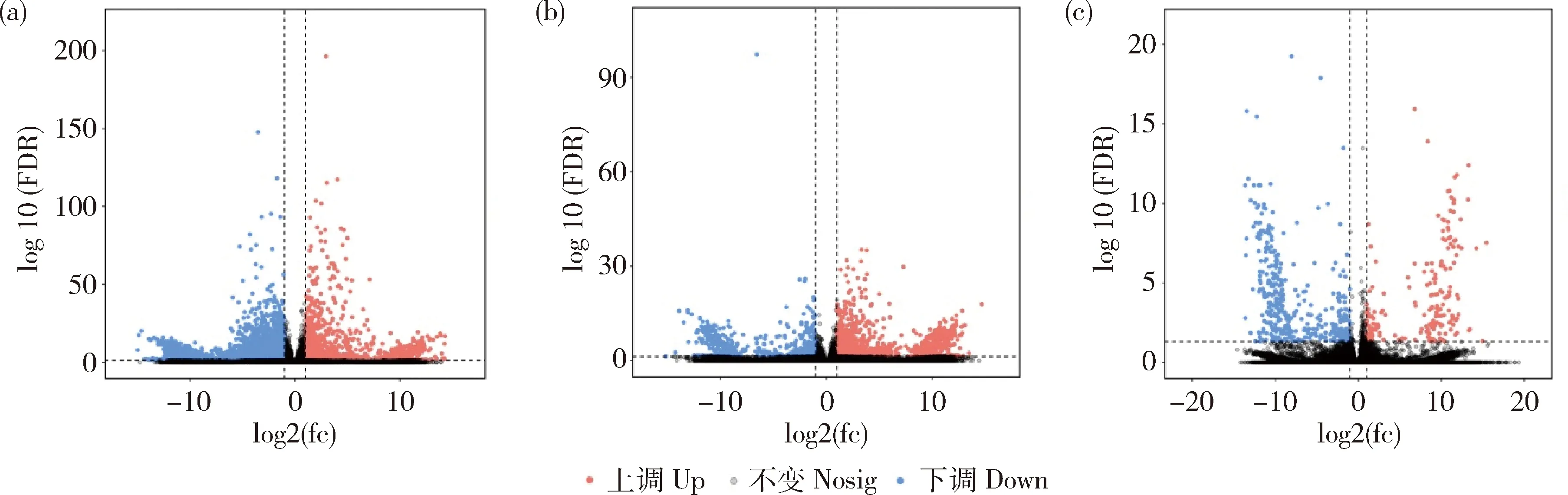
(a)未胁迫与未胁迫加JA;(b)轻度干旱胁迫与轻度干旱胁迫加JA;(c)重度胁迫与重度干旱胁迫加JA (a) Unstressed and unstressed plus JA; (b) Mild drought stress and mild drought stress plus JA; (c) Severe stress and severe drought stress plus JA
DEGs分别注释到生物过程(biological process,BF)、细胞组分(cellular component, CC)和分子功能(molecular function,MF)3 个子类,其中BF基因表达发生显著变化的数量高于其他2个子类。QD与QDA(图2)上调基因的数量高于下调的,而CK与CKA(图3)和ZD 与 ZDA(图4)下调基因的数量高于上调的。
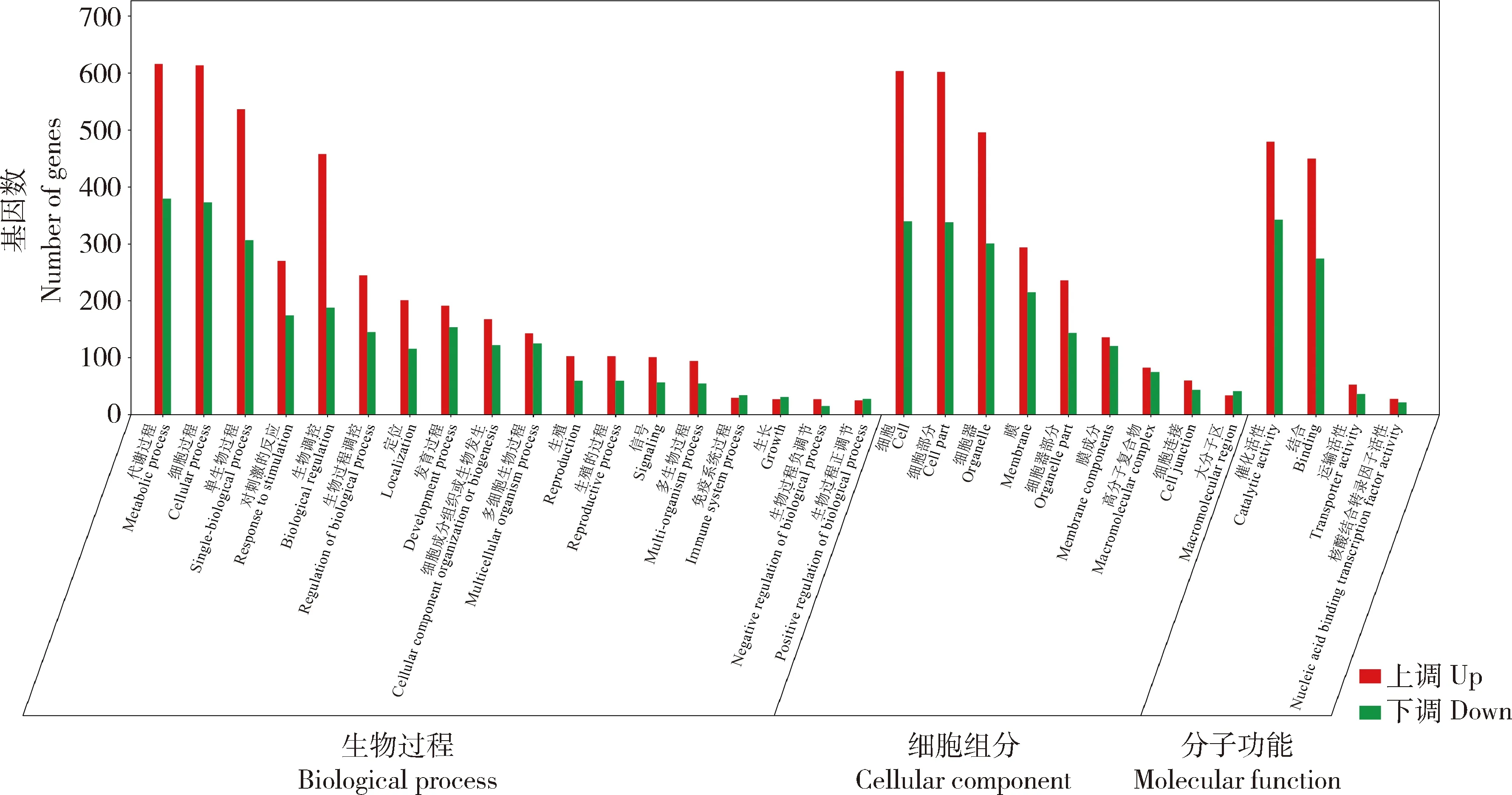
图2 轻度干旱胁迫和轻度干旱胁迫加JA处理燕麦基因表达GO富集分类
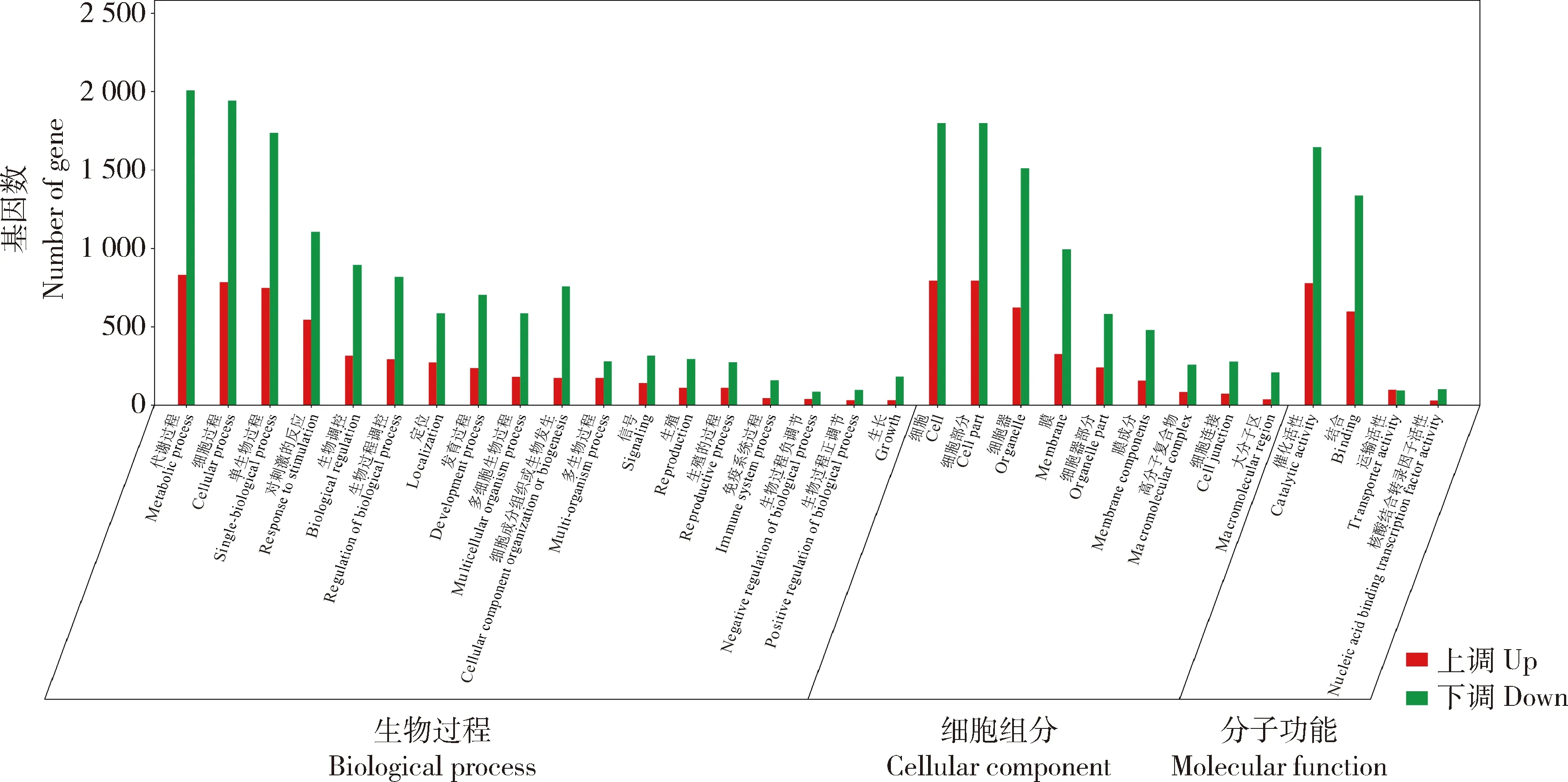
图3 未胁迫(CK)和未胁迫加JA处理燕麦基因表达GO富集分类
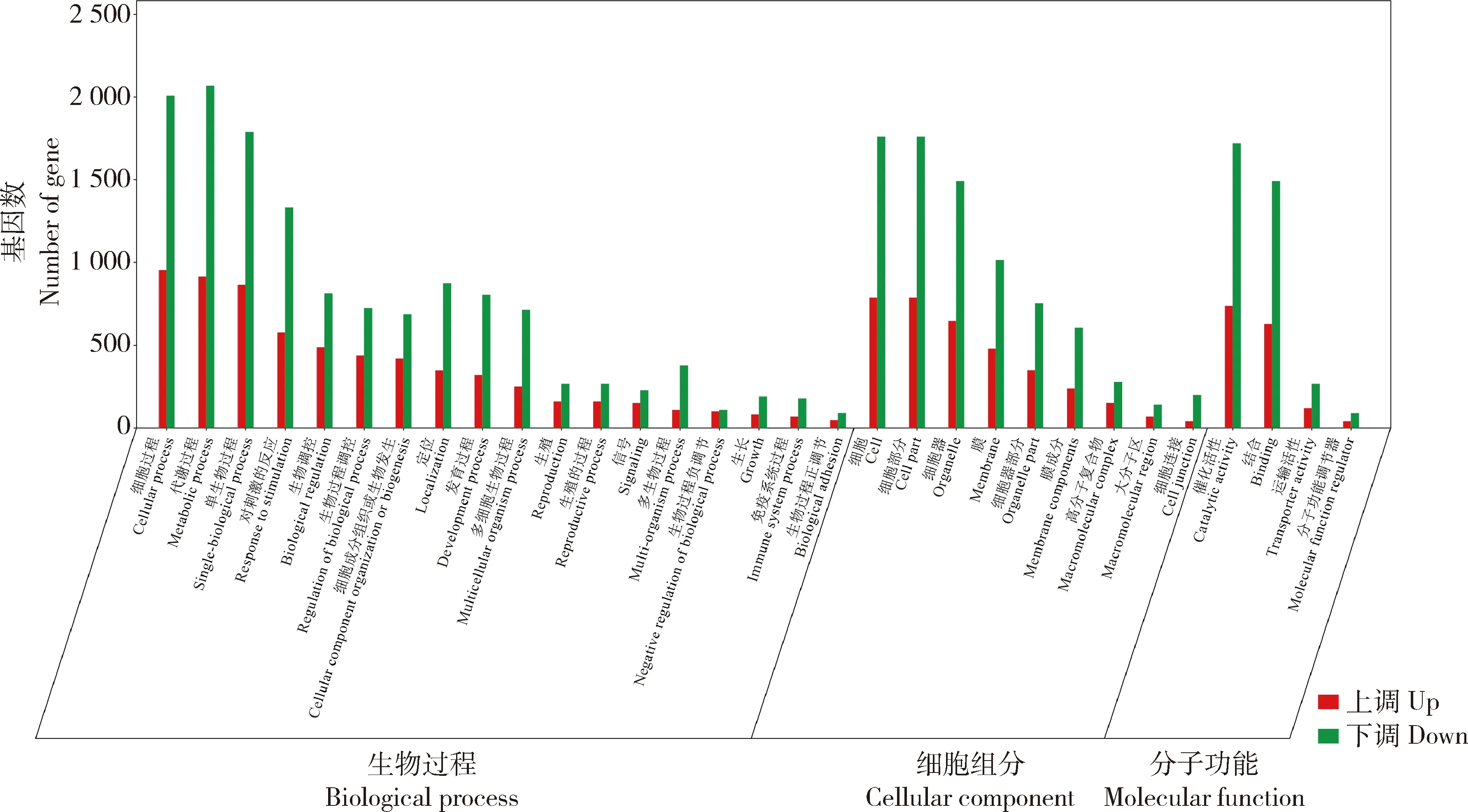
图4 重度干旱胁迫和重度干旱胁迫加JA处理燕麦基因表达GO富集分类
对所有DEGs进行KEGG功能注释,DEGs富集的代谢途径主要为全局和概述图谱,糖代谢、脂类代谢、氨基酸代谢、其他次级代谢物的生物合成、能量代谢、其他氨基酸代谢。
2.2 JA对未胁迫处理转录组的影响
CK与CKA的GO功能富集分析,CC组分DEGs显著富集在15个词条(P<0.05和Q<0.05,下同),富集较多基因的词条为细胞(GO: 0005623)、细胞部分(GO: 0044464)、细胞器膜(GO: 0016020),1 315个DEGs,占CC总DEGs(3020个)43.53%,见图3。MF组分DEGs显著富集在49词条,富集较多基因的词条是催化活性(GO:0003824),2 426 个DEGs,占MF总的DEGs(3 310个)的73.29%,其次是结合(GO:0005488),富集1 938个DEGs,转移酶活性(GO:0016740),富集936个DEGs,占MF总的DEGs 28.28%(图3)。BP组分DEGs显著富集在205个词条,富集较多基因的词条是代谢过程(GO:0008152)、细胞过程(GO:0009987)、单生物过程(GO: 0044699)和对刺激的反应(GO:0050896),对刺激的反应富集1 648个DEGs,占BP总DEGs(3 513个)的46.91%(图3)。
由图5可知,CK与CKA的KEGG功能富集分析,DEGs主要富集在代谢途径、次生代谢的生物合成和苯丙素的生物合成,分别占总的DEGs的59.69%、39.88%和10.50%。苯丙素的生物合成代谢中有122个DEGs,其中18个上调,104个下调,下调基因占85.24%,主要为木质素的生物合成基因。苯丙氨酸解氨酶基因Pepsico1_Contig31055.path1(ZB8)表达上调,log2FC为11.9。过氧化物酶基因MSTRG.25991(PER72)、MSTRG.24809(GSVIVT00023967001)和MSTRG.1931(PRX74)表达下调,log2FC分别为11.0、10.6和10.5,上述4个基因表达量较高。α-亚麻酸代谢通路中17个基因显著上调,其中ACX基因Pepsico1_Contig13785.path1(ACX1) log2FC为12.8。光合天线蛋白通路中富集25个LHCB1,其中24个下调。植物激素信号转导通路IAA和CTK通路显著富集,其中IAA通路中富集25个DEGs,22个下调,主要为AUX和AUXIAA;CTK通路富集13个DEGs,其中12个下调,且表达量较高。

图5 CK与CKA的KEGG 富集分析
2.4 JA及轻度干旱胁迫对转录组的影响
CK与QD的KEGG富集分析,DEGs主要富集在ABC转运蛋白、植物-病原相互作用和内质网蛋白加工3条代谢途径显著富集。CKA 与 QDA,除了内质网蛋白加工、植物-病原相互作用显著富集外,还显著富集在植物昼夜节律、类黄酮生物合成、亚油酸代谢、玉米素生物合成、次生代谢物的生物合成、苯丙素的生物合成、类胡萝卜素生物合成代谢通路。其中玉米素生物合成代谢通路中2个UGT73E1下调,log2FC均为-9.2,4个UGT73C5 上调,4个CKX11均下调,见图4。
由图6可知,QD与QDA的GO功能富集分析,CC组分里DEGs主要富集在12个词条,膜富集507个DEGs,占CC总的DEGs(1 079个)46.99%。MF组分DEGs显著富集在11 个词条,催化活性富集175个DEGs,占MF总的DEGs(1 148个)的15.24%。BP组分DEGs显著富集在74 个词条,对刺激的反应富集643个DEGs,占BP总的DEGs(1 266个)的50.79%。
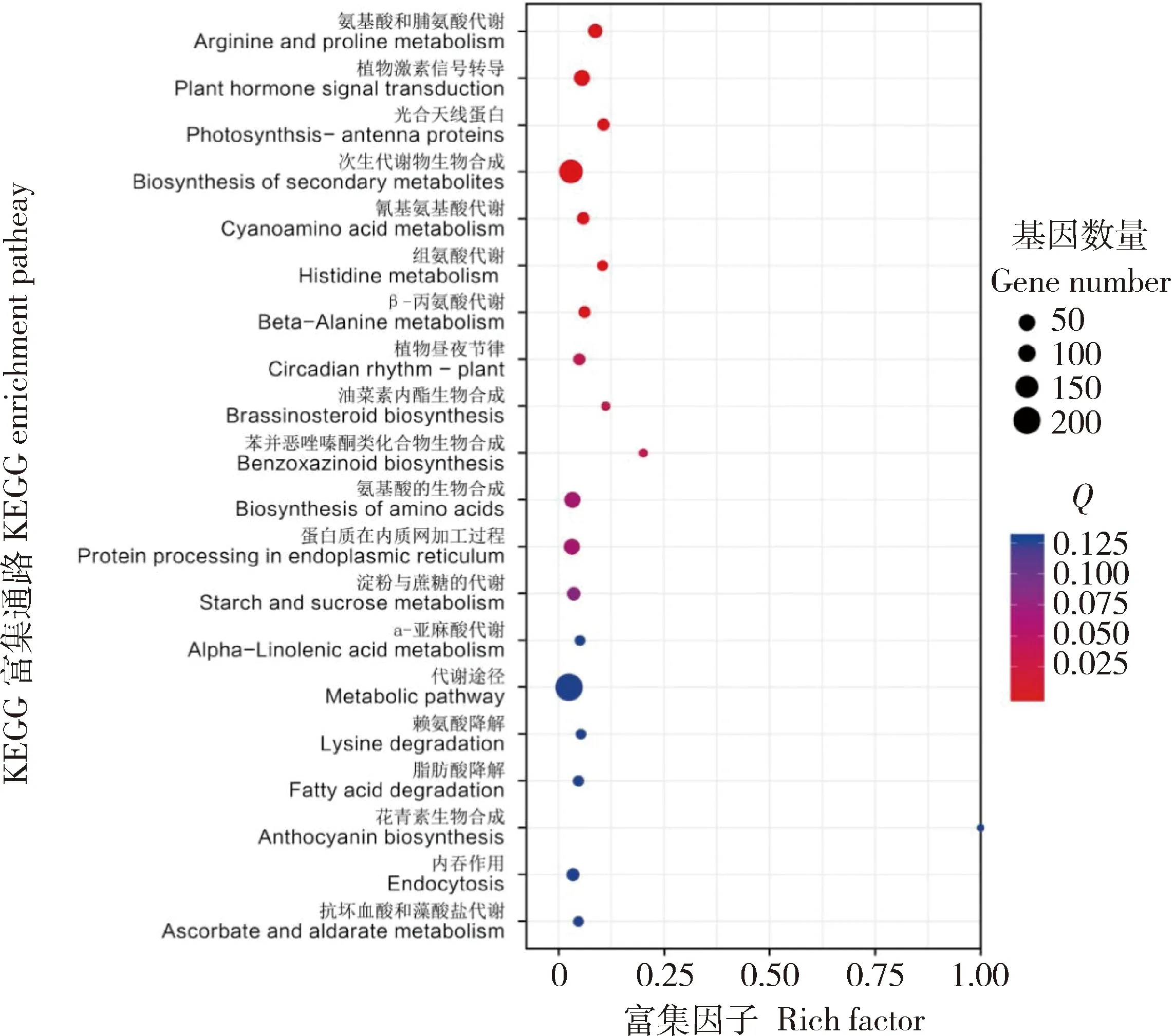
图6 QD与QDA的KEGG富集分析
QD 与 QDA的KEGG功能显著富集分析结果,DEGs主要富集在次生代谢的生物合成、植物激素信号转导、精氨酸和脯氨酸代谢,分别占总DEGs的34.5%、9.3%和6.76%,另外光合天线蛋白和其他氨基酸代谢、植物昼夜节律通路DEGs显著富集,见图6。
QD 与 QDA植物激素信号转导通路富集DEGs 40个,其中生长素信号转导通路富集1个ARF,log2FC为-1.2,1个GH3.8(Pepsico1_Contig15958.path1),log2FC为9.6。细胞分裂素信号转导通路富集5个CRE1和1个A-ARR,log2FC为-1.3~-2.3。赤霉素信号转导通路富集的3个TF,log2FC为-1.4~-1.6。脱落酸信号转导通路富集的DEGs 19个,占植物激素信号转导通路总DEGs的47.5%,基因表达均表现为上调,13个PP2C,log2FC为1.2~2.3,2个SnRK2,log2FC为1.1~1.2,4个ABF,log2FC为1.1~2.0。乙烯信号转导通路富集1个ETR,表达下调,log2FC为1.0,1个EIN3基因表达上调,log2FC为11.7。油菜素甾醇信号转导通路富集2个TCH4,1个上调,log2FC为2.8,1个下调,log2FC为-5.2。JA信号转导通路富集3个JAR1,Pepsico1_Contig14072.path1(GH3.5),log2FC 为-10.2,Pepsico1_Contig18804.path1(GH3.12)和Pepsico1_ Contig30333.path1(GH3.3)log2FC均为9.6。水杨酸信号转导通路富集2个NPR1和1个PR-1,Pepsico1 _Contig17697.path1(NPR2)和Pepsico1_Contig29039.path1(NPR2) log2FC均为8.6,MSTRG.71428(PR M S) log2FC为1.0。
QD 与 QDA精氨酸和脯氨酸代谢富集DEGs 29个,27个上调,2个下调,为酰胺酶基因。13个吡咯啉5羧酸合成酶(P5CS)基因表达均上调,log2FC为1.7~6.0,其中Pepsico1_Contig19083. path2 (P5CS2)和Pepsico1_Contig 24641.path1(P5CS2)log2FC为6.0。多胺氧化酶基因Pepsico1_Contig 5595.path2 (MPAO1)表达上调,log2FC为12.9。脯氨酰4-羟化酶基因Pepsico1_Contig3102.path3(P4H6)和天冬氨酸氨基转移酶基因Pepsico1_Contig10623.path3(ASP1)表达均上调,log2FC分别为9.3和9.8;6个醛脱氢酶基因表达均上调,其中Pepsico1_Contig2025 9.path1(ALDH3I1) log2FC为9.2。
2.5 JA和重度干旱胁迫对转录组的影响
由图7可知,CK与ZD的基因KEGG功能富集分析结果显示,DEGs主要富集在23个代谢通路,分别为次生代谢物的生物合成、苯丙素生物合成、植物激素信号转导、淀粉和蔗糖代谢、内质网蛋白加工、植物-病原相互作用、谷胱甘肽代谢、α-亚麻酸代谢、亚油酸代谢、单萜生物合成、脂肪酸伸长、角质、苏氨酸和蜡质的生物合成、脂肪酸降解、氰基氨基酸代谢、ABC转运蛋白、丙氨酸、天冬氨酸和谷氨酸代谢、真核生物中的核糖体生物发生、2-氧羧酸代谢、植物昼夜节律、类黄酮生物合成、葡萄糖苷酸生物合成,精氨酸和脯氨酸代谢、甘油磷脂代谢。其中α-亚麻酸代谢11个基因上调,12个基因下调,LOX2S和MFP2、茉莉酸O-甲基转移酶基因均下调。
由图8可知,CKA与ZDA的KEGG功能富集分析中DEGs主要富集在11个代谢通路,亚油酸代谢、次生代谢物的生物合成、玉米素的生物合成、苯丙素生物合成、氰基氨基酸代谢、萜类主链生物合成、硫胺素代谢、内质网中的蛋白质加工、托烷、哌啶和吡啶生物碱生物合成、淀粉和蔗糖代谢、半萜类和三萜类生物合成。其中玉米素的生物合成途径中N-糖基转移酶基因(Pepsico1_Contig19945.path1(UGT73C5))上调,4个细胞分裂素氧化酶基因Pepsico1_Contig 10297. path1(CKX11)下调。
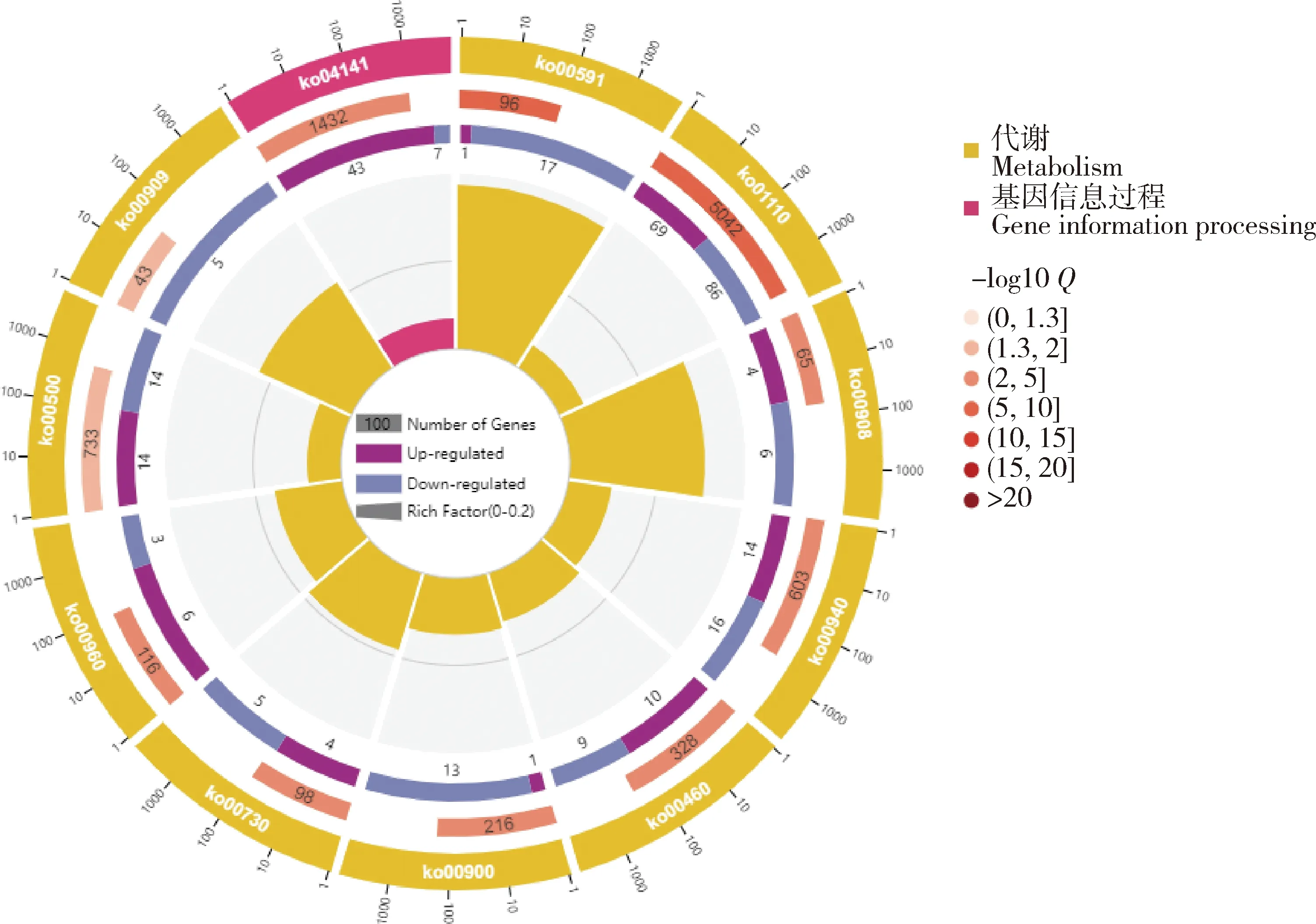
ko00908,玉米素的生物合成;ko00900,萜类主链生物合成;ko00730,硫胺素代谢;ko00960,托烷、哌啶和吡啶生物碱生物合成;ko00909,半萜类和三萜类生物合成。 ko00908, zeatin biosynthesis; ko00900, terpene main chain biosynthesis; ko00730, thiamine metabolism; ko00960, biosynthesis of tropane, piperidine and pyridine alkaloids; ko00909, semiterpene and triterpenoid biosynthesis.
由图9可知,ZD与ZDA,GO功能富集分析,CC组分里膜显著富集149个DEGs,占CC总DEGs(299个)49.83%。MF组分DEGs显著富集在5 个词条,在MF组分转移酶活性富集20个DEGs,占MF总DEGs(328个)的6.1%。BP组分DEGs显著富集在58个词条,单生物细胞突起(GO:0044763)、对刺激的反应,分别有224和192个DEGs,分别占BP总DEGs(362个)的61.88%和53.04%。
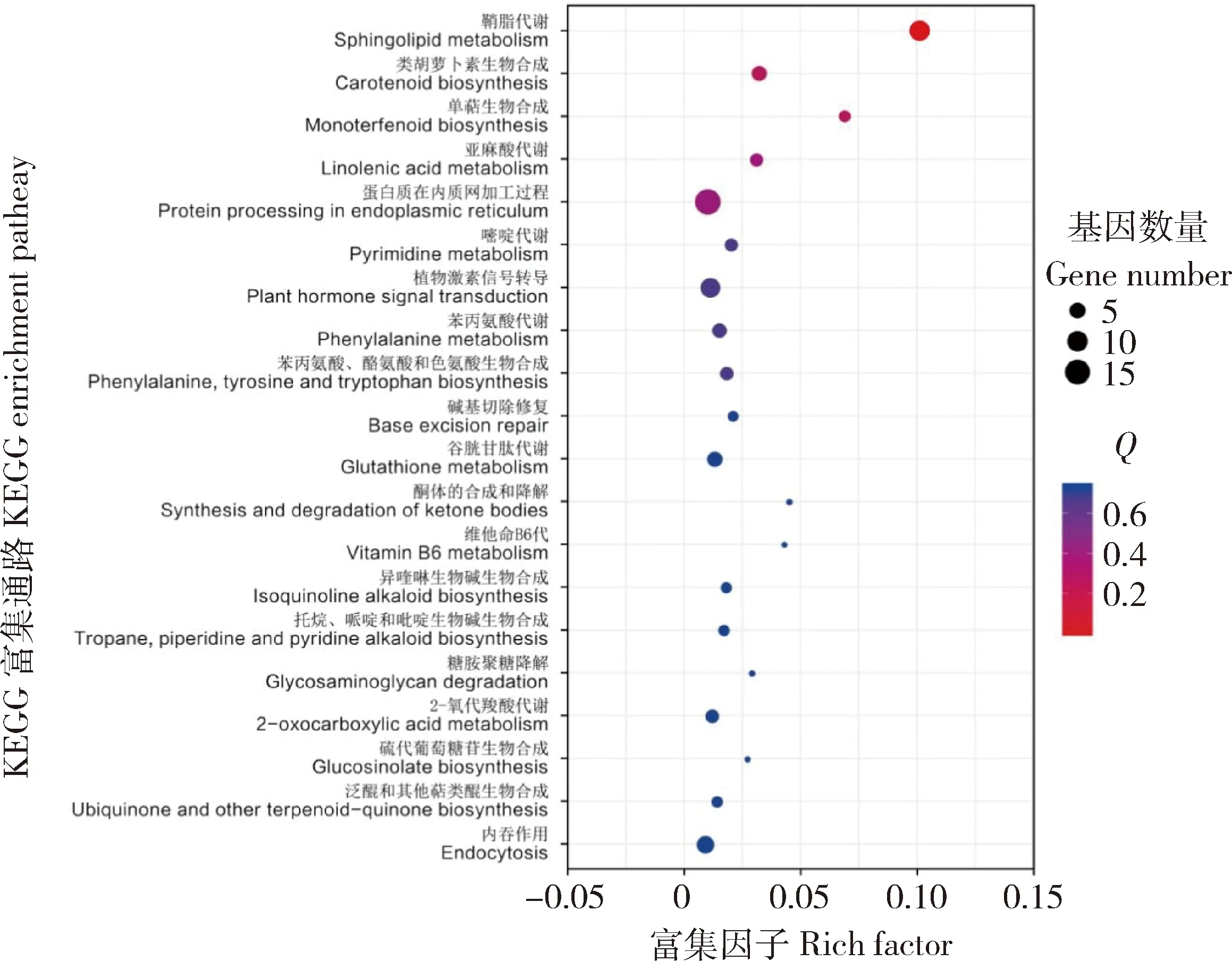
图9 ZD 与 ZDA 的KEGG富集分析
ZD与ZDA的KEGG富集前20通路中只有鞘脂代谢通路基因表达发生显著变化,富集基因9个,占总DEGs的7.44%,均下调。富集丝氨酸棕榈酰转移酶基因6个,log2FC为-2.3~-4.6,其中MSTRG.76144(Os01 g0928800)log2F为-4.6;富集鞘氨醇碱基N-棕榈酰转移酶基因2个Pepsico1_Contig12909.path1(Os02 g0581300)和Pepsico1_Contig24178.path2 (Os02 g05813 00),log2FC均为-9.9;富集β-半乳糖苷酶基因1个,Pepsico1_Contig31689.path1(lacZ),log2FC为-7.6。
2.6 不同干旱胁迫处理下JA均能诱导的基因
由图10可知,3组不同处理共有10个基因表达均发生了显著变化,其中包括3个THI1.3和3个AT1G71250基因, CK和QD条件下,JA诱导上述6个基因表达上调,ZD条件下,JA诱导上述6个基因表达下调。

图10 韦恩图(a)和重叠基因及表达量(b)
2.7 DEGs的RT-qPCR验证
Pepsico1_Contig2520.path2(ARF,ADP核糖基化因子)、Pepsico2_Contig10105.path1(GH3.5,茉莉酸-酰胺合成酶JAR1亚型X2)、Pepsico2_Contig12697.path1(MPK6, 丝裂原活化蛋白激酶)、Pepsico1_Contig30614.path1(ACX1,过氧化物酶体酰基辅酶A氧化酶1异构体X1)、Pepsico1_Contig24949.path1(GID1,赤霉素不敏感基因dwarf 1)和Pepsico2_Contig 11866. path1(MFP2,乙二醛脂肪酸β-氧化多功能蛋白MFP-a异构体X1)在重度干旱胁迫下均显著上调,Pepsico2_Contig15385.path1(BZR2,油菜素内酯信号转导的核心转录因子)不同处理之间差异不显著,Pepsico1_Contig26945.path2(EBF2,EIN3结合F-box蛋白)轻度干旱胁迫处理显著下调(图11)。8个基因中的7个和转录组测序的结果一致。
3 讨 论
植物受到伤害时,植物体内茉莉酸及其衍生物的含量显著增加,进而诱导一系列与抗逆相关的基因表达[21]。张志芬等[4]研究表明干旱胁迫下,燕麦叶片JA含量显著升高。玉米内源JA的缺少能够减少水分损失,提高在干旱条件下的生存能力[22]。已有研究表明外源JA可以提高水稻[21]、小麦[7]的抗旱性。
外源JA诱导干旱胁迫下小麦内源JA含量显著升高,激活抗氧化酶系统酶活[7]。本研究结果发现,在未胁迫条件下,外源JA诱导燕麦叶片叶绿体中的光合天线蛋白基因、IAA和CTK信号转导通路基因表达下调,α-亚麻酸基因表达显著上调,因此推测,正常条件下外源JA通过调控燕麦光合作用、以及IAA和CTK的信号转导来抑制燕麦植株的株高,同时诱导内源JA的合成,干旱胁迫引发JA信号传导,介导植物胁迫反应;此外,Jang等[23]的研究表明,JA参与了干旱胁迫下根系发育的调节,如JA促进了拟南芥根中木质部细胞分化,因此推测正常条件施用JA可能提高燕麦的抗旱性。植物苯丙素代谢作为植物重要的次级代谢途径之一,其代谢产物例如木质素、香豆素、肉冠醛等,在调控植物适应性生长的过程中发挥着重要功能[24],其中苯丙氨酸解氨酶(PAL)和苯丙氨酸/酪氨酸氨裂解酶(PTAL)是木质素合成代谢过程中的关键酶,PAL催化植物体内多种具有防御功能的化合物合成,对于植物的生长发育具有重要的意义[25],如参与植物的生长、发育、抗逆等重要生理活动,可以被环境胁迫和植物信号分子激活表达[25]。MeJA处理能提高白及(Bletillastriata)的PAL酶活[25]。已知PAL在转录水平上受到调节,以响应逆境胁迫,例如特定组织对木质素的需求[26]。植物细胞中木质化程度与木质素的含量有关,细胞壁的厚度增强可以形成具有疏水环境的机械屏障,抵抗病原菌的入侵,而植物通过调控苯丙烷类代谢途径的关键酶PAL产生木质素[27]。本研究表明,未胁迫条件下,外源JA诱导燕麦苯丙素生物合成代谢过程中的基因表达发生显著变化,主要表现为下调,因此,未胁迫条件下外源JA通过抑制木质素的合成抑制燕麦植株株高。
张志芬等[4]研究表明,与田间最大持水量的75%相比(CK),土壤田间最大持水量的45%的燕麦叶片ABA、JA、SA、脯氨酸(Pro)、可溶性糖、腐胺(Put)、精氨酸(Spm)含量均显著升高,IAA含量则显著降低[4]。本研究结果表明,燕麦在轻度干旱胁迫下,外源JA主要诱导次生代谢物的生物合成、植物激素信号转导以及精氨酸和脯氨酸代谢通路基因的表达发生显著变化,由此说明,轻度干旱胁迫下,外源JA作为正调控因子,通过调节燕麦内源激素和渗透调节物质来缓解干旱胁迫。拟南芥PP2Ca受到模拟干旱处理后其表达量显著降低[28]。本研究结果表明,植物激素信号转导通路中47.5%的DEGs富集在ABA信号转导通路,鉴定出13个PP2C,均表现为上调。已对陆地棉的研究表明,干旱胁迫条件下GH3基因表达上调;通过病毒诱导的基因沉默(VIGS)对Gh_A08G1120 (GH3.5)的功能鉴定表明,GH3基因在植物适应干旱胁迫过程中发挥着重要的作用[29]。本研究结果显示GH3基因参与IAA和JA信号转导,燕麦在干旱胁迫下外源JA诱导植物激素信号转导中GH3表达量最高。精氨酸和脯氨酸是响应干旱胁迫的主要渗透调节物质,本研究结果表明,外源JA诱导精氨酸和脯氨酸代谢通路基因的表达显著上调,其中包括13个吡咯啉5羧酸合成酶(P5CS);多胺氧化酶基因Pepsico1_Contig5595.path2(MPAO1)的表达量最高。因此,轻度干旱胁迫下,外源JA通过调控燕麦内源激素信号转导和渗透调节物质(精胺和脯氨酸)的积累来增加燕麦的抗旱性。
本研究结果表明,重度干旱胁迫诱导几乎所有代谢基因表达均发生显著变化,燕麦生长受到胁迫的影响严重;重度干旱胁迫下施用JA,表达发生显著变化的基因较少,外源JA无法缓解重度干旱胁迫导致的伤害。鞘脂分子通过增强植物质膜和液泡膜的稳定性来促进植物对干旱胁迫的适应[30]。本研究表明,重度干旱胁迫后施用外源JA处理可诱导燕麦鞘脂代谢通路基因表达显著低于对照和轻度干旱胁迫。植物中鞘脂的功能目前还不很清楚,但是它们在膜稳定性、细胞信号转导、抗逆反应和程序性细胞死亡进程中都发挥着重要作用[31-32]。关于燕麦鞘脂代谢以及外源JA对鞘脂代谢的影响有待进一步研究。
在植物糖基转移酶大家族中,多基因家族尿苷二磷酸糖基转移酶(uridine dipfosphate glycosyltrans ferase, UGT)成员最多,广泛参与植物生长发育调控、逆境响应等生理过程;UGT73C5为CTK的N-糖基化基因,该糖基化过程不可逆,可维持CTK在植物体内的动态水平[33]。细胞分裂素氧化酶/脱氢酶(CKX)参与植物的多种生理过程,包括细胞分裂素(CTKs)分解代谢、根系结构和对非生物胁迫的响应,植物中CKX4基因的下调能够促进CTK的累积,从而抑制侧根和冠状根的生长,进而影响整株作物的生长发育及产量[34-35]。本研究结果表明,与未添加JA处理相比,干旱施加JA处理,玉米素的生物合成代谢通路基因发生显著变化,均表现为UGT73C5上调和CKX11下调。因此可认为,外源添加JA可调控燕麦植株的CTK含量。本研究结果还发现,在任何水分条件下,外源JA均能诱导AT1G71250和THI1.3基因的表达,AT1G为未知功能基因,已有研究表明拟南芥AT1G14260基因在盐胁迫应答过程中起重要作用,该基因可能与侧根的生长有关[36]。THI1通过参与保卫细胞ABA的信号传导,其过表达激活保卫细胞慢型阴离子通道和气孔关闭,有效地降低了水分的损失率,从而增强了拟南芥植株的耐旱水平[37],因此本研究认为,在不同水分条件下,外源JA均能通过AT1G1和THI1调控燕麦的抗旱性。
4 结 论
添加外源JA可诱导燕麦细胞膜、催化酶、转移酶和应对刺激反应代谢通路基因表达发生显著变化。在未进行干旱胁迫条件下(CK),外源JA可诱导基因表达下调;轻度干旱胁迫下,外源JA诱导脱落酸和水杨酸信号转导通路和精氨酸、脯氨酸代谢通路基因表达的上调;重度干旱胁迫下,施用外源JA,DEGs没有显著富集。在不同干旱胁迫下,JA均能诱导玉米素的生物合成代谢通路CTK的N-糖基化基因(UGT73C5)上调和细胞分裂素氧化酶/脱氢酶基因(CKX11)下调。在正常水分条件和轻度干旱胁迫处理后添加JA均可诱导ABA信号转导基因(THI 1.3)和未知功能基因(AT1G71250)的表达上调,而在重度干旱胁迫后添加JA,THI 1.3和AT1G71250的表达均下调。综上,在轻度干旱胁迫下,JA诱导激素信号转导和氨基酸代谢通路基因表达发生显著变化;轻度和重度干旱胁迫处理下,JA均能诱导CTK和ABA相关基因表达发生显著变化。
