简单芽孢杆菌P10 菌株对马铃薯晚疫病菌的防控作用
2023-07-14张翠绵贾楠彭杰丽马佳胡栋王旭王占武
张翠绵,贾楠,彭杰丽,马佳,胡栋,王旭,王占武
(河北省农林科学院农业资源环境研究所/河北省肥料技术创新中心,河北 石家庄 050051)
马铃薯粮菜兼用,已成为我国第三大种植作物。近年来,马铃薯的种植面积和产量均呈逐年增加趋势[1,2],其深加工产品和副产品广泛应用于造纸、医药、化工等多个领域,具有较高的经济价值。由致病疫霉(Phytophthora infestans)引起的马铃薯晚疫病已成为世界第一大作物病害,防治困难[3]。生产上除选用抗病品种外,主要采用化学防治[4]。而不合理使用化学农药易造成农药残留和环境污染,长期使用还会产生抗药性,导致防效降低[5,6]。利用植物益生菌进行生物防治可以有效克服化学防治的上述缺点,已受到我国学者的高度重视[7]。前人利用芽孢杆菌(Bacillus spp.)及其代谢产物进行马铃薯晚疫病(potato late blight)防控已有较多研究。李双东等[8]研究发现,枯草芽孢杆菌(Botrytis cinerea)EB-28 对盆栽马铃薯晚疫病的防效为74.22%。和凤美等[9]发现,解淀粉芽孢杆菌(B.amyloliquefaciens) B9601 对早期的马铃薯晚疫病具有较好防效。张笑宇等[10]研究报道,地衣芽孢杆菌(B.licheniformis) 对马铃薯晚疫病也具有较好防效。王翠翠等[11]报道,拮抗细菌S34-1 对马铃薯晚疫病菌菌丝生长具有较强的抑制作用。年洪娟等[12]发现,荧光假单胞杆菌(Pseudomonas fluorescens) 对疫霉属(Phytophthora)等引起的植物病害具有较强的防控作用。但截至目前,利用简单芽孢杆菌(B.simplex)防控马铃薯晚疫病的研究鲜有报道。简单芽孢杆菌P10 菌株由河北省农林科学院资源环境研究所微生物工程研究室分离鉴定,前期研究表明,该菌株功能多样、作用广谱,可显著提高小麦和玉米的耐盐性,并具有促生、溶磷、固氮等特性,对镰刀菌、丝核菌和腐霉菌等均具有抑制作用[13]。为了从理论上明确P10 菌株菌剂的防病机制,利用P10 菌株进行马铃薯晚疫病防治研究,旨为该菌株进一步的应用研究和生防产品开发提供科学依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 参试马铃薯品种为冀张薯12 号。在聚乙烯塑料盆(32 cm×27 cm)内装土2 kg,调节土壤含水量至2%,然后点种马铃薯块种1 粒/盆,在日光温室内培养至出苗后30 d,备用。
1.1.2 菌株 简单芽孢杆菌P10 菌株由河北省农林科学院资源环境研究所微生物工程研究室分离鉴定,并提供;马铃薯晚疫病菌菌株由河北省农林科学院植物保护研究所提供。
P10 菌株发酵菌液和无菌滤液的制备。挑取已活化的P10 菌株,接入事先置入三角瓶的液体培养基(装液量100 mL/瓶)中,在30 ℃下180 r/min 振荡培养24 h;按照5%的接种量将种子液接到灭菌的细菌培养液中,在30 ℃下180 r/min 振荡培养24 h,制成P10 菌株发酵菌液。将发酵液在4 ℃下5 000 r/min 离心20 min,沉淀(菌体)经无菌水重悬浮,并稀释至与原发酵液等体积的菌液,制成P10 活菌体;上清液于无菌条件下经0.22 μm 微孔滤膜过滤,得到无菌滤液,保存备用。
马铃薯晚疫病菌孢子囊悬液的制备。参照宋风平等[14]方法进行制备。用接种环在已长好的马铃薯晚疫病菌落上轻刮,并用细菌液体培养基多次冲洗,吸出孢子囊悬液,调至浓度为104个/mL,备用。
1.1.3 培养基 P10 菌株培养基为PDA 培养基,成分为马铃薯200.0 g/L、葡萄糖20.0 g/L 和琼脂18.0 g/L,pH值自然。马铃薯晚疫病菌培养基为RTA 培养基,成分为黑麦60.0 g/L、蔗糖15.0 g/L、胡萝卜汁60.0 mL/L和琼脂18.0 g/L。发酵培养液为NB 培养基,成分为牛肉浸膏3.0 g/L、蛋白胨10.0 g/L 和氯化钠5.0 g/L,pH值自然。
1.1.4 仪器或设备 试验用到的仪器或设备有PYXDHS 型电热恒温培养箱(上海一恒科技有限公司)、YX280A 型高压蒸汽灭菌器(上海三申医疗仪器有限公司)、HCB-1300v 型垂直层流洁净工作台(青岛海尔特种电器有限公司)、Primo Star 正直生物显微镜(上海无陌光学仪器有限公司)、ZWY-2102C 恒温培养振荡器(上海智诚分析仪器制造公司) 和三角瓶(规格250 mL)等。
1.2 试验方法
1.2.1 P10 菌株对马铃薯晚疫病致病疫霉的抑制效果
1.2.1.1 对致病疫霉菌丝生长的影响。采用平皿对峙培养法[15],测定P10 菌株活菌体对致病疫霉(P.infestans)的抑制活性;采用打孔法[16],测定P10 菌株发酵菌液和无菌滤液对致病疫霉的抑制活性。20 ℃暗培养5 d,观察P10 菌株的抑菌作用,测量抑菌圈宽度。以只接病原菌的平皿为对照(CK)。每处理均3 次重复。计算抑菌率:
抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.2.1.2 对致病疫霉菌丝体形态的影响。测量抑菌圈宽度后,挑取距P10 菌株活菌体、发酵菌液和无菌滤液最近处的致病疫霉菌落边缘的菌丝以及对照菌落边缘的菌丝,在显微镜10×40 倍视野下观察菌丝形态的变化。
1.2.2 P10 菌株对马铃薯晚疫病的防治效果
1.2.2.1 对离体叶片侵染的抑制作用。选择出苗后20 d、长势一致的盆栽薯苗,参照胡同乐等[17]方法,设喷清水(处理Ⅰ,CK)、喷P10 菌株发酵菌液(处理Ⅱ)、喷P10 菌株无菌滤液(处理Ⅲ)3 个处理,喷施量均为25 mL/株,每处理均5 次重复。24 h 后,采集各处理相同部位的叶片,喷浓度为104个/mL 的马铃薯晚疫病菌孢子囊悬液后置于铺有灭菌湿滤纸的平皿中,20 ℃培养,3 d 后统计发病叶片数量,并参照GB/T 17980.30—2000[18]进行病情分级。计算病情指数和防病效果:
病情指数=[Σ(病级数×该病级的叶片数)/(调查总叶片数×最高病级数)]×100
防病效果=(对照病情指数-处理病情指数)/对照病情指数×100%
1.2.2.2 对盆栽马铃薯晚疫病的防治效果。参照王文丽等[19]方法,在温室(温度20 ℃左右、空气相对湿度90%)内进行试验。选取苗龄30 d、生长健壮的盆栽马铃薯苗,调查叶片数后进行试验处理。P10 菌株病害预防处理4 个,分别是接种病菌前12 h 喷1 次P10菌株发酵菌液,接种病菌前12 h 喷1 次P10 菌株无菌滤液,接种病菌前12 h 和接种病菌后12 h 各喷1 次P10 菌株发酵菌液,接种病菌前12 h 和接种病菌后12 h 各喷1 次P10 菌株无菌滤液;P10 菌株病害治疗处理2 个,分别是接种病菌后12 h 喷1 次P10 菌株发酵菌液,接种病菌后12 h 喷1 次P10 菌株无菌滤液;以喷清水为对照(CK)。P10 菌株发酵菌液、无菌滤液和清水的喷施量均为25 mL/株;马铃薯晚疫病菌孢子囊悬液的喷施量为10 mL/株。处理后第5 天时统计发病叶片数,计算发病率、病情指数和防病效果。
1.3 数据处理与分析
采用Microsoft Excel、DPS 9.5 软件对试验数据进行统计分析。
2 结果与分析
2.1 P10 菌株对马铃薯晚疫病致病疫霉的抑制效果
2.1.1 对致病疫霉菌丝生长的影响 P10 菌株发酵菌液对致病疫霉菌丝生长的抑制作用最强,抑菌带宽度为6.11 mm 且显著>其他处理,抑菌率达到77.8%;活菌体对致病疫霉菌丝生长的抑制作用次之,抑菌率为66.7%;无菌滤液对致病疫霉菌丝生长的抑制作用最弱,抑菌带宽度为2.13 cm 且显著<其他处理,抑菌率为44.4%(表1 和图1)。
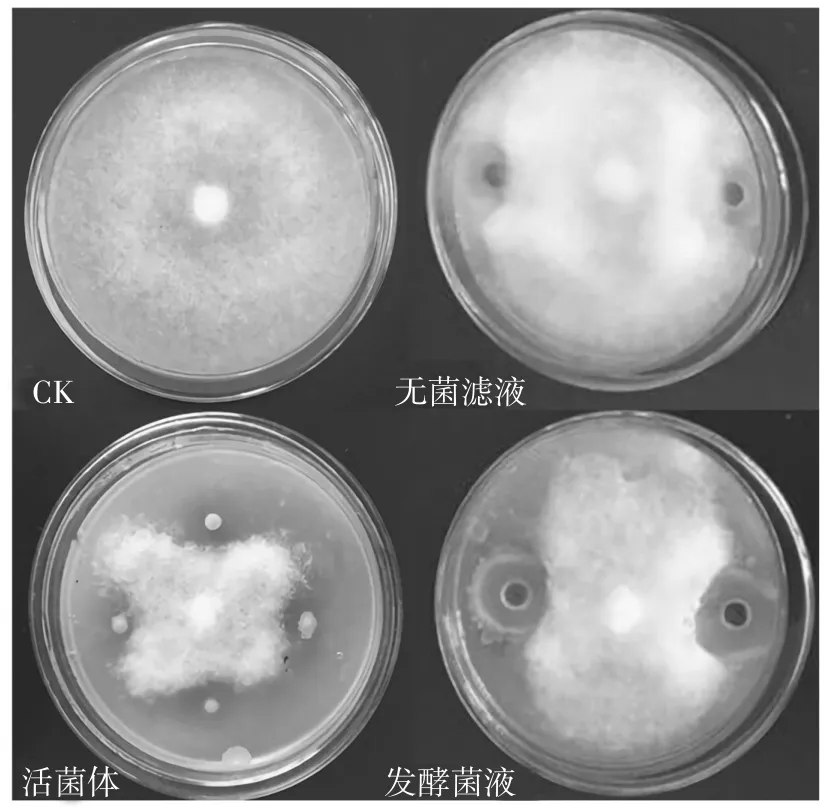
图1 P10 菌株不同处理下马铃薯晚疫病致病疫霉菌丝的生长状况Fig.1 Growth status of P. infestans hypha under different treatments with P10 strain
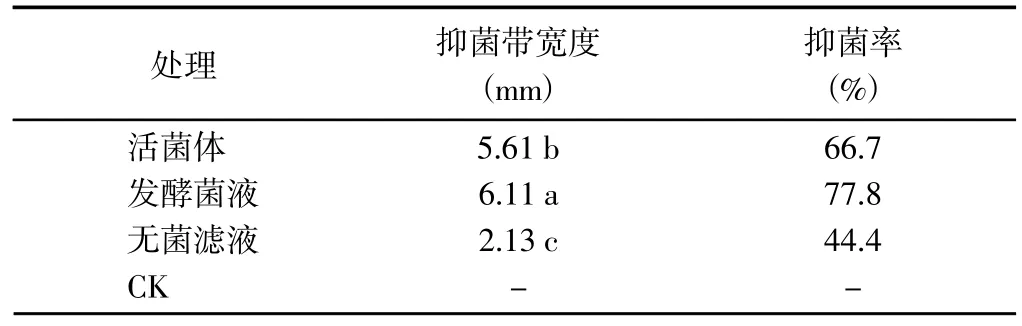
表1 P10 菌株对马铃薯晚疫病致病疫霉菌丝生长的抑制效果Table 1 Inhibition effect of P10 strain on the growth ofP. infestans causing potato late blight
2.1.2 对致病疫霉菌丝体形态的影响 显微镜下观察发现,对照致病疫霉的菌丝光滑、粗细一致、内含物分布均匀(图2a),不正常的菌丝较少;而受P10 菌株抑制的菌丝呈现不同程度的畸变,表现为扭曲变形、粗细不一(图2b、c、d),局部膨胀(图2e),内含物分布不均(图2f)等。
2.2 P10 菌株对马铃薯晚疫病的防治效果
2.2.1 对离体叶片侵染的抑制作用 马铃薯离体叶片喷施P10 菌株发酵菌液和无菌滤液24 h 后再接种马铃薯晚疫病菌孢子囊悬液,病情指数分别为30.1 和35.6,二者差异显著,且均显著<CK;防治效果分别为57.2%和49.4%(表2)。表明P10 菌株发酵菌液和无菌滤液均对马铃薯晚疫病具有一定的防治效果,其中发酵菌液的效果优于无菌滤液。
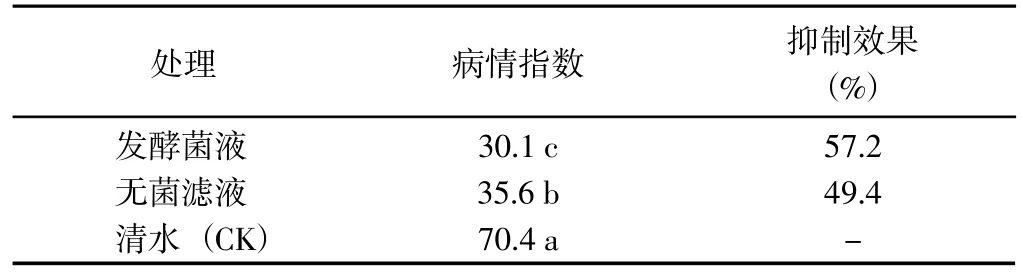
表2 P10 菌株对晚疫病菌侵染离体叶片的抑制作用Table 2 Inhibition effect of P10 strain on in vitro leavesinfection by P. infestans
2.2.2 对盆栽马铃薯晚疫病的防治效果 在接种晚疫病菌孢子囊悬液前12 h 喷施P10 菌株发酵菌液以及接种病菌前后各喷施1 次P10 菌株发酵菌液的防效较高,分别为73.9%和71.5%;接种病菌后再喷施P10菌株发酵菌液的治疗效果为54.8%;接种病菌前喷施P10 菌株无菌滤液以及接种病菌前后各喷施1 次P10菌株无菌滤液的预防和治疗效果分别为60.3%和57.9%(表3)。表明P10 菌株发酵菌液的预防效果好于治疗效果,发酵菌液的效果优于无菌滤液。

表3 P10 菌株对盆栽马铃薯晚疫病的防效Table 3 Control effect of P10 strain against late blight of potted potato
3 结论与讨论
3.1 简单芽孢杆菌及P10 菌株对马铃薯晚疫病致病疫霉的抑制作用
目前对马铃薯晚疫病的防控,除培育推广抗病品种、使用杀菌药剂外,利用有益微生物进行生物防治成为热点,涉及的生防菌株主要有枯草芽孢杆菌[20]、解淀粉芽孢杆菌[21]、链霉菌[22]、地衣芽孢杆菌[10]和哈茨木霉[23]等,而利用简单芽孢杆菌防控马铃薯晚疫病的研究鲜有报道。马铃薯晚疫病菌由于既侵染马铃薯块茎,又侵染植株的茎叶,存在先种传、土传再气传的侵染机制[24],因此为害重,防治困难。这就对生防菌株提出了更高的要求,生防菌株不仅需要对疫霉菌菌丝、胞囊孢子释放与萌发具有抑制作用,还需要具有生态位的竞争和诱导植物抗性等多种功能,如在土壤、根际和叶际等生态位上都能发挥作用将会更加理想。简单芽孢杆菌就具有这方面的潜力。项鹏等[25]利用简单芽孢杆菌菌株Sneb545 包衣处理大豆种子,通过拮抗和诱导抗性,有效地防控了大豆胞囊线虫。孙广正等[26]分离的简单芽孢杆菌XX6,通过抑菌和促生机制,对小麦根腐病的抑制率达到62.3%。前期试验发现,P10 菌株生物功能多样、作用广谱,不仅能有效防控番茄和黄瓜枯萎病,还能提高小麦和玉米耐盐性,并显著促进根系发育[13]。本研究以较难防控的马铃薯晚疫病为对象,通过对峙培养试验发现,P10 菌株的活菌体、发酵菌液和无菌滤液均对马铃薯晚疫病致病疫霉的菌丝生长具有较强的抑制作用,其中发酵菌液的抑制效果优于无菌滤液。说明P10 菌株对马铃薯晚疫病致病疫霉的抑制存在营养竞争和代谢产物抑菌2 种机制,这为深入研究其代谢产物和抑菌机理指明了方向。
3.2 P10 菌株对马铃薯晚疫病的抗病效果
采用离体叶片侵染及温室盆栽试验发现,接种晚疫病病菌前喷施P10 菌株发酵菌液或无菌滤液均对马铃薯晚疫病具有较好的防控效果,而在接种病菌后再喷施则效果较差,且发酵菌液的效果优于无菌滤液。说明除抑菌产物外,P10 菌株活菌体也发挥了一定的作用,菌株通过生态位、营养竞争和产生抑菌物质等多种机制抑制了病菌的侵染。此外,试验中还发现,喷施P10 菌株发酵菌液的叶片厚度有所增加,且叶色鲜亮,推测可能是P10 菌株与宿主互作,提高了宿主抗性,存在诱导抗性机制。P10 菌株具有良好的应用潜力,更广泛地应用和作用机制研究正在进行中。
