达格列净治疗糖尿病合并慢性心力衰竭的疗效及对血清微小RNA水平的影响*
2023-07-14唐仁春
孙 静,唐仁春
中国人民解放军联勤保障部队第九二〇医院心内科,云南昆明 650000
糖尿病是临床常见的慢性代谢性疾病,其中2型糖尿病(T2DM)占所有糖尿病病例的90%~95%[1]。T2DM已被证实与心脏、肾脏、血管和神经的长期损伤、功能障碍和心力衰竭有关[2]。随着人口老龄化进程的加快,T2DM患者中慢性心力衰竭(CHF)相关的并发症也在逐步增加。尽管临床上在改善T2DM患者的心血管病结局方面已经取得了很大进展,但在降低T2DM患者发生心力衰竭的风险和改善临床结局方面仍十分落后。钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂已成为降低T2DM心血管风险的重要治疗方式[3]。SGLT2抑制剂最初被用于治疗T2DM患者。它通过选择性地抑制肾脏中的SGLT2并阻断葡萄糖的重吸收而降低血糖水平,这一过程不依赖于胰岛素抵抗和β细胞功能。研究表明,除了降低血糖外,SGLT2抑制剂达格列净在心力衰竭患者的治疗中发挥了积极作用[4]。然而,其具体作用机制尚未完全阐明。近年来,循环微小RNA(miRNA)在心血管疾病的研究中受到广泛关注。血清miRNA-92a、miR-92a、miR-16和miR-765在CHF患者中的差异表达对疾病的诊断、进展和治疗具有重要意义[5]。本研究选择T2DM合并CHF的患者为研究对象,探讨达格列净的临床疗效及其对患者血清miR-92a、miR-16、miR-765水平的影响,以期为达格列净的临床应用提供一定科学依据。
1 资料与方法
1.1一般资料 将2019年1月至2022年1月该院收治的T2DM合并CHF的患者共166例纳入研究,年龄40~75岁,男107例、女59例,将其随机分为对照组和观察组各83例。对照组男56例、女27例,年龄(55.87±8.17)岁。观察组男51例、女32例,年龄(55.93±9.31)岁。纳入标准:(1)T2DM诊断符合《中国2型糖尿病防治指南(2017年版)》中的相关诊断标准;(2)CHF诊断符合《中国心力衰竭诊断和治疗指南2018》中的相关诊断标准;(3)心功能分级为Ⅱ~Ⅳ级。排除标准:(1)伴外周血管疾病;(2)合并其他心脑血管疾病,如脑梗死、脑缺血、先天性心脏病、心肌炎等;(3)伴肝、肾衰竭;(4)伴肿瘤或有重大创伤;(5)曾行冠状动脉支架植入术或冠状动脉搭桥手术;(6)有药物过敏或使用禁忌者。所有患者及其家属均对本研究知情同意并签署知情同意书。本研究经本院伦理委员会批准。
1.2仪器与试剂 N末端脑钠肽前体(NT-proBNP)的酶联免疫吸附法(ELISA)检测试剂购自上海酶联生物科技有限公司;血管紧张素Ⅱ(AngⅡ)ELISA检测试剂盒购自上海优科唯生物科技有限公司;TRIzol试剂盒购自英国Invitrogen公司;TaqMan miRNA反转录试剂盒购自美国Applied Biosystems公司。AU5800型全自动生化分析仪购自成都斯马特科技有限公司;DC-N3S型彩色多谱勒超声诊断仪购自贝登医疗有限公司;ABI 7300实时荧光定量PCR(qPCR)系统购自美国Applied Biosystems公司。
1.3方法
1.3.1治疗方案 两组患者均给予常规抗心力衰竭标准药物治疗。对照组根据患者的情况个体化给予降糖药物和抗心力衰竭药物治疗,如胰岛素、二甲双胍、β-受体阻滞剂、利尿剂、钙通道阻滞剂等。观察组在对照组治疗方案的基础上,给予达格列净片治疗(国药准字J20170040,规格:10 毫克/片),1片/次,3次/天。两组患者均持续治疗6个月。
1.3.2基线资料收集和标本采集 收集所有患者的年龄、性别、体重指数(BMI)、收缩压(DBP)、舒张压(SBP)、吸烟史、饮酒史、病程、并发症、用药情况等资料。分别于治疗前和治疗后采集患者的空腹静脉血5 mL,室温下静置1 h后离心,留取血清冻存于-80 ℃冰箱。
1.3.3血清学指标的检测 采用全自动生化分析仪检测空腹血糖(FBS)、餐后2 h血糖(2hPG)和糖化血红蛋白(HbA1c)水平。采用ELISA试剂盒检测患者血清NT-proBNP和AngⅡ水平。采用彩色多谱勒超声诊断仪检测患者治疗前和治疗后的左心室射血分数(LVEF)、左心室收缩末期内径(LVESD)和左心室舒张末期内径(LVEDD)。
1.3.4RNA提取和qPCR检测 使用TRIzol试剂盒从血清样品中提取总RNA。使用A260/A280的比值(在1.9~2.0范围内)来评估所提取RNA的纯度。使用TaqMan miRNA反转录试剂盒进行反转录。将获得的cDNA储存在-20 ℃备用。在qPCR系统中使用SYBR Green PCR预混液进行PCR。使用50 μL的PCR反应体系:10×缓冲液5 μL,2.5 mmol/L dNTP 4 μL,Taq酶0.5 μL,Pmix 2.5 μL,上游引物和下游引物各1 μL,ddH2O 36 μL。qPCR反应条件如下:95 ℃预变性5 min;95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,进行40个循环。以U6基因作为内源性对照。采用2-ΔΔCt法计算miR-92a、miR-16和miR-765的相对表达水平。引物序列设计如下,miR-92a:正向引物为5′-CCTGCAAGGCATAGTCTCATTGAA-3′,反向引物为5′-GAACTTGGCCACTTGCTAGATCAA-3′;miR-16:正向引物为5′-TAGCAGCACGTAAATATTGGCG-3′,反向引物为5′-TGCGTGTCGTGGAGTC-3′;miR-765:正向引物为5′-CGGCTCGGATCCGTTAG-3′,反向引物为5′-CGACTACCGTTAGCTAGA-3′;U6:正向引物为5′-CTCGCTTCGGCAGCA-3′,反向引物为5′-AACGCTTCACGAATTTGCGT-3′。
1.3.5随访 患者在治疗期间每1个月进行一次门诊随访,观察并记录用药期间的不良反应,包括肾功能损伤、低血糖、低血压、皮疹、恶心呕吐、腹胀腹泻情况;记录用药期间的再住院情况,以及主要不良心血管事件发生情况,包括全因死亡、心肌梗死、靶血管重建等。

2 结 果
2.1两组患者一般资料的比较 两组患者在性别、年龄、BMI和常规药物使用等方面比较,差异均无统计学意义(P>0.05),见表1。

表1 两组患者一般资料比较或n或n/n)
2.2两组患者治疗前后血糖指标的比较 两组患者治疗前FBG、2hPG、HbA1c水平比较,差异无统计学意义(P>0.05)。治疗6个月后,两组患者的FBG、2hPG和HbA1c水平均明显低于治疗前,差异均有统计学意义(P<0.05)。治疗6个月后,观察组患者FBG、2hPG和HbA1c水平显著低于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组患者治疗前后血糖指标的比较
2.3两组患者治疗前后心功能指标的比较 治疗前,两组患者的心功能指标(LVEF、LVEDD和LVESD)比较,差异均无统计学意义(P>0.05)。与治疗前相比,治疗后两组患者的LVEF均明显升高,而LVEDD及LVESD均明显降低,差异均有统计学意义(P<0.05)。治疗6个月后,与对照组比较,观察组LVEF较高,而LVESD和LVEDD较低,差异均有统计学意义(P<0.05)。见表3。

表3 两组患者治疗前后心功能指标的比较
2.4两组患者治疗前后心肌损伤标志物的比较 治疗前,两组患者的心肌损伤标志物(NT-proBNP和AngⅡ)比较,差异均无统计学意义(P>0.05)。与治疗前相比,治疗后两组患者的血清NT-proBNP和AngⅡ水平均明显降低,差异均有统计学意义(P<0.05)。治疗6个月后,与对照组相比,观察组的血清NT-proBNP和AngⅡ水平均较低,差异均有统计学意义(P<0.05)。见表4。

表4 两组患者治疗前后心肌损伤标志物的比较
2.5两组患者治疗前后血清miR-92a、miR-16和miR-765水平比较 治疗前,两组患者血清miR-92a、miR-16和miR-765水平比较,差异均无统计学意义(P>0.05)。治疗6个月后,两组患者血清miR-92a水平较治疗前降低,而miR-16和miR-765水平较治疗前升高,差异均有统计学意义(P<0.05)。治疗6个月后,观察组血清miR-92a水平低于对照组,而miR-16和miR-765水平均高于对照组,差异均有统计学意义(P<0.05)。见表5。

表5 治疗前后两组患者血清miR-92a、miR-16和miR-765水平比较
2.6两组患者临床疗效比较 治疗6个月后,观察组患者治疗的总有效率高于对照组,差异有统计学意义(P<0.05)。见表6。
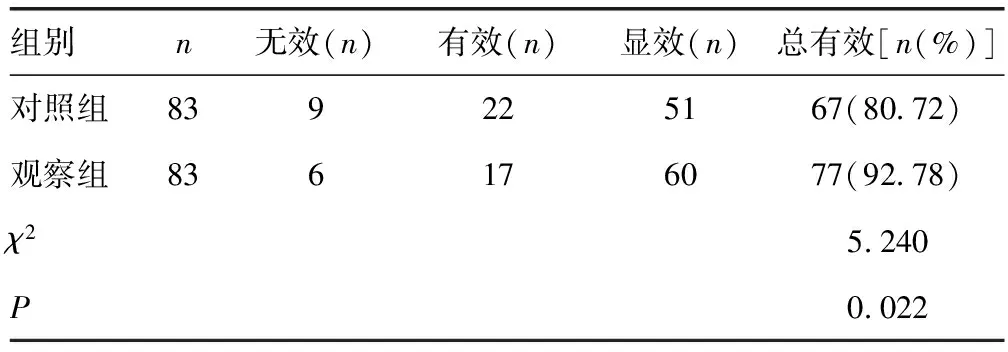
表6 两组患者临床疗效比较
2.7两组患者治疗期间不良反应和随访结局的比较 治疗期间未发生全因死亡事件,两组患者不良反应(包括低血糖、低血压、恶心呕吐、腹胀腹泻)的发生率比较,差异均无统计学意义(P>0.05)。观察组的心力衰竭再住院率和不良心血管事件发生率均低于对照组,差异有统计学意义(P<0.05)。见表7。

表7 两组患者治疗后不良反应和随访结局的比较(n)
3 讨 论
T2DM已被证实是CHF预后不良的独立危险因素,是导致CHF高病死率、高发病率和高再住院率的原因之一[6]。5%~10%的糖尿病患者合并心力衰竭,约44%因心力衰竭住院的患者合并糖尿病。即使在调整了其他风险因素,如年龄、高血压、高酯血症和冠状动脉疾病之后,糖尿病患者心力衰竭的发生率仍会增加。
SGLT2抑制剂已成为降低T2DM心血管风险的重要治疗药物[7]。研究表明,SGLT2抑制剂可以通过增加心肌能量和底物效率来改善或优化心脏能量代谢并改善心脏功能和心输出量[8]。同时,抑制SGLT2可以促进支链氨基酸的降解,从而为T2DM和心力衰竭患者的心肌提供能量来源[9]。动物实验也表明,SGLT2抑制剂可能通过增加心肌酮体消耗并降低心脏葡萄糖利用和乳酸产生[10]。临床研究也证实,SGLT2抑制剂的使用可以显着降低心力衰竭患者的死亡风险[11]。涉及T2DM患者的大型临床试验表明,SGLT2抑制剂能够降低糖尿病患者因心力衰竭住院的风险[12]。达格列净作为一种SGLT2抑制剂,已在欧盟和日本获得美国食品药品监督管理局(FDA)批准用于治疗1型糖尿病(T1DM)。此外,FDA于2019年批准了达格列净可用于伴或不伴T2DM的心力衰竭成年患者,以降低心血管死亡和心力衰竭住院的风险。因此,达格列净代表了第一类明确降低T2DM患者心力衰竭风险的治疗性降糖药。本研究结果发现,治疗6个月后,两组患者FBG、2hPG和HbA1c水平均明显低于治疗前,且观察组低于对照组,提示达格列净可有效降低T2DM伴CHF患者的血糖水平,这与赖晓菁等[13]的研究结果一致。PETRIE等[14]报道,达格列净治疗可以减少左心室质量,有助于延缓心室重塑。本研究结果也发现,治疗后两组患者的LVEF、LVEDD和LVESD均发生明显改善,且观察组的改善幅度优于对照组。同时,达格列净能够明显降低患者血清NT-proBNP和AngⅡ水平,它们是反映心肌损伤的重要生物标志物。这些结果提示达格列净治疗能够减轻T2DM伴CHF患者的心肌损伤,改善心功能。研究表明,达格列净在降低血压、降低体重、左心室重构、减少急性肾损伤和心房颤动方面具有积极的作用[15]。此外,达格列净能够降低不同年龄人群的死亡风险和心力衰竭恶化程度[16]。本研究结果也显示,观察组患者在治疗期间的心力衰竭再住院率和不良心血管事件发生率明显低于对照组,在临床应用中具有一定安全性。然而,达格列净治疗获得这些收益的机制尚不清楚。
miRNA是真核细胞中的一类小的内源性单链RNA转录物,通常由20~24个核苷酸组成。在人类细胞中发现了超过2 000种miRNA,参与了基因组中1/3的基因调控。循环miRNA在心血管疾病的研究中受到广泛关注。虽然尚未达到临床应用阶段,但miRNA早已被证明在大多数心血管疾病中发挥重要作用。miRNA通过转录后调节对心肌细胞活力、炎症、肥大和纤维化产生影响,在心脏病的发病过程和发展中发挥关键作用。此外,miRNA可以靶向心肌细胞中的钙处理蛋白,从而改变其收缩性。潜在的miRNA生物标志物可以指导急性心力衰竭患者的短期和长期治疗。本研究结果发现,达格列净治疗能够明显降低T2DM合并CHF患者的血清miR-92a和miR-765水平,并升高血清miR-16水平。miR-92a作为miRNA家族成员之一,已证明miR-92a在心肌梗死患者的血清中上调[17]。靶向抑制miR-92a的表达能够缩小梗死面积、降低心肌缺血后心功能受损程度,可能是预防心肌再灌注损伤的新策略。miR-16在被认为是一种潜在的核因子-κB(NF-κB)相关miRNA,通过介导心肌炎中的CD40来抵抗脂多糖诱导的炎症。miR-16已被证实通过靶向下游蛋白质来抑制心肌细胞凋亡,在心脏系统中发挥保护作用[18]。临床研究显示,心力衰竭患者血清miR-16的水平明显降低,循环miR-16可作为预测心力衰竭患者预后的有价值生物标志物[19]。有研究证实miR-765在心力衰竭患者心脏组织中的表达上调[7]。miR-765通过抑制inhibitor-1的表达导致关键钙循环蛋白的去磷酸化和失活,从而引起心力衰竭的标志-肌浆网(SR)Ca2+循环受损和收缩力下降[20]。miR-765的下调可能是心脏功能障碍的潜在治疗方法。达格列净可能通过调控miR-92a、miR-765和miR-16的水平来发挥抗炎、抗心肌纤维化、抑制心肌细胞凋亡作用,从而达到改善患者心功能、减少不良心脏事件发生的目的。
综上所述,达格列净治疗能够降低T2DM合并CHF患者的血糖水平、改善心功能、降低心脏不良事件的发生率,这可能与其对miR-92a、miR-765和miR-16的调节作用有关。然而,由于本研究纳入样本量少且观察时间较短,未详细探讨达格列净对T2DM伴心力衰竭患者远期预后的影响。因此,后期仍需要扩大样本量来评估达格列净治疗对患者远期预后的影响。
