基于高通量测序分析多巴胺受体DRD5缺失小鼠肠道菌群的变化*
2023-07-14吴昱青
刘 璐,吴昱青
1.南京医科大学基础医学院免疫学系,江苏南京 211100;2.南京医科大学第一附属医院检验学部,江苏南京 210029;3.国家医学检验临床医学研究中心分中心,江苏南京 210029
肠道菌群是定植在肠道内复杂且丰富的微生物群落。研究表明,肠道菌群在生物体内的新陈代谢、免疫系统发育、炎症反应等方面发挥着重要作用,肠道菌群的紊乱与消化系统、免疫系统、呼吸系统、神经系统等疾病的发生密切相关[1-2]。目前研究发现帕金森患者肠道菌群紊乱并伴随有肠道功能异常的出现[3],多巴胺的水平及其受体表达的异常与帕金森病的发生密切相关[4]。小鼠肠腔内含有由肠道多巴胺能神经元分泌产生的高浓度的多巴胺[5],多巴胺可通过多巴胺受体调控胃肠道功能,胃肠道中多巴胺水平的下降也可导致肠道微生态失衡[6],而多巴胺受体DRD5在肠道微生物稳态中扮演的角色并不十分明确。本研究拟采用高通量测序分析DRD5缺失小鼠粪便样本的肠道菌群变化,探讨DRD5在肠道微生态调控中的作用,以期为临床诊断和治疗肠道菌群紊乱提供依据。
1 材料与方法
1.1实验动物 5只野生型无特定病原体级(SPF级)C57BL/6J小鼠作为对照组(购于南京医科大学医药实验动物中心)。5只DRD5敲除小鼠作为对照组(购于广州赛业生物科技有限公司)。两组小鼠均饲养于南京医科大学医药实验动物中心SPF级环境,实验动物饲养设施合格证号为SYXK(苏)2021-0023。光暗每日各半,室温控制在(23±2)℃,相对湿度45%~70%。本研究已通过南京医科大学动物实验伦理委员会审查(批准编号:1707029)。
1.2方法
1.2.1小鼠粪便标本及肠道组织的收集 粪便标本的采集采取立取、立存(取样后立即保存)原则,用无菌1.5 mL EP管收集饲养至8周龄的小鼠粪便,取样前洗手,戴无菌手套、口罩,连续收集3次粪便,混匀。标本采集后,标记好小鼠品系、编号、采样日期等。收集同期小鼠肠道组织,进行大体观察,测量结肠长度,同时制备常规石蜡切片,进行HE染色,于镜下观察组织形态。
1.2.2DNA提取 采用粪便DNA组快速提取试剂盒进行粪便基因组DNA提取,按照试剂盒说明书操作,并检测DNA浓度。
1.2.3DNA 16S rRNA检测 对16S rRNA的DNA序列进行高通量测序,高通量测序及测序文库构建由上海美吉生物医药科技有限公司完成。
1.2.4生物信息学分析 原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接。通常将相似度在97%以上的序列聚类作为1个操作分类单元(OTU),并在聚类过程中去除单序列和嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva数据库(SSU123),比对阈值设置为70%。

2 结 果
2.1小鼠肠组织的大体形态观察 对照组小鼠肠组织长度、大体形态正常;敲除组小鼠肠组织水肿,长度缩短,与对照组比较差异有统计学意义(P<0.05)。见图1。

注:A为对照组;B为敲除组。
2.2小鼠肠组织的镜下观察 结肠肠壁由内至外依次为黏膜层、黏膜肌层、黏膜下层、肌层和浆膜层。对照组小鼠肠道组织形态正常,可见明显的隐窝和大量杯状细胞,无炎性细胞浸润。敲除组小鼠肠道组织结构紊乱,肠道黏膜层轻微增生,有少量淋巴细胞浸润,见图2。

注:A为对照组;B为敲除组;箭头表示淋巴细胞浸润。
2.3OTU分析 对照组小鼠和敲除组小鼠共产生OTU 443个,共有OTU 273个,其中对照组小鼠OUT 326个,敲除组小鼠390个,对照组小鼠特有OTU为53个,敲除组小鼠特有OTU为117个,明显高于对照组小鼠,两组比较差异有统计学意义(P<0.05),满足归类分析要求,见图3。

注:A为对照组;B为敲除组。
2.4物种及其丰度分析
2.4.1门分类水平比较 门分类水平主要检测出10个菌门,其中两组小鼠均以拟杆菌门和厚壁菌门为优势菌门,对照组和敲除组优势菌门的相对丰度百分比分别为93.06%和95.10%。两组间优势菌门的相对丰度比较,差异无统计学意义(P>0.05)。与对照组小鼠比较,敲除组小鼠中变形菌门显著减少,蓝细菌门显著增多,差异均有统计学意义(P<0.05),见图4。

注:A为对照组;B为敲除组。
2.4.2属分类水平比较 敲除组小鼠与对照组小鼠之间罗姆布茨菌属、真杆菌属、脱硫弧菌属、ⅩⅢ_UCG-001属、胃嗜气科菌属、Rs-E47_termite属、双歧杆菌属、ASF356属、布劳特菌属、毛螺菌属丰度比较,差异均有统计学意义(P<0.05),但除毛螺菌属外,其他菌属相对丰度都很低。相对丰度居于前5位的分别为拟杆菌属、梭菌属、丹毒丝菌属、毛螺菌属和弯曲菌属,见图5。

注:A为对照组;B为敲除组。
2.5差异细菌种类 对照组小鼠肠道菌群中弯曲菌、脱硫弧菌、红螺菌、伯克菌以及疣微菌相对丰度较高,差异有统计学意义(P<0.05),而敲除组小鼠中颤螺菌和柔膜菌的相对丰度较高,差异有统计学意义(P<0.05),见图6。
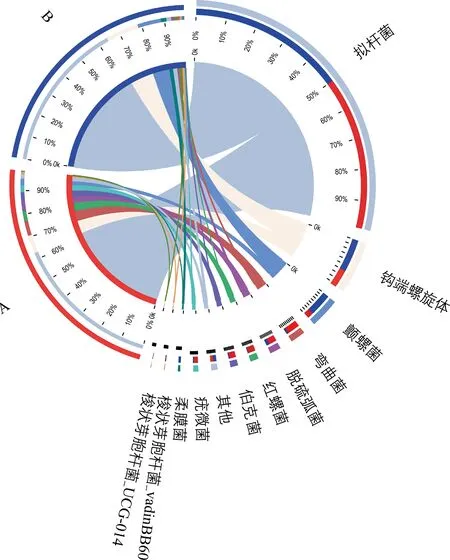
注:A为对照组;B为敲除组。
3 讨 论
多巴胺又名3,4-二羟基苯乙胺,是中枢神经系统中一种重要的儿茶酚胺类神经递质,负责机体的重要功能,包括情绪、认知、行为、运动控制、心血管功能和内分泌调节等,其缺失可导致帕金森病的发生[7]。多巴胺主要通过其受体发挥生物学功能,多巴胺受体包括D1类受体和D2类受体:D1类受体包括DRD1和DRD5,D2类受体包括DRD2、DRD3和DRD4[8]。目前针对多巴胺-DRD5信号的研究主要集中在其对炎症和肿瘤等疾病的调控作用。
肠道菌群是定植在肠道内的庞大微生物群落。肠道菌群失调可导致微生物丰度、微生物构成和微生物代谢产物等发生变化,从而影响肠道或远端器官的免疫功能,甚至影响疾病的发生发展,如“菌群-肠-脑轴”“菌群-肠-肝轴”的提出说明肠道菌群与脑、肝脏等器官及相关疾病存在密切联系[9-10]。随着微生物分析技术和生物信息学的发展,如高通量微生物16S rDNA基因测序技术极大地丰富了微生物的检测手段,肠道菌群的研究进入一个新的阶段[11]。本研究通过检测对照组小鼠和敲除组小鼠肠道菌群的变化,探讨DRD5与肠道菌群紊乱的关系。
本研究结果显示,对照组小鼠和敲除组小鼠OTU数存在差异。进一步菌群差异分析发现,两组肠道菌群在门、纲、目、科、属、种水平存在差异。敲除组小鼠与对照组小鼠相比,蓝细菌门显著增加,其数目增多可导致神经系统疾病空泡性髓鞘病的发生[12]。本研究结果发现,与对照组小鼠相比,敲除组小鼠中罗姆布茨菌丰度明显降低。有研究报道,80%以上的肥胖患者肠道菌群中都存在罗姆布茨菌,提示罗姆布茨菌可能是超重人群中一种普遍的致病菌[13]。对照组小鼠中真杆菌的丰度显著高于敲除组小鼠,真杆菌是属于后壁菌门、梭菌目、真杆菌科的一类革兰阳性菌,是人体肠道的重要组成部分。目前研究认为真杆菌可通过产生短链脂肪酸缓解宿主肠道炎症、2型糖尿病和肥胖等症状,而且短链脂肪酸中的丁酸可修复肠道黏膜,抑制结直肠癌的发生[14-15]。脱硫弧菌属增多是肠息肉和溃疡性结肠炎的一个重要特征[16],本研究结果发现,DRD5缺失后,脱硫弧菌属的丰度显著下降,提示靶向抑制DRD5可降低肠息肉和溃疡性结肠炎的发生风险。梭菌家族的ⅩⅢ_UCG-001菌属相对丰度与血清总胆固醇、甘油三酯、血清低密度脂蛋白均呈正相关[17],DRD5缺失小鼠中ⅩⅢ_UCG-001菌属的相对丰度均低于对照组小鼠。报道指出,在帕金森病患者中Gastranaerophilales菌属的丰度显著增加,提示Gastranaerophilales菌属可能参与了帕金森病的发病过程[18]。本研究结果显示,DRD5缺失后Gastranaerophilales菌属的丰度明显增加,提示DRD5的表达可影响帕金森病的发生发展。本研究结果显示,敲除组小鼠中双歧杆菌属丰度明显降低。双歧杆菌有助于肠道微生态平衡,促进肠上皮细胞分泌黏蛋白,促进潘氏细胞分泌sIgA,在肠道局部产生免疫作用,对全身免疫反应也有一定调节作用[19]。梭状芽孢杆菌ASF356的丰度与脂多糖(LPS)水平呈负相关,而与短链脂肪酸呈正相关[20]。本研究结果发现,敲除组小鼠中梭状芽孢杆菌ASF356的相对丰度明显降低。布劳特菌属是一种具有抗炎特性的肠道共生菌,肠道中布劳特菌属的丰度与移植物抗宿主病的病死率降低和总存活率提高有关[21]。敲除组小鼠中,布劳特菌属的丰度明显增加。
本研究初步揭示DRD5缺失小鼠和野生型小鼠肠道菌群结构和多样性具有明显差异,未来在临床中可通过选择DRD5激动剂或抑制剂治疗相关疾病,如DRD5激动剂可通过提高双歧杆菌的相对丰度,促进肠道微生态的平衡,治疗肠道炎症。但本研究尚存在一定的局限性:由于16S rRNA基因测序技术的局限性及小鼠样本量不足,后续将增大样本量并采用宏基因测序技术找出差异基因,进一步探讨DRD5影响肠道菌群结构和多样性的内在机制,为不同疾病的诊治提供依据。
