水稻TAC1基因的STARP标记开发及164份杂交稻TAC1基因型分析
2023-07-13杨绍华桂毅杰陈睿周淑芬陈在杰刘华清王锋
杨绍华 桂毅杰 陈睿 周淑芬 陈在杰 刘华清 王锋
摘 要:分蘖角度是水稻重要的株型性状,合适分蘖角是实现水稻高产的关键因素。针对控制水稻分蘖角度的主效基因TAC1的功能位点,设计了基于STARP(Semi-thermal asymmetric reverse PCR)技术的特异性分子标记S-TAC1,并对56份已测序常规水稻品种及164份杂交水稻进行了基因型鉴定。S-TAC1准确地鉴定了56个已测序常规品种的基因型,紧凑纯合基因型tac1/tac1 36份,松散纯合型TAC1/TAC1 20份,表明S-TAC1分型结果准确可靠。在164份杂交水稻中,杂合基因型
TAC1/tac1 62份,松散纯合型TAC1/TAC1 102份。本研究开发的功能标记为通过分子标记辅助选择培育理想株型的水稻品种提供了技术支撑。
关键词:水稻;TAC1基因;分子标记;STARP(Semi-thermal asymmetric reverse PCR)技术
中图分类号:S 511 文献标志码:A 文章编号:0253-2301(2023)04-0007-05
DOI: 10.13651/j.cnki.fjnykj.2023.04.002
Development of STARP Markers for TAC1 Gene in Rice andAnalysis of TAC1 Genotypes in
164 Hybrid Rice
YANG Shao-hua, GUI Yi-ie, CHEN Rui, ZHOU Shu-feng, CHEN Zai-jie, LIU Hua-qing, WANG Feng
(Fujian Key Laboratory of Agricultural Genetic Engineering / Institute of Biotechnology,Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China)
Abstract: The tillering angle was an important plant type trait of rice, and the suitable tillering angle was the key factor to achieve the high yield of rice. The specific molecular marker S-TAC1 based on STARP (Semi-thermal asymmetric reverse PCR) technology was designed for the functional site of TAC1, which was the major efficiency gene controlling the tillering angle of rice, and the genotype identification of 56 sequenced conventional rice varieties and 164 hybrid rice varieties were conducted. S-TAC1 accurately identified the genotypes of 56 sequenced conventional varieties, including 36 compact homozygous genotypes tac1/tac1 and 20 incompact homozygous genotypes TAC1/TAC1, which indicated that the S-TAC1 typing results were accurate and reliable. Among 164 hybrid rice varieties, 62 were heterozygous genotypes TAC1/tac1 and 102 were incompact homozygous genotypes TAC1/TAC1. The functional markers developed in this study provided technical support for the cultivation of rice varieties with ideal plant type by molecular marker-assisted selection.
Key words: Rice; TAC1 gene; Molecular marker; STARP (Semi-thermal asymmetric reverse PCR) technology
分蘗角度是指分蘖与主茎之间的夹角,是水稻最直观的农艺性状之一。较大的分蘖角有利于单个分蘖获得更充足的光照,以及良好的通风透气性,但不利于水稻密植,降低了单位面积产量;紧凑型水稻由于分蘖间空间过小,导致光合效率降低,且不利于通风透气,增加了纹枯病等病害的感病概率。因此培育分蘖角度合适的理想株型水稻品种是实现高产的关键因素之一。目前,已明确功能的水稻分蘖角控制基因包含有PROG1[1-2]、LPA1[3]、LAZY1[4]、LAZY2[5]、LAZY3[6]、OsLIC[7]、TIG1[8]、TAC1[9]、TAC3[10]和TAC4[11]等。在上述已克隆基因中,大多在野生稻或突变体中克隆获得,匍匐生长或分蘖角度过大,在栽培稻中缺乏应用价值。TAC1基因是籼稻和粳稻分化的重要基因,粳稻中紧凑型的tac1基因位于3′UTR的内含子剪切位点由A突变为G,导致mRNA的稳定性降低,从而导致分蘖角降低[9]。大部分粳稻为紧凑型的tac1基因,而籼稻中基因存在分化,大部分为松散型的TAC1基因,但在保持系中有一定比例的紧凑型tac1基因。由于TAC1基因的共显性,杂合态基因型分蘖夹角适中,被认为是杂种优势贡献的重要基因[12]。因此准确高效鉴定水稻品种中TAC1的基因型对育种实践具有非常重要的参考价值。
目前,针对TAC1的基因型已开发了基于等位基因特异扩增的四引物分子标记ARMS[13]和PARMS标记[14]。前者需要通过电泳,难以实现高通量检测,而PARMS为商业化标记,依赖于商业公司,成本相对较高。STARP技术[15]为近年来新出现的分子标记技术,原理与KASP和PARMS類似,也是基于等位基因竞争性扩增。STARP技术的主要特点在于通过在位点特异引物的3′末端的倒数第3位和第4为分别引入错配碱基,增加2个不同等位基因扩增的差异性,使得利用普通Taq酶也能实现包括SNP和INDEL在内的多种类型的多态位点分析。由于其低成本和高通量的特点,目前已在小麦等作物中大量应用[16-17]。本研究针对水稻TAC1基因的功能位点开发了基于STARP技术的分子标记,并鉴定164份杂交稻的基因型,为
TAC1基因的有效利用提供参考,并为分子标记辅助选择提供有效的工具。
1 材料与方法
1.1 试验材料
以93-11、日本晴、蜀恢498及福建省农业遗传工程重点实验室已测序的56份常规水稻品种作为分子标记准确性的验证材料,164份杂交稻品种为福建省农业遗传工程重点实验室本课题组收集保存。所有材料种植在福州市寿山乡。
1.2 TAC1基因的STARP分子标记开发
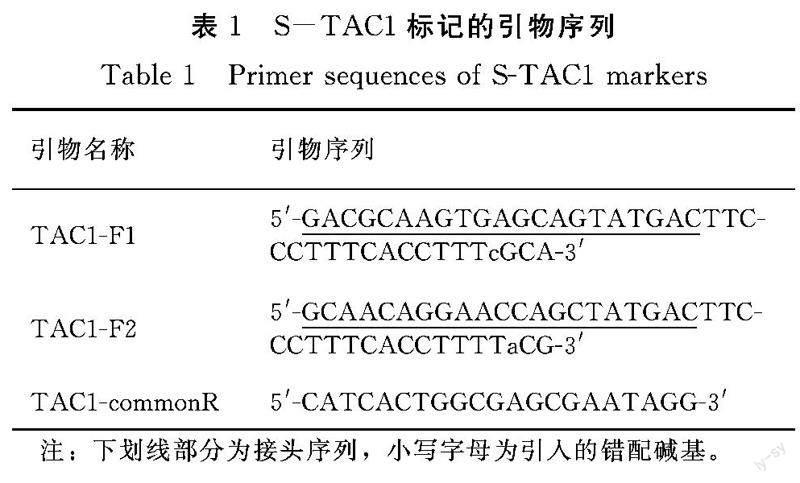
根据TAC1基因第4内含子剪切位点碱基A突变为G的单碱基变异位点设计STARP引物S-TAC1,截取变异位点5′端19 bp作为位点特异扩增引物。位点特异引物TAC1-F1的3′末端的倒4位碱基由T替换为C,5′末端接Tail2,TAC1-F2的3′末端的倒3位碱基由G替换为a,5′末端接Tail1,公共反向引物TAC1-commonR为5′-CATCACTGGCGAGCGAATAGG-3′(表1)。通用荧光引物为PEA1-QFAM:5′-d FAM-AGCTGGTT-Sp9-GCAACAGGAACCAGC-T(Dabsyl)-ATGAC-3′,PEA2-QHEX:5′-d HEX-ACTGCTCA-Sp9-GACGCAAGTGAGCAG-T(Dabsyl)-ATGAC-3′ ,由生工生物工程(上海)股份有限公司合成。根据接头的不同,扩增产物中松散型等位基因TAC1(A)为Hex信号,而紧凑型等位基因tac1(G)为Fam信号。
1.3 DNA提取及基因型分析
取水稻苗期叶片,利用CTAB法提取基因组DNA。PCR扩增体系参考Long等[15],10 uL反应体系中分别添加10 μmol·L-1的TAC1-F1、TAC1-F2、TAC1-commonR、PEA1-QFAM和PEA2-QHEX引物0.04、0.04、0.2、0.1和0.1 μL,takara Taq(5 U·μL) 0.2 μL。PCR反应程序为,94℃ 3 min变性;第1阶段循环为9℃ 20 s,56℃退火延伸2 min,每个循环降低1℃,共6个循环;第2阶段循环为94℃ 20 s,62℃退火延伸90 s,42个循环;最后62℃延伸2 min。在实时荧光定量PCR仪QuantStudioTM 3上读取荧光信号值,根据信号比值判断TAC1基因型。2 结果与分析
2.1 水稻功能分子标记S-TAC1的验证
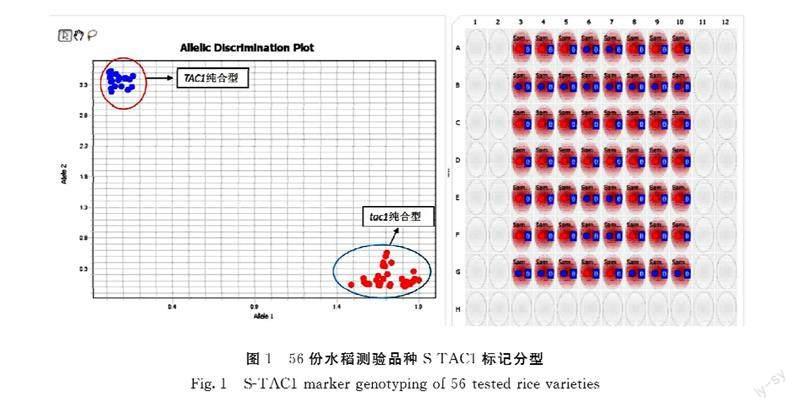
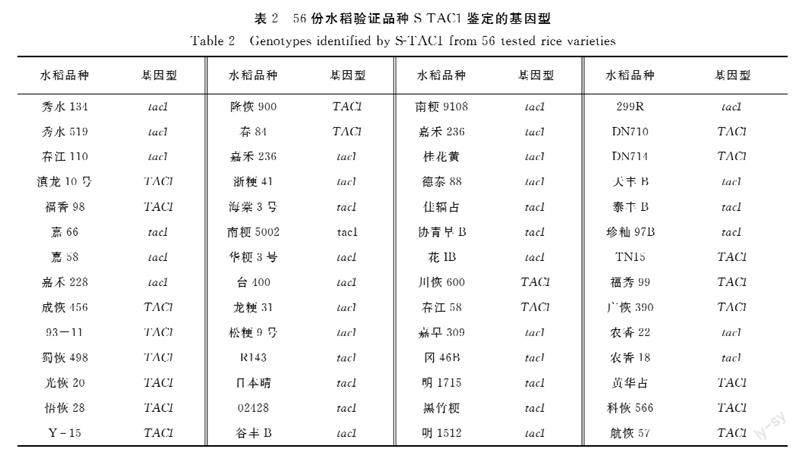
为验证所开发的功能标记的准确性,用S-TAC1分析已知基因组序列的常规水稻品种共56份(图1)。日本晴、93-11和蜀恢498为已公布参考基因组序列的水稻品种,基因型分别为tac1、TAC1和TAC1,其余53份样品为本课题组已测序水稻品种。S-TAC1分型结果显示所有56份样品明显分为两个不同类群(图1),其中紧凑纯合型tac1/tac1 36份,松散纯合型TAC1/TAC1 20份(表2)。基因型为紧凑纯合型tac1/tac1的36份水稻为日本晴、南粳9108等20份常规粳稻、天丰B等7份保持系、农香22等5份常规籼稻、R143等4份恢复系。籼稻93-11、蜀恢498等20份籼稻为松散纯合TAC1/TAC1基因型。分型结果和已测序结果完全一致,表明S-TAC1能准确区分TAC1不同基因型,可以用于TAC1基因型的鉴定。
2.2 164份杂交稻TAC1基因型分析
由表3可知,164份杂交稻品种只有TAC1/TAC1松散纯合型和TAC1/tac1杂合型等2种基因型,未检测到tac1/tac1紧凑纯合型。TAC1/tac1杂合型杂交水稻62份,其中有以籼粳杂种优势而闻名的甬优系列杂交水稻6份,以谷丰A为母本的谷优2736和谷优353,以泰丰A为母本的泰优068,以天丰A为母本的天优382、天优827和天优华9。而TAC1/TAC1松散纯合型杂交水稻102份,全部为籼型杂交水稻。
3 讨论与结论
水稻是一种多分蘖的禾本科作物,其产量由单位面积内的穗数、穗粒数及粒重等3个主要因素构成。紧凑的株型虽然单位面积有效穗数增多,但会导致光合效率下降,田间通风透气性降低,抗病性下降。大分蘖角的株型采光透气性良好,但由于分蘖数减少,影响水稻产量。因此在育种中培育适中的分蘖角是水稻株型育种的一个重要考量因素。
TAC1基因是利用松散型的籼稻品种IR24和粳稻品种Asominori构建的近等基因系,通过经典的图位克隆鉴定的一个控制水稻分蘖角度的基因。籼稻中大多为松散型的TAC1基因,而粳稻为紧凑型的tac1基因。陈宗详等[18]研究发现TAC1基因与tac1基因相比较,分蘖角度仅增加8.4°~13.7°,显性的TAC1基因可以改善株型紧凑品种的分蘖角,提高纹枯病抗性水平。Huang等[12]认为由于TAC1基因的半显性效应使得杂交稻有合适的分蘖角,是杂种优势的关键基因。在本研究中,鉴定了164份杂交水稻,杂合型TAC1/tac1基因为62份,特别是以籼粳杂种优势利用为主要特点的甬优系列杂交水稻都为杂合型。松散型TAC1/TAC1纯合基因型的杂交水稻有102份,但有意思的是,在本研究中没有检测到tac1/tac1紧凑型基因的杂交水稻。一方面的原因在于目前所使用恢复系大多为松散型TAC1基因型[12],另一方面可能在于过于紧凑的株型的杂交水稻育种实践没有被选择。对164份杂交水稻TAC1基因型检测结果暗示过于紧凑的株型可能不利于杂交水稻,特别是籼型杂交水稻的生产。分析结果有助于在育种实践中更好地利用TAC1基因。
本研究所开发的基于STARP技术的S-TAC1标记能准确快速地鉴定TAC1基因型,和四引物分子标记系统相比,省去了凝胶电泳步骤,适合高通量大规模的检测,提高分子标记辅助选择的效率。而和PARMS标记相比,基于STARP技术的分子标记同样高效,但由于其在位点特异引物的3′端倒3或倒4位分别引入错配碱基,更有利于2条位点特异引物的竞争性扩增,能对包括SNP和INDEL等多种类型的变异位点进行检测。STARP技术使用普通Taq酶,不依赖于特定的商业公司,降低了检测成本。基于STARP技术的优点,目前已在小麦等多种作物获得了较为广泛的应用
[16-17],但在水稻中还较少应用。本研究针对水稻TAC1基因所开发的S-TAC1为标记辅助选择提供了高效低成本的分子标记。
参考文献:
[1]JIN J,HUANG W,GAO J,et al.Genetic control of rice plant architecture under domestication[J].Nat Genet,2008,40:1365-1369.
[2]TAN L,LI X,LIU F,et al.Control of a key transition from prostrate to erect growth in rice domestication[J].Nat Genet,2008,40:1360-1364.
[3]WU X,TANG D,LI M,et al.Loose Plant Architecture1, an INDETERMINATE DOMAIN Protein Involved in Shoot Gravitropism, Regulates Plant Architecture in Rice[J].Plant Physiology,2013,16(1):317-329.
[4]LI P,WANG Y,QIAN Q,et al.LAZY1 controls rice shoot gravitropism through regulating polar auxin transport[J].Cell Research,2007,17(5):402-410.
[5]HUANG L,WANG W,ZHANG N,et al.LAZY2 controls rice tiller angle through regulating starch biosynthesis in gravity-sensing cells[J].New Phytologist,2021,231(3):1073-1087.
[6]CAI Y,HUANG L,SONG Y,et al.LAZY3 interacts with LAZY2 to regulate tiller angle by modulating shoot gravity perception in rice[J].Plant Biotechnol J,2023:https://doi.org/10.1111/pbi.14031.
[7]WANG L,XU Y,ZHANG C,et al.OsLIC,a Novel CCCH-Type Zinc Finger Protein with Transcription Activation,Mediates Rice Architecture via Brassinosteroids Signaling[J].PLOS ONE,2008,3(10):e3521.
[8]ZHANG W,TAN L,SUN H,et al.Natural Variations at TIG1 Encoding a TCP Transcription Factor Contribute to Plant Architecture Domestication in Rice[J].Molecular Plant,2019,12(8):1075-1089.
[9]YU B,LIN Z,LI H,et al.TAC1,a major quantitative trait locus controlling tiller angle in rice[J].The Plant Journal,2007,52(5):891-898.
[10]DONG H,ZHAO H,XIE W,et al.A Novel Tiller Angle Gene,TAC3,together with TAC1 and D2
Largely Determine the Natural Variation of Tiller Angle in Rice Cultivars[J].PLoS Genetics,2016,12(11): e1006412.
[11]LI H,SUN H,JIANG J,et al.TAC4 controls tiller angle by regulating the endogenous auxin content and distribution in rice[J].Plant Biotechnology Journal,2021,19(1):64-73.
[12]HUANG X H,YANG S H,GONG J Y,et al.Genomic architecture of heterosis for yield traits in rice[J],Nature,2016,537(7622):629-633.
[13]陳国鑫,陈冰,李昊澍,等.四引物分子标记鉴定水稻光合效率基因TAC1的不同基因型[J].分子植物育种,2020,18(7):2225-2232.
[14]GAO J,LIANG H,HUANG J,et al.Development of the PARMS marker of the TAC1 gene and its utilization in rice plant architecture breeding[J].Euphytica,2021,217:49.
[15]LONG Y M,CHAO W S,MA G J,et al.An innovative SNP genotyping method adapting to multiple platforms and throughputs[J].Theor Appl Genet ,2017,130:597-607.
[16]WU Y,LI M,HE Z,et al.Development and validation of high-throughput and low-cost STARP assays for genes underpinning economically important traits in wheat[J].Theor Appl Genet,2020,133:2431-2450.
[17]CHEN Z,KE W,HE F,et al.A single nucleotide deletion in the third exon of FT-D1 increases the spikelet number and delays heading date in wheat (Triticum aestivum L.) [J].Plant Biotechnology Journal,2022,20(5):920-933.
[18]陳宗祥,冯志明,王龙平,等.水稻分蘖角基因TAC1的育种应用价值分析[J].中国水稻科学,2017,31(6):590-598.
(责任编辑:柯文辉)
收稿日期:2023-03-16
作者简介:杨绍华,男,1976年生,博士,副研究员,主要从事水稻分子遗传与育种研究。
基金项目:福建省科技计划公益类项目(2019R1027-9);福建省科技计划重大专项(2020NZ08017)。
