赤红球菌提取物的制备及其化学成分分析
2023-07-13程贤陈洲琴张祝兰杨煌建严凌斌王德森连云阳
程贤 陈洲琴 张祝兰 杨煌建 严凌斌 王德森 连云阳

摘 要:为建立赤红球菌提取物制备新工艺,以赤红球菌Rhodococcus ruber FIM12为试验材料,通过单因素试验优化赤红球菌提取物制备条件,并进一步分析其类脂化合物、总糖、氨基酸等主要成分。结果表明:赤红球菌提取物制备收率为100 g湿细胞可制备3.97 g赤红球菌提取物,其类脂化合物含量为17.48%,多糖含量44.1%,含有1种氨糖(细胞壁特征氨基酸)和18种氨基酸(其中包含8种人体必需氨基酸),种类较为丰富。研究结果可为深入开发利用赤红球菌提取物可供参考。
关键词:赤红球菌;制备;多糖;氨基酸
中图分类号:Q 936 文献标志码:A 文章编号:0253-2301(2023)04-0042-06
DOI: 10.13651/j.cnki.fjnykj.2023.04.006
Preparation of Rhodococcus ruber Extract and Analysis of Its Chemical Composition
CHENG Xian, CHEN Zhou-qin, ZHANG Zhu-lan*, YANG Huang-jian,YAN Ling-bin, WANG De-sen, LIAN Yun-yang*
[Fujian Institute of Microbiology / Fujian Key Laboratory of New Drugs (Microbiology)Screening, Fuzhou, Fujian 350007, China]
Abstract: In order to establish a new process for the preparation of Rhodococcus ruber extract, by taking Rhodococcus ruber FIM-12 as the experimental material, the preparation conditions of Rhodococcus ruber extract were optimized by using the single factor test, and the main components such as lipoic acid, total polysaccharide and amino acids were further analyzed. The results showed that: the preparation yield of Rhodococcus ruber extract was as follows: 3.97 g Rhodococcus ruber extract could be prepared from 100 g wet cells, which contained 17.48% lipoic acids and 44.1% polysaccharides. It contained 1 kind of glucosamine (cell wall characteristic amino acid) and 18 kinds of amino acids (including 8 kinds of essential amino acids), with relatively rich species. The research results could provide reference for the further development and utilization of Rhodococcus ruber extract.
Key words: Rhodococcus ruber; Preparation; Polysaccharide; Amino acid
目前,BCG-CWS(卡介苗細胞壁骨架)[1]、N-CWS(红色诺卡氏菌细胞壁骨架)[2]等微生物菌体提取物已被研究表明具有良好的免疫调节功能,其多糖成分具有增强脾淋巴细胞繁殖的生物活性,已获批用于临床。未见赤红球菌提取物研究的相关报道,但赤红球菌与诺卡氏菌细胞壁成分类似,且生长快、易培养,可规模化工业生产,具有很高的研究价值。探索赤红球菌提取物制备新工艺有助于提高提取物收率和产品主要质量控制指标,筛选低毒性溶媒降低生产污染等[3-4]。因此开展赤红球菌提取物的制备工艺研究具有重要意义。
研究发现稀有放线菌细胞壁含有特异性的寡糖、肽聚糖、特殊氨基酸等,具有人体的免疫增强作用[5-6],前期初步试验表明赤红球菌菌体提取物对巨噬细胞等有调节功能,能够增强机体免疫能力,有巨大的发展潜力[7]。本项目以赤红球菌Rhodococcus ruber FIM12为试验材料,开展赤红球菌提取物制备工艺优化研究,同时分析其类脂化合物、总糖、氨基酸等主要成分,为深入开发利用赤红球菌提取物奠定基础。
1 材料与方法
1.1 供试菌株
赤红球菌Rhodococcus ruber FIM12,福建省微生物研究所保藏。
1.2 试剂与仪器
1.2.1 主要试剂 葡萄糖(秦皇岛骊骅淀粉股份有限公司);酵母粉(安琪酵母股份有限公司);蛋白胨(福建省仙游三和生物科技有限公司);牛肉膏(广东环凯微生物科技有限公司);盐酸和氢氧化钠(西陇科学股份有限公司);D阿拉伯糖(纯度>98%,上海源叶生物科技有限公司);甲醇和乙腈(HPLC,美国默克公司);19种氨基酸和葡萄胺标准品(中国食品药品检定研究院)。
1.2.2 培养基 斜面培养基:蛋白胨1.0%、牛肉膏0.3%、NaCl 0.5%、琼脂2.0%、pH7.2;种子培养基:葡萄糖1.0%、酵母粉1.5%、pH 7.2;发酵培养基:同种子培养基。
1.2.3 仪器与设备 台式冷冻离心机(Beckman公司,Allegra X15R)、超净工作台(亚泰科隆公司,1360B)、微生物培养箱(三洋公司,MIR253)、大型恒溫摇床(上海智城分析仪器制造有限公司,ZHWY2102)、超声破碎仪(Sonices,VCX1600)、酶联免疫仪(Molecular Devices公司,SpectraMax M5)、氨基酸分析仪(L8900)、低温冰箱(日本三洋MDF382E型);分析天平(IL京赛多利斯仪器系统有限公司);Allegra X15R型离心机(德国BECKMAN公司);安捷伦1290高效液相色谱仪(美国安捷伦公司)。
1.3 赤红球菌提取物的提取工艺优化
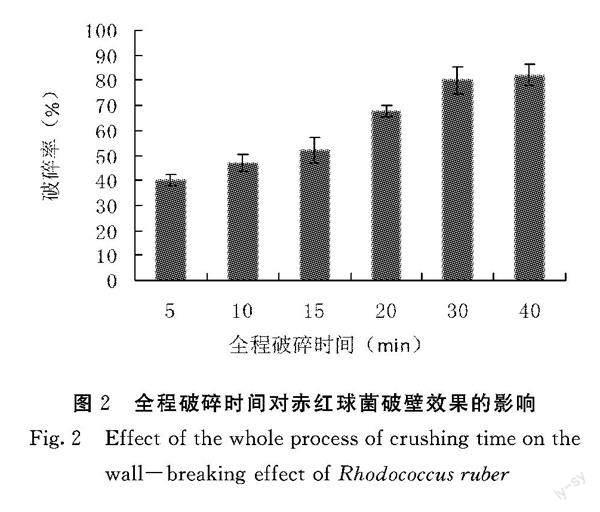
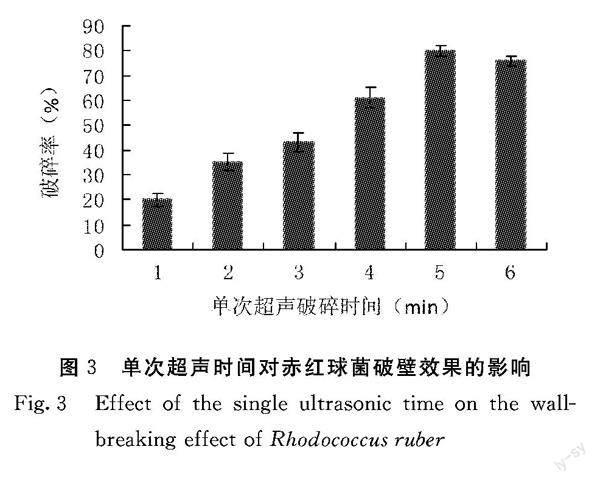
Rhodococcus ruber FIM12接入种子培养基,32℃、230 r·min-1条件下培养42 h,按5%(V/V)接种量移种到发酵培养基中,32℃、230 r·min-1条件下发酵培养120 h。通过单因素试验,分别考察全程破碎时间、单次超声破碎时间、超声波输出功率和液料比对赤红球菌破壁效果的影响。
1.3.1 全程破碎时间对赤红球菌破壁效果的影响 吸取菌悬液1 mL,在单次超声时间为5 min 、超声波输出功率800 w、液料比为4∶1的条件下,考察不同破碎时间(5、10、15、20、30、40 min)对赤红球菌菌体的破壁效果。
1.3.2 单次超声时间对赤红球菌破壁效果的影响 吸取菌悬液1 mL,在总超声时间为30 min、超声波输出功率800 w、液料比为4∶1的条件下,考察不同单次超声时间(1、2、3、4、5、6 min) 对赤红球菌菌体的破壁效果。
1.3.3 超声波输出功率对赤红球菌破壁效果的影响 吸取菌悬液1 mL,在总超声时间为30 min、单次超声时间5 min、液料比为4∶1的条件下,考察不同超声波输出功率(200、300、400、500、600、700、800 w) 对赤红球菌菌体的破壁效果。
1.3.4 液料比对赤红球菌破壁效果的影响 吸取菌悬液1 mL,在总超声时间为30 min、单次超声时间5 min、超声波输出功率800 w的条件下,考察不同液料比(1∶1、2∶1、3∶1、4∶1、5∶1、6∶1 ) 对赤红球菌的破壁效果。
通过血球计数板计数,算出每毫升中Rhodococcus ruber湿细胞破碎前的数目(S0)和破碎后的数目(S1),按下式计算破碎率(Q):
Q=(S1-S0)×100%
1.4 赤红球菌提取物的制备
Rhodococcus ruber FIM12发酵液离心弃上清液,用纯水洗涤Rhodococcus ruber FIM12湿菌体1次,将湿菌体细胞置于-80℃低温24 h,反复冻融2次;以1∶4比例将纯化水加入湿细胞中,在冰水浴条件下超声波破碎处理,超声功率 800 w,超声时间5 min,间隔时间2 min,总时间30 min;以胰蛋白酶糜蛋白酶及链蛋白酶处理细胞壁碎片消化蛋白质2次,以无水乙醇提取3 次,离心即得赤红球菌提取物。制备3批。
1.5 赤红球菌提取物的化学成分检测
1.5.1 类脂化合物分析 精密称取赤红球菌提取物样品50 mg,加入2.5% 2 mL NaOH溶液,在20 mL甲醇∶苯=1∶1(v
∶v)条件下回流水解2 h。水解液用1 mol·L-1的HCl中和后用乙醚提取3次,收集3次乙醚层进行浓缩,浓缩液用无水乙醇进行精制,即得到类脂化合物[6,8]。重复提取精制3批。
1.5.2 多糖含量测定 精密称取在60℃减压干燥1 h的阿拉伯糖对照品适量,将阿拉伯糖配成每1 mL含阿拉伯糖5、10、15、20、30、40、50 μg 的溶液,精密量取上述溶液各2 mL置具塞试管中,在冰浴冷却条件下,分别加入2.0% 蒽酮乙酸乙酯液0.5 mL,浓硫酸4.0 mL,摇匀,于80℃水浴保温30 min,立即用流水冲冷至室温,以分光光度法于625 nm 波长处测定光密度( 以纯水代替标准溶液作空白对照) ,横坐标为阿拉伯糖浓度,纵坐标为光密度值,绘制标准曲线。标准曲线见图1。
采用分析天平准确称取0.2~0.5 mg赤红球菌提取物样品至具塞试管,加入4 mL蒸馏水混合均匀。然后在冰水浴中加入2%蒽酮乙酸乙酯溶液1.0 mL及浓硫酸8.0 mL摇匀冷却,80℃水浴显色30 min后以流水冲冷至室温,于625 nm测定光密度,根据标准曲线计算多糖含量[9-10]。
1.5.3 氨基酸和氨糖含量测定 分别精密称取18种氨基酸和葡糖胺标准品于50 mL烧杯中,加水超声溶解后配制成10 μmol·L-1的混合氨基酸标准储备液。准确吸取混合氨基酸氨糖标准储备液1.0 mL于10 mL容量瓶中,加水定容至刻度,混匀,为标准上机液。
精密称取赤红球菌提取物样品50 mg加入水解管中,加入4 mL 6 mol·L-1 HCl,氮吹15 min后封管。将水解管置烘箱中110℃水解 22 h,冷却开管将样品转移至100 mL容量瓶中,用水定容至100 mL。准确吸取2 mL水解液,置氮吹仪于温度60℃下脱至干燥。再准确加入1 mL 0.02 mol·L-1 HCl,混匀后过0.22 μm过滤小柱。
混合氨基酸氨糖标准储备液和样品测定液分别以同体积进样氨基酸分析仪。色谱条件:色谱柱:离子交换树脂、阳离子树脂层析柱(200 mm×4.6 mm),显色剂:茚三酮 ;缓冲液系统:pH 5.4的2
mol·L-1醋酸缓冲液 ;流速:0.2 mL·min-1;柱温55℃,反应室温138℃。测定在440 nm和570 nm波长下的吸光度,以外标法通过峰面积计算样品液中的氨基酸和氨糖浓度[11]。
2 结果与分析
2.1 赤红球菌提取物的提取工艺优化
2.1.1 全程破碎时间对赤红球菌破壁效果的影响 由图2可知,在单次超声时间为5 min 、超声波输出功率800 w、液料比为4∶1的条件下,细胞的破碎率随着全程破碎时间的延长而明显增加,这说明破碎时间的延长可以增加超声波对细胞壁的破坏,有利于细胞的整体破碎。当破碎总时长为30 min时,破碎率达到80%以上。继续延长破壁时间至40 min,破碎率没有明显提高,并且时间太长容易破坏蛋白质的结构和性质,因此选择细胞破碎时间为30 min。
2.1.2 单次超声时间对赤红球菌破壁效果的影响 由图3可知,在总超声时间为30 min、超声波输出功率800 w、液料比为4∶1的条件下,单次超声在1~5 min内,随着超声时间的延长,破碎率也随之增加,但是在5~6 min后,破碎率随着超声时间的延长反而降低。这是因为超声波通过空化效应破碎细胞的过程其实就是空化泡形成、振动、压缩和崩溃闭合的过程,短时多次的工作方式有利于空化泡有足够的时间去完成膨胀和爆炸的过程,因此选择单次破碎时间为5 min。
2.1.3 超声波输出功率对赤红球菌破壁效果的影响 由图4可知,在总超声时间为30 min、单次超声时间5 min、液料比为4∶1的条件下,细胞的破碎率随着超声波输出功率的增加而明显增加,这是因为输出功率越大越有利于空化泡的形成与爆破,使破碎作用增强。仪器的最大功率为800 w,因此选择输出功率为800 w。
2.1.4 液料比对赤红球菌破壁效果的影响 由图5可知,在总超声时间为30 min、单次超声时间5 min、超声波输出功率800 w的条件下,随着液料比的增加,赤红球菌菌体破碎率逐渐升高。当液料比为 4∶1时,赤红球菌菌体破碎率最高,随后赤红球菌菌体破碎率有所下降。因为浓度太低的时候减少了空化泡膨胀和爆破过程中与细胞接触的机会,而浓度过高的时候溶液黏度增加,不利于空化泡的形成、膨胀和爆炸[12]。因此,适宜的液料比为 4∶1。
2.1.5 赤红球菌提取物的制备 称取100 g赤红球菌湿细胞制备赤红球菌提取物,连续5批次制备得到4.05、3.95、3.86、4.15及3.83 g的赤红球菌提取物干粉,赤红球菌提取物制备平均收率为3.97 g·hg-1湿赤红球菌细胞。
2.2 赤红球菌提取物的化学成分分析
2.2.1 类脂化合物含量 通过溶媒提取精制3批赤红球菌提取物,其类脂化合物含量分别为887、876、859 mg·hg-1,占赤红球菌提取物含量的17.74%、17.52%、17.18%,平均值为17.48%。而类脂化合物本身具有很强的生物活性[5],赤红球菌提取物中类脂化合物含量是产品质量的主要控制指标。
2.2.2 多糖含量 由表1可知,通过蒽酮硫酸法测定赤红球菌提取物的多糖含量,测定结果分别为43.6%、42.8%、45.8%,平均值为44.1%。多糖含量决定赤红球菌提取物的生物活性,是重要控制指标。
2.2.3 氨基酸和氨糖含量测定 由表2(图6)可知,赤红球菌提取物含有1种氨糖(细胞壁特征氨基酸)和18种氨基酸(其中包含8种人体必需氨基酸),种类较为丰富。含量较高的几种氨基酸分别为丙氨酸 57.26 mg·g-1、谷氨酸 52.637 mg·g-1、酪氨酸 49.665 mg·g-1、丝氨酸 42.103 mg·g-1、亮氨酸40.308 mg·g-1、苏氨酸39.587 mg·g-1、二氨基庚二酸38.230 mg·g-1。
3 结论与讨论
本试验通过对赤红球菌Rhodococcus ruber FIM12培养提纯获得赤红球菌提取物,通过单因素试验研究了全程破碎时间、单次超声破碎时间、超声波输出功率和液料比对赤红球菌破壁效果的影响,得到了赤红球菌最优破壁工艺条件:全程破碎时间为30 min、單次超声时间为5 min、超声波输出功率800 w、液料比为4∶1,在该条件下,赤红球菌提取物制备效率为100 g湿细胞可制备3.97 g赤红球菌提取物。
同时,对赤红球菌提取物进行化学成分分析,结果表明赤红球菌提取物中类脂化合物17.48%,多糖含量44.1%,含有丙氨酸、谷氨酸、二氨基庚二酸等18种氨基酸和葡糖胺。微生物多糖,特别是糖缀化合物的糖链参与了多种生物学活动,如细胞识别、粘连与融合、信号传导、细胞分化、免疫调节与应答等,具有很高的生物活性[13-14],氨基酸是人体不可或缺的重要物质之一,不仅可以为身体提供能量还可以提高免疫力,具有很高的生物活性[15-16]。从化学成分来看,与BCG-CWS,N-CWS等菌体提取物成分相似,可望作为一种新的免疫调节剂进行开发。本研究建立了赤红球菌提取物优化制备工艺并较系统地研究了其主要化学成分,为赤红球菌活性提取物的规模化生产和质量控制奠定基础。
参考文献:
[1]石虹,于鸿,张健,等.BCG-CWS对荷瘤小鼠红细胞免疫功能的影响[J].实用肿瘤学杂志,1998(4):249-250.
[2]李子强,贾云宏,杨殿深.稀有放线菌产生抗菌药物的多样性[J].中国现代应用药学,2013,30 (12):1373-1384.
[3]SHINTANI M, SUGIYAMA K, SAKURAI T, et al.Biodegradation of A-fuel oil in soil samples with bacterial mixtures of Rhodococcus and Gordonia strains under low temperature conditions[J].J Biosci Bioeng, 2019,127(2):197-200.
[4]ALI BH, ZIADA A, BLUNDEN C.Biological effects of gum arabic:A review of some recent research[J].Food and Chemical Toxicology,2009,47(1):1-8.
[5]DAI Z L,YANG W L,FAN Z X, et al.Actinomycetes Rhodococcus ruber CGMCC 17550 degrades neonicotinoid insecticide nitenpyram via a novel hydroxylation pathway and remediates nitenpyram in surface water [J].Civil Engineering and Technology,2021,270:128670-128670.
[6]CUNHA I,SILVA A,VASCONCELOS A, et al.Biotechnological potential of actinobacteria isolated from rhizosphere of the medicinal plant, Ipomoea pes-caprae(L.) R.Br[J].African journal of microbiology research, 2014,8(52):4020-4026.
[7]陈洲琴,张祝兰, 程贤, 等.Rhodococcus ruber FIM-12菌株的分离鉴定及其生物活性研究[J].宁夏大学学报(自然科学版), 2022, 43(3):288-292.
[8]陶冉.银杏叶类脂分离、衍生物合成及其生物活性研究[D].北京:中国林业科学研究院,2013.
[9]张祝兰,林善,唐文力,等.红色诺卡氏菌细胞壁骨架的理化性质、化学成分及含量测定的研究[J].中国抗生素杂志,2002(9):532-534.
[10]林艺华.硫酸蒽酮法测定风柜斗草粗多糖含量[J].福建分析测试,2017,26(6):52-55.
[11]苗艳丽,宋文东.菲牛蛭中脂肪酸和氨基酸的分析[J].福建分析测试,2007,16(2):49-51.
[12]魏德洲,贾春云,曹成有,等.Nocardia细胞的破碎方法及其IR光谱分析[J].东北大学学报(自然科学版),2007,28(12):1749-1753.
[13]ALI B H, ZIADA A, BLUNDEN C.Biological effects of gum arabic: A review of some recent research[J].Food and Chemical Toxicology, 2009, 47(1): 1-8.
[14]练冬梅,姚运法,赖正锋,等.菜用黄麻粗多糖含量的测定及其单糖组成分析[J].福建农业科技,2019,50(6):14-17.
[15]史琦云,邵威平.八种食用菌营养成分的测定与分析[J].甘肃农业大学学报,2003,38 (3):336-339,345.
[16]林铃,张琪辉,马涛,等.真姬菇氨基酸类风味物质超声波提取工艺优化[J].福建农业科技, 2020, 51(3): 17-21.
(責任编辑:柯文辉)
收稿日期:2023-02-25
作者简介:程贤,女,1993年生,硕士,研究实习员,主要从事微生物药物研究。
*通信作者:张祝兰,女,1966年生,研究员,主要从事微生物药物研究(E-mail:jessylan9963@sina.com);连云阳,男,1969年生,博士,研究员,主要从事微生物新药研究(E-mail:ylianfim@139.com)。
基金项目:福建省科技计划公益类项目(2020R10050014、2020R10050016)。
