医疗器械生产企业不良事件监测工作存在的问题及建议
2023-07-12玄怡王茜桑媛通信作者
玄怡,王茜,桑媛(通信作者)
1 山东省药品不良反应监测中心 (山东济南 250000);2 威海市食品药品检验检测研究院 (山东威海 264200)
《医疗器械不良事件监测和再评价管理办法》[1](以下简称“办法”)指出,我国要建立医疗器械不良事件监测制度,药品监督管理部门要加强对不良事件监测工作的监督检查力度。我国的医疗器械不良事件监测工作起步较晚,基础比较薄弱,尤其是2019 年新办法正式实施之后,监管部门对当前的监测工作现状及法规执行情况缺乏全面的了解。而随着一系列鼓励医疗器械创新发展政策的实施,驱动产品上市加速[2],对不良事件监测工作提出了更高的要求。开展不良事件监测专项检查工作,是贯彻落实习近平总书记关于食品药品安全“四个最严”要求(最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责),践行全生命周期监管理念的重要手段。
2022 年,山东省药品监督管理局为充分发挥不良事件监测在医疗器械上市后监管和保障公众用械安全中的靶向标作用,深入排查风险隐患,提升全省医疗器械生产企业的不良事件监测能力,开展了与指导帮扶相结合的医疗器械生产企业不良事件监测专项检查工作。本研究介绍了此次专项检查工作的概况,梳理出生产企业不良事件监测存在的主要问题,并从企业和监管机构两方面进行原因分析,提出改进建议,以期提升企业的不良事件监测能力,保障公众用械安全,促进医疗器械产业健康发展。
1 检查概况
此次专项检查工作以日常工作中发现的问题为主要线索,一方面结合企业和产品因素,重点关注监测工作质量、产品风险及当前关注度较高的疫情防控产品相关企业;另一方面,根据地理分布、产品类别、企业类别等遴选具有代表性的企业作为检查对象。依据《医疗器械注册人备案人开展不良事件监测工作检查要点》[3]制定检查内容,包括机构和人员、文件管理、设计开发、不良事件监测分析和改进4 个方面。检查结果主要以限期整改为主;同时,检查组对监测工作质量较差的企业提出了行政处罚和约谈的建议。受疫情影响,此次专项检查工作采用远程检查方式进行,共完成15 家企业的检查工作,涉及辖区6 个市。
2 存在的主要问题
此次专项检查工作发现,企业对不良事件监测工作的认识和理解均有很大的提升,大部分企业已初步建立了不良事件监测体系,监测能力也有了一定的提高,部分监测能力较强的企业开始与监管机构沟通合作,积极参与前沿政策研究;同时,发现企业的不良事件监测工作仍存在较多问题,其监测工作质量与当前法规的要求差距较大。
15 家企业共发现了52 条不符合项(包括不同企业存在的同类问题),见图1。其中,机构和人员、不良事件监测分析和改进合计占总不符合项的70%以上。虽然文件管理和设计开发因检查内容较少,不符合项的条数也比较少,但约有一半的企业存在文件管理和设计开发不符合的问题。以上问题是当前不良事件监测工作中普遍存在的问题。检查只是发现问题的手段,解决问题才是检查的目的,所以我们暂时未对不符合项进行一般缺陷和关键缺陷分类,对于大部分不符合项已现场反馈企业并进行相应指导。根据此次检查工作要点梳理的企业监测工作主要问题见表1。

表1 医疗器械企业不良事件监测专项检查不符合项主要问题
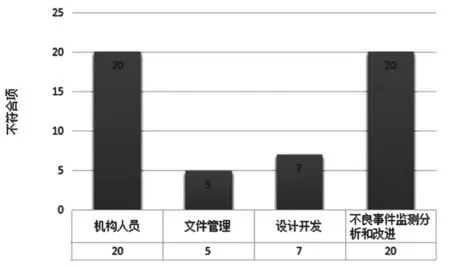
图1 医疗器械企业不良事件监测专项检查不符合项数据
3 原因分析
不良事件专项检查对企业把控质量、监管机构管控风险具有非常大的良性影响。此次专项检查工作发现的问题不仅与生产企业相关,还与监管机构规范化体系建设不足有关,现从企业和监管机构两方面进行原因分析。
3.1 生产企业的不良事件监测能力有待提高
(1)生产企业主体责任意识欠缺,对医疗器械不良事件风险管理重视程度不足,主动开展监测工作的积极性不高,法规执行质量也有待提高[4]。(2)生产企业不良事件监测体系不健全,部分企业机构、部门、人员职责不明确,人员和资源配备投入不足,直接影响质量体系的执行,在制度建设方面有待进一步加强。(3)生产企业文件管理体系不完善,未能涵盖质量管理的全部内容,与经营、运输等受托方各自制定文件,无法保证双方质量管理体系有效衔接,沟通机制不健全。
3.2 监管机构的监管能力与产业发展规模不匹配
(1)由于医疗器械产品品种越来越丰富、技术趋专业化,而监管人员知识储备不足,对法规文件的理解存在偏差,无法很好地对生产企业的不良事件监测工作进行指导。(2)医疗器械生产企业数量较多,监管机构工作量大,存在监管无力的情况,无法有效监管生产企业的政策执行情况。(3)监管机构在引导不良事件上报单位(如医疗机构)配合生产企业不良事件调查方面工作不足[5],主动服务行业发展的意识还有待进一步提升。(4)科学监管信息化建设尚不完善,缺乏一个公开、系统、全面的不良事件专项检查数据库。
4 改进建议
4.1 生产企业强化主体责任落实
生产企业应从以下几方面强化主体责任落实。(1)深入学习不良事件法律法规、指南文件,积极参加相关培训及上市后研究[6],不断提升不良事件监测能力。(2)切实从器械质量第一责任人的角度出发,合理设置组织机构,成立专门的质量管理部门,配备与企业规模相适应的专业人员。(3)在文件及制度落实、计划执行等方面,生产企业还应加强评估和考核,确保监测活动能够持续满足法规的要求及企业实际工作需要。(4)梳理文件目录,确保质量管理文件没有遗漏,在文件制定过程中要与受托方质量管理体系进行衔接,根据双方实际管理方式、产品特点签订详细的委托协议,协议应涵盖双方质量管理活动中涉及的全部内容,并可以清晰界定双方的活动和义务,保存双方各项活动的沟通记录。
4.2 监管机构提升监管能力
监管机构应从以下几方面提升监管能力。(1)充分借助外部专家资源,半其作为技术支撑力量,不断完善检查组织方式,增加实践培训环节,统一监管人员检查标准,提升法规的执行力度,引导企业尽快建立与法规要求相适应的不良事件监测体系。(2)继续推进专项检查,根据企业持有产品数量、产品风险、质量管理水平、不良事件监测体系建设等因素,对企业进行分级、分类管理,依据企业风险级别合理制定监督检查频次和检查深度,更加有效地利用监管资源,提高监管的力度。(3)加强对检查结果的利用,通过表彰、鼓励和典型示范等引领企业不断提升监测工作质量。(4)丰富不良事件宣传培训的内容和形式,提升不良事件上报单位对企业进行不良事件调查的理解和支持,推动社会共治,从而促进企业不良事件监测工作高质量发展。(5)建立检查数据库,收录不良事件检查相关信息,实现检查信息共享,提升监管效率。
5 小结
专项检查工作是医疗器械不良事件监测工作发展史中迈出的重要一步,也是对医疗器械不良事件监测工作检查组织形式的一次探索。本研究结合2022 年山东省药品监督管理局开展的医疗器械生产企业不良事件监测专项检查工作实践,总结生产企业不良事件监测存在的主要问题,并提出了改进建议。但专项检查工作不同于飞行检查,其缺少生产现场检查环节,主要通过查看文件资料、监测系统和人员访谈等环节了解企业监测工作的开展情况。此检查方式虽然具有其特有的优势[7],但还要充分考虑企业配合、网络安全和检查诚信等问题。目前,相关部门尚未正式出台远程检查相关的规章制度,远程检查仅是特殊情况下的过渡措施和不良事件现场检查的补充形式,在以后的工作中可以将两者充分结合,以提高专项检查工作的质量。
