磁珠法提取新型冠状病毒核酸的稳定性
2023-07-12秦冬梅杨志通信作者肖光军周波曾玉兰
秦冬梅,杨志(通信作者),肖光军,周波,曾玉兰
1 大英县人民医院 (四川大英 629300);2 遂宁市中心医院 (四川遂宁 629000)
新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)核酸检测结果在新型冠状病毒肺炎(corona virus disease 2019,COVID-19)的诊疗过程中具有极其重要的作用,既是确诊证据,又是解除隔离管理标准和出院标准[1]。实时荧光逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)法具有操作方便、快速、高效、高特异性、高灵敏度等优点[2-3],因此成为我国绝大多数实验室检测SARS-CoV-2 核酸的首选方法[4]。而核酸提取是实时荧光RT-PCR法必不可少的前处理步骤,其中磁珠法因具有快捷、高效、重复性好、高通量、自动化等优点[5-6]而被广泛采用。
磁珠法提取核酸所需时间明显短于实时荧光RTPCR 法检测核酸所需时间,因此在SARS-CoV-2 核酸检测工作中时常出现核酸提取后无法立即进行扩增分析的情况,且样本量越大越容易出现该情况。《医疗机构新型冠状病毒核酸检测工作手册(试行第二版)》[7]明确规定了无法及时检测样本的保存方式,但并未明确无法及时检测的核酸保存方式。本研究初步探索了磁珠法提取SARS-CoV-2 核酸及其与试剂混合后在4 ℃和20 ℃条件下的稳定性,现报道如下。
1 材料与方法
1.1 样本来源
以国家卫生健康委员会临床检验中心(National Center for Clinical Laboratories,NCCL)和 四 川 省临床检验中心(Sichuan Province Center for Clinical Laboratories,SPCCL)提供的室间质量评价(external quality assessment,EQA)样本作为试验样本,详情如下:NCCL 样本共12 份,为SARS-CoV-2 核酸检测(接收集中隔离点样本检测机构)EQA 活动2022 年第2、3、4、5 次EQA 样本,批号分别为22FEB01、22FEB02、22FEB03、22MAR01、22MAR02、22MAR03、22APR01、22APR02、22APR03、22MAY01、22MAY02、22MAY03,依次编号为A1~A12;SPCCL 样本共20 份,为SARSCoV-2 核酸检测B 室间质评活动2022 年第2、3、4、5 次EQA 样本,批号分别为B220211~B220215、B220311~B220315、B220411~B220415、B220511~B220515,编号依次为B1~B20。将以上样本分为4 组:第1 组包含A1~A3 和B1~B5;第2 组包 含A4~A6 和B6~B10;第3 组 包 含A7~A9 和B11~B15;第4 组包含A10~A12 和B16~B20。
1.2 仪器与试剂
1.2.1 仪器
西安天隆科技有限公司提供的全自动医用PCR分析系统(型号:Gentier96E)和全自动核酸提取仪(型号:GeneRotex96);江苏新康医疗器械有限公司提供的快速混匀器(型号:XK80-A);大龙兴创实验仪器(北京)股份公司提供的掌上离心机(型号:D1008E);青岛海尔生物医疗股份有限公司提供的生物安全柜(型号:HR40-11A2)和医用冷藏冷冻冰箱(型号:HYCD-282A)。
1.2.2 试剂及耗材
西安天隆科技有限公司提供的磁珠法核酸提取或纯化试剂(qEx-DNA/RNA 病毒,规格:64T/盒);圣湘生物科技股份有限公司提供的荧光PCR 法核酸检测试剂盒(48 人份);帝恩生物科技(香港)有限公司提供的8 联PCR 管(0.2 ml,光学平盖);江苏大唐医疗器械有限公司提供的离心管(1.5 ml)。
1.3 方法
1.3.1 样本处理
NCCL 样本为冻干粉,试验前先瞬离,再加入附带的去离子水500 μl,上下颠倒5 次,静置15 min,复溶后用快速混匀器混匀15 s,再用掌上离心机离心15 s。
SPCCL 样本先于室温下平衡20 min,待解冻后用快速混匀器混匀15 s,再用掌上离心机离心15 s。
1.3.2 核酸提取
取处理后的样本200 μl 至核酸提取或纯化试剂预装板的第1 列或第7 列,再在第2 列和第8 列放入搅拌套,最后放入全自动核酸提取仪并启动核酸提取程序。每份样本均双孔提取,提取完毕的核酸立即转移至离心管。两孔来自同一样本的核酸转移至同一离心管,混匀后瞬离备用。
1.3.3 扩增分析
在试剂储存和准备区按说明书配制核酸检测试剂,并分装至八联管备用。每孔分装30 μl 试剂。在样本制备区的生物安全柜内,取20 μl 待测核酸加入上述已分装试剂的八联管内,盖严管盖,用掌上离心机离心15 s,转移至扩增和产物分析区用全自动医用PCR 分析系统检测。PCR 程序设置如下:逆转录,50 ℃、30 min;预变性,95 ℃、1 min;扩增,95 ℃、15 s,60 ℃、30 s(采集荧光),循环45 次,选择FAM、ROX、HEX 3 个荧光通道。
1.3.4 稳定性试验(靶基因为ORF1ab 基因和N 基因)
SARS-CoV-2 核酸的稳定性。第1 组样本的核酸各检测5 次:提取后立即检测1 次,记录循环阈值(即Ct 值)作为初始结果;余下的核酸于4 ℃保存,分别于第6、12、18、24 天各检测1 次,记录Ct 值作为各次结果;将各次结果与初始结果进行比较。第2 组样本的核酸作相似处理,但核酸保存温度改为20 ℃。无Ct 值时记录为“-”。
SARS-CoV-2 核酸与试剂混合后的稳定性。第3 组样本的核酸提取后立即加入装有扩增试剂的八联管,即与试剂混合成RT-PCR 反应体系。每份核酸各加4 孔,其中1 孔立即检测,记录Ct 值作为初始结果;余下3 孔于4 ℃保存,并在第4、8、16 小时各取1 孔进行检测,记录Ct 值作为各次结果。将各次结果与初始结果进行比较。第4 组样本的核酸作相似处理,但RT-PCR 反应体系的保存温度改为20 ℃。无Ct 值时记录为“-”。
1.4 统计学处理
采用SPSS 19.0 统计软件进行数据处理。比较前剔除无Ct 值的样本,再对剩余样本的检测结果进行配对t检验(双侧检验)。P<0.05 为差异有统计学意义。
2 结果
2.1 SARS-CoV-2 核酸保存不同时间的检测结果比较
SARS-CoV-2 核酸于4 ℃或20 ℃保存24 d 内各次检测结果与初始结果比较,差异均无统计学意义(P>0.05),见表1 和表2。

表1 SARS-CoV-2 核酸于4 ℃保存不同时间的检测结果(ORF1ab 基因/N 基因)

表2 SARS-CoV-2 核酸于20 ℃保存不同时间的检测结果(ORF1ab 基因/N 基因)
2.2 SARS-CoV-2 核酸与试剂混合后保存不同时间的检测结果比较
SARS-CoV-2 核酸与扩增试剂混合后,在4 ℃或20 ℃保存16 h 内各次检测结果与初始结果比较,差异均无统计学意义(P>0.05),见表3 和表4。
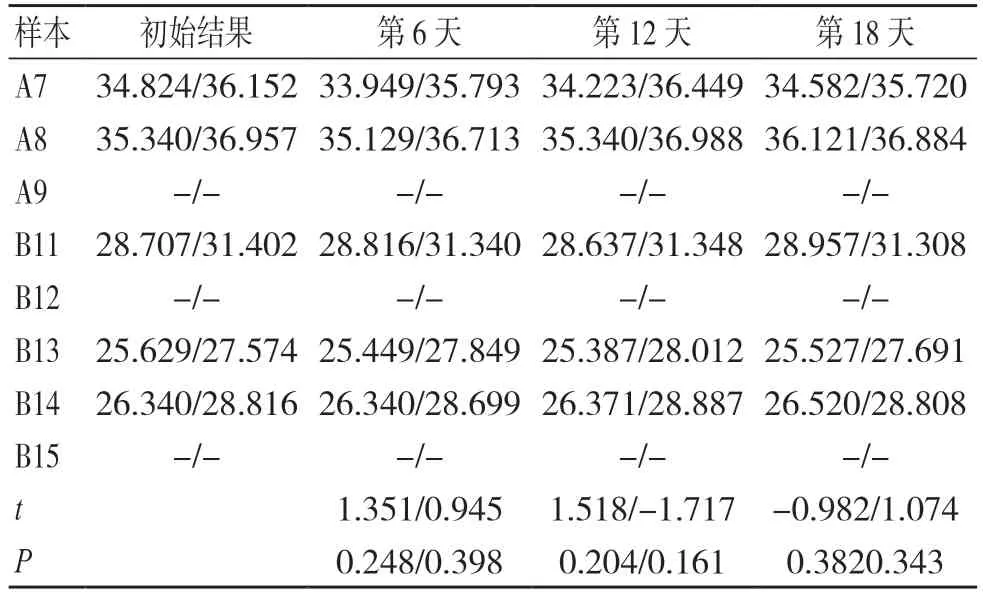
表3 SARS-CoV-2 核酸与试剂混合后于4 ℃保存不同时间的检测结果(ORF1ab 基因/N 基因)
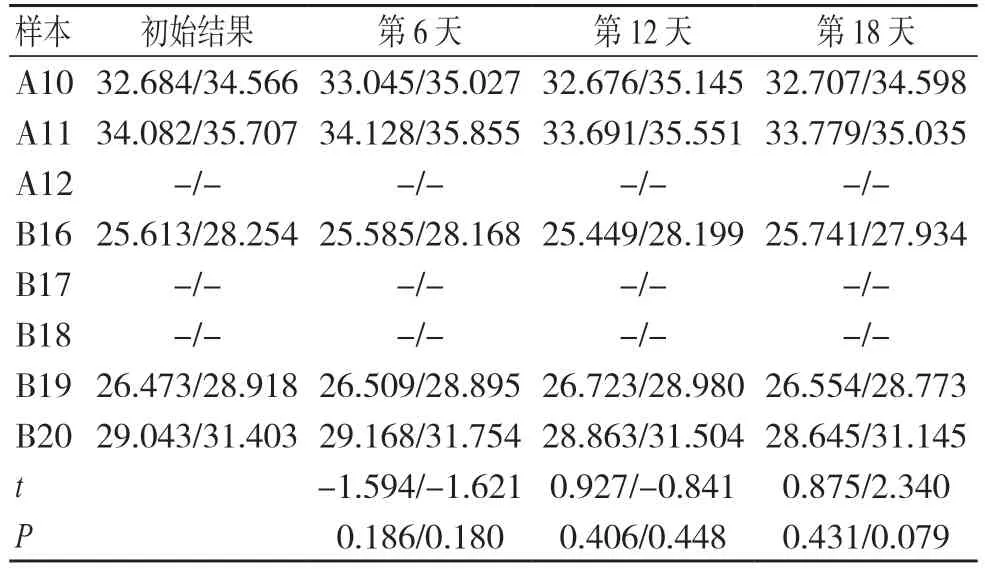
表4 SARS-CoV-2 核酸与试剂混合后于20 ℃保存不同时间的检测结果(ORF1ab 基因/N 基因)
3 讨论
SARS-CoV-2 核酸检测工作为防控疫情做出了突出贡献,是尽快找出传播源、阻断传播链的重要手段。在追求高效率的同时,高质量的检测结果更为重要,假阴性和假阳性结果均会严重影响疫情防控工作进度。《新型冠状病毒肺炎诊疗方案(试行第九版)》[1]规定:连续2 次SARS-CoV-2 核酸检测ORF1ab 基因/N 基因Ct 值均≥35(荧光定量PCR 方法,界限值为40,采样时间至少间隔24 h)是解除隔离管理标准和出院标准。综合以上两点可知:SARS-CoV-2 核酸检测工作除了必须保证定性结果的准确性,还务必要重视Ct 值的准确性和可重复性。根据实时荧光PCR 原理可知,Ct 值与样本核酸浓度的对数呈负相关,因此研究核酸的稳定性对于保证Ct 值的准确性和可重复性具有重要意义。
核酸是脱氧核糖核酸(deoxyribo nucleic acid,DNA)和核糖核酸(ribonucleic acid,RNA)的统称。SARS-CoV-2 基因组为单股正链RNA,全长约29.9 kb。由于环境中广泛存在RNA 酶(RNase),且RNA 为单链结构,故一般认为其稳定性不及DNA,容易降解。本研究结果显示,磁珠法提取的SARS-CoV-2 RNA 表现出良好的稳定性:在4 ℃和20 ℃条件下均能稳定至少24 d。SARS-CoV-2 RNA稳定性良好的原因如下:(1)核酸提取试剂同时具有提取和纯化功能,在工作过程中降解并去除了包括RNase 在内的所有蛋白质,防止了RNase 对RNA 的降解作用;(2)核酸提取试剂最后的洗脱液成分对RNA 具有稳定作用。相关研究显示,其他常见RNA 病毒核酸提取后也表现出良好的稳定性。熊玉娟和周华友[8]发现丙型肝炎病毒(hepatitis C virus,HCV)RNA 在25 ℃和4 ℃条件下可以稳定至少3 d。王婧等[9]也曾报道纯化的HCV RNA 及人类免疫缺陷病毒(human immunodeficiency virus,HIV)RNA 在2~8 ℃条件下至少可以保存7 d。而JOSÉ 等[10]的研究显示,HCV RNA 和HIV RNA在-20 ℃条件下可以稳定5 年以上。但王嫣等[11]的研究发现,HCV RNA 在25、4、-20 ℃条件下保存70 d,其浓度总体呈下降趋势,且前12 d 浓度对数值大约降低1,超出分子诊断领域的允许总误差(total allowable error,TEA)[12]。王嫣等[11]的研究与本研究结果存在差异的原因之一可能是核酸提取方法不同:前者使用的Qiagen RNA 病毒提取试剂盒采用硅胶膜吸附柱法,而本研究所用试剂盒采用磁珠法,两种试剂的组分对RNA 的保护作用可能存在差别。
本研究结果显示,磁珠法提取的SARS-CoV-2 核酸与PCR 试剂混合组成的RT-PCR 反应体系也表现出不错的稳定性:在4 ℃和20 ℃均可以至少保存16 h。其原因可能为:(1)PCR 反应体系中的缓冲液(buffer)既可稳定核酸也可保护RT-PCR反应所需酶(逆转录酶和DNA 聚合酶)的活性,即保证了各成分稳定而不变质;(2)逆转录酶和DNA 聚合酶均具有高温依赖性,4 ℃和20 ℃与两者的启动温度差距较大,即SARS-CoV-2 核酸与试剂混合后在此种温度始终维持不反应的状态。
综上所述,磁珠法提取SARS-CoV-2 核酸在4 ℃或20 ℃可以保存至少24 d,即使与试剂混合后,也可保存至少16 h,检测结果不受影响(Ct 值可重复性良好)。因此,在处理大批量样本时,如遇提取的核酸无法立即进行扩增分析,可以在相应条件下保存一定时间而不会影响检测结果的准确性和可重复性。以最快速度完成核酸提取工作对样本制备区的工作人员有一定益处,毕竟长时间穿着防护服和生物安全柜的噪声等因素对其身心有一定损害。
本研究的局限性在于:(1)所用样本并不含真正的SARS-CoV-2,而是来自基因工程制备的假病毒,与临床样本或许存在差异;(2)受限于样本来源,本研究所用样本量少,浓度覆盖范围窄,结论是否适用于所有浓度水平的样本还有待进一步验证;(3)受样本体积和核酸提取试剂洗脱液体积的共同限制,无法得到足够量的核酸,本研究未探索出磁珠法提取SARS-CoV-2 核酸及其与试剂混合后保持稳定的上限时间,也未能评估该结论是否适用于其他品牌试剂。
