镍钛合金材料体内植入对小鼠免疫功能的影响
2023-07-12戴政宁王蕊管博李华毛永建贺学英通信作者
戴政宁,王蕊,管博,李华,毛永建,贺学英(通信作者)
北京市医疗器械检验研究院·北京市医用生物防护装备检验研究中心 (北京 101111)
镍钛合金是镍和钛的近等原子合金,具有良好的生物相容性、超弹性和形状记忆效应等特性,被广泛应用于医疗器械领域,特别是被用于制备口腔、心血管和骨科植入器械[1]。随着镍钛合金植入器械临床使用率的不断增加,相关并发症的报道也越来越多,镍钛合金材料的免疫原性也引起了学者们的广泛关注。但相关研究并未在某一镍钛合金植入器械的临床使用失败与其引起的免疫反应之间建立明确的联系。
目前,大量科学证据揭示了镍离子对免疫系统的有害影响(包括抑制免疫器官发育、造成淋巴细胞凋亡等)[2];但关于镍钛合金材料体内植入对免疫功能影响的研究较少。基于此,本研究通过将镍钛合金材料植入小鼠皮下,观察其对小鼠免疫功能的影响(包括免疫器官、免疫细胞、抗体和细胞因子的变化),为评价镍钛合金材料的免疫毒性提供依据。
1 仪器、材料与方法
1.1 实验动物与仪器、试剂、材料
实验动物:北京维通利华实验动物技术有限公司提供的SPF 级BALB/c 小鼠20 只,均为雌性、6 周龄,合格证号为SCXK(京)2016-0001。本研究伦理审查编号为BIMT2020-202。
主要仪器、试剂和材料:购于美国BD 公司的BD CANTO PLUS 流 式 细 胞 仪、HorizonTMV450 Rat Anti-Mouse CD45、FITC Hamster Anti-Mouse CD3e、PerCP-CyTM5.5 Rat Anti-Mouse CD19、APC Rat Anti-Mouse CD4、PE-CyTM7 Rat Anti-Mouse CD8a、PE Rat Anti-Mouse CD49b、红细胞裂解液和Th1/Th2/Th17 CBA Kit;购于武汉普诺赛生命科技有限公司的PBS溶液;购于美国赛默飞公司的Thermo MK3 酶标仪,购于美国Bethyl 公司的小鼠IgM 和IgG 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测试剂盒;购于国内某金属材料有限公司的镍钛合金材料(Ni/Ti:55/45)。
1.2 实验方法
将20只小鼠随机分为植入组和对照组,每组10只。实验方法如下:将麻醉后的小鼠固定于手术板上,常规消毒,剪开背部皮肤;植入组将长1 cm、直径2 mm 的圆柱形镍钛合金材料(约0.2 g)植入背部皮下,然后缝合皮肤;对照组剪开背部皮肤后直接缝合。术后第14 、21天两组各取5只小鼠进行如下检测。
1.2.1 体质量和主要免疫器官脏器系数
体质量:每日测量1 次小鼠的体质量。脏器质量系数:术后第14、21 天两组各处死5 只小鼠,用无菌剪刀和镊子取出其脾脏和胸腺,除去多余的结缔组织和脂肪后称重并计算脾脏脏器系数(脾脏质量/体质量)和胸腺脏器系数(胸腺质量/体质量)。
1.2.2 脾脏和胸腺淋巴细胞亚群
术后第14、21 天,取小鼠脾脏,加入PBS 溶液研磨得到细胞混悬液,以1 000 r/min 离心5 min 后去除上清液;每管加入2 ml 红细胞裂解液,裂解3 min,以1 000 r/min 离心5 min 后去除上清液;每管加入5 ml PBS 溶液重悬细胞,以1 000 r/min 离心5 min 后去除上清液,用PBS 溶液调节脾细胞浓度至1×107个/ml;将调节好浓度的脾细胞悬液加入各样本的流式管(100 μl/管),并向各流式管加入相应标记抗体,充分混合均匀,室温下避光反应30 min;每管加入1 ml PBS 溶液重悬细胞,以1 000 r/min 离心5 min 后去除上清液;每管加入0.5 ml PBS 溶液重悬细胞后,采用流式细胞仪获取数据。
处理小鼠胸腺时不加红细胞裂解液,其他步骤与脾脏的处理步骤类似,最后采用流式细胞仪获取数据。
1.2.3 血清IgM 和IgG
术后第14、21 天,于小鼠眼眶取血,制备血清;取100 μl 稀 释 后 血 清(IgM:1 ∶10 000;IgG:1 ∶100 000)及标准品工作液,于37 ℃条件下孵育90 min;弃掉板内液体后,立即加入100 μl 生物素化抗体工作液,于37 ℃孵育60 min,弃掉板内液体,洗板3 次;每孔加入100 μl HRP 酶结合物工作液,于37 ℃孵育30 min,弃掉板内液体,洗板5 次;每孔加入90 μl 底物溶液,于37 ℃孵育15 min 左右,使用Thermo MK3 酶标仪在450 nm 波长下读取数据。
1.2.4 血清Th1/Th2/Th17 细胞因子
术后第14、21 天,于小鼠眼眶取血收集于1.5 ml离心管中,室温下静置60 min,以3 000 r/min 离心10 min 后收集上层血清,于-20 ℃保存备用;制备梯度稀释的标准品工作液,制备捕获微球和检测抗体,在各流式管中加入50 μl 捕获微球,分别在含有捕获微球的各管中加入50 μl 标准品或样品,混匀,室温条件下孵育1 h;每管加入50 μl PE Detection Reagent,轻轻混匀后室温下避光孵育1 h;每管加入1.0 ml 清洗液Wash Buffer,以1 000 r/min离心5 min后去除上清液;每管加入300 μl Wash Buffer 重悬微球,采用流式细胞仪获取数据;最后,导出FCS 数据文件,使用FCAP 软件进行分析。
1.3 统计学处理
2 结果
2.1 体质量和主要免疫器官脏器系数
术后第14、21 天,两组体质量及脾脏、胸腺脏器系数比较,差异均无统计学意义(P> 0.05),见表1。
表1 两组体质量和主要免疫器官脏器系数比较(±s)
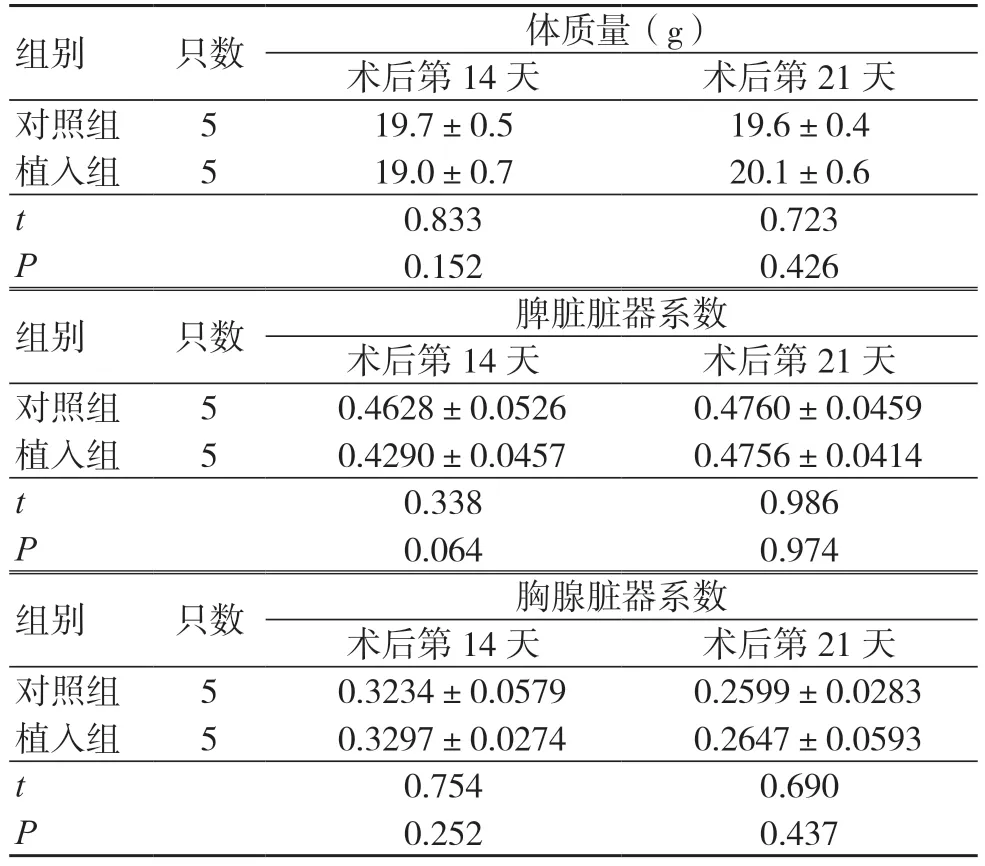
表1 两组体质量和主要免疫器官脏器系数比较(±s)
组别 只数 体质量(g)术后第14 天 术后第21 天对照组 5 19.7±0.5 19.6±0.4植入组 5 19.0±0.7 20.1±0.6 t 0.833 0.723 P 0.152 0.426组别 只数 脾脏脏器系数术后第14 天 术后第21 天对照组 5 0.4628±0.0526 0.4760±0.0459植入组 5 0.4290±0.0457 0.4756±0.0414 t 0.338 0.986 P 0.064 0.974组别 只数 胸腺脏器系数术后第14 天 术后第21 天对照组 5 0.3234±0.0579 0.2599±0.0283植入组 5 0.3297±0.0274 0.2647±0.0593 t 0.754 0.690 P 0.252 0.437
2.2 脾脏和胸腺淋巴细胞亚群
术后第14 天,植入组的脾脏CD8+T 淋巴细胞占总淋巴细胞的比例高于对照组,差异有统计学意义(P<0.05);术后第14 天,两组脾脏CD3+、CD4+、CD19+和CD49b+淋巴细胞占总淋巴细胞的比例及胸腺各淋巴细胞亚群占比比较,差异均无统计学意义(P> 0.05);术后第21 天,两组脾脏各淋巴细胞亚群占比及胸腺各淋巴细胞亚群占比比较,差异均无统计学意义(P>0.05);见图1~4。
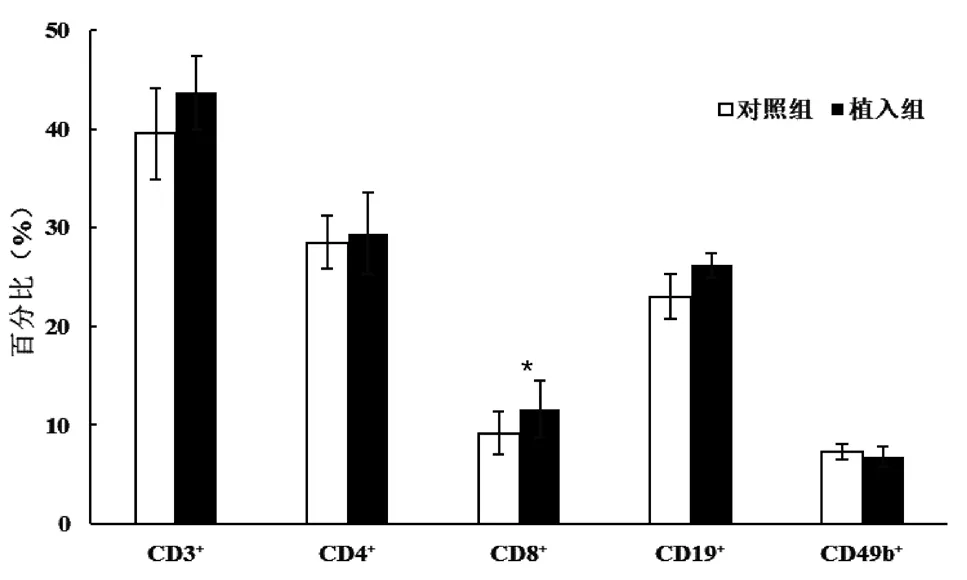
图1 术后第14 天小鼠脾脏淋巴细胞亚群占比
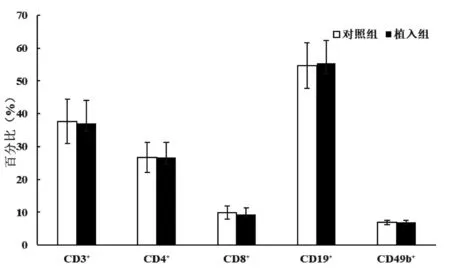
图2 术后第21 天小鼠脾脏淋巴细胞亚群占比
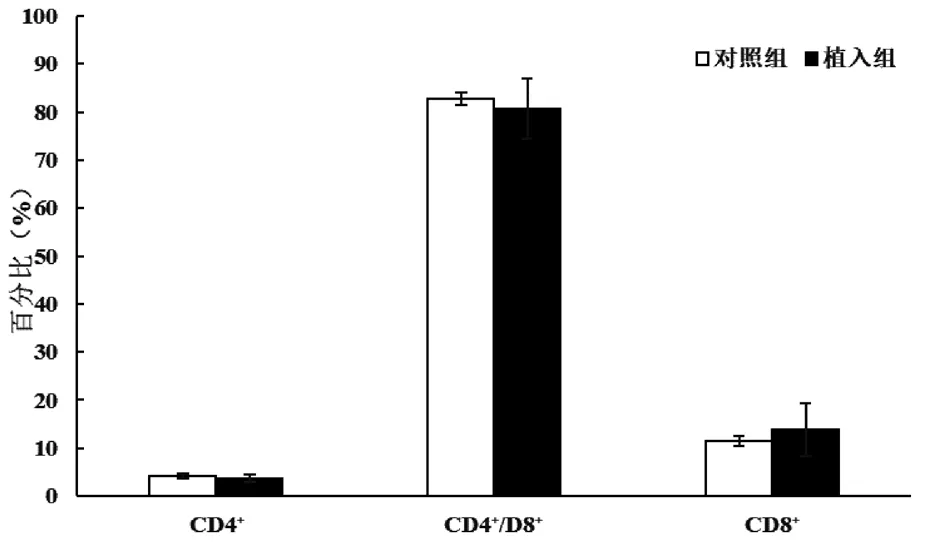
图3 术后第14 天小鼠胸腺淋巴细胞亚群占比
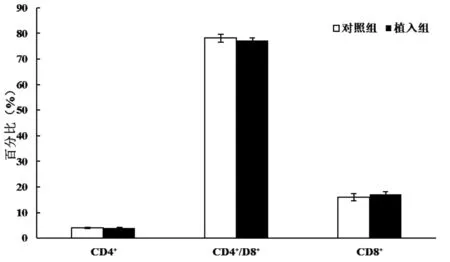
图4 术后第21 天小鼠胸腺淋巴细胞亚群占比
2.3 血清IgM 和IgG
术后第14、21 天,两组IgM 和IgG 水平比较,差异均无统计学意义(P> 0.05),见表2。
表2 两组血清IgM 和IgG 水平比较(±s)

表2 两组血清IgM 和IgG 水平比较(±s)
组别 只数 IgM(μg/ml)IgG(mg/ml)术后第14 天 术后第21 天 术后第14 天 术后第21 天对照组 5 56.0±7.0 53.8±4.6 13.3±1.6 16.8±6.2植入组 5 61.4±16.3 58.2±6.8 16.6±3.1 16.3±4.7 t 0.693 0.958 2.175 0.139 P 0.524 0.392 0.118 0.897
2.4 血清Th1/Th2/Th17 细胞因子
术后第14 天,植入组血清干扰素(interferon,IFN)-γ 和白细胞介素(interleukin,IL)-17A 水平高于对照组,差异有统计学意义(P<0.05),两组其他细胞因子水平比较,差异无统计学意义(P>0.05);术后第21 天,两组血清Th1/Th2/Th17 细胞因子水平比较,差异均无统计学意义(P>0.05);见图5和图6。
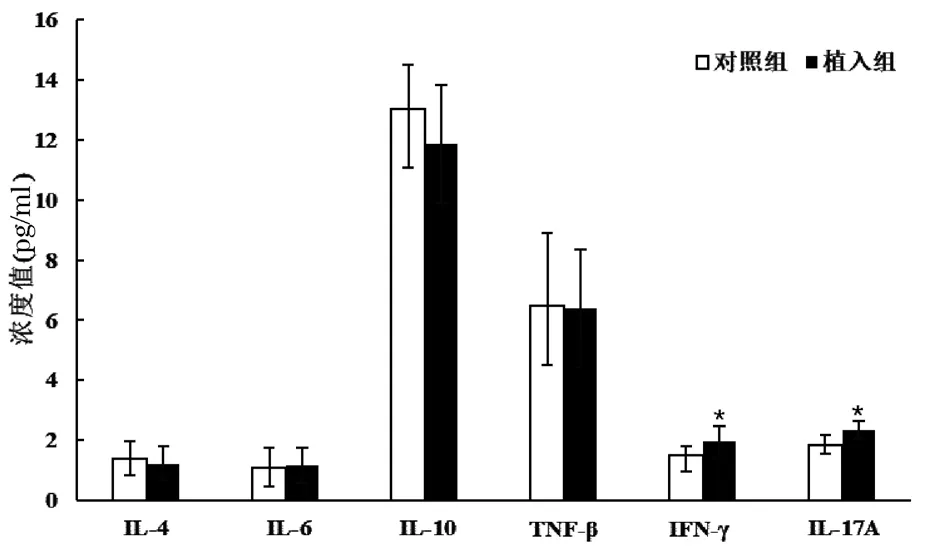
图5 术后第14 天小鼠血清Th1/Th2/Th17 细胞因子水平
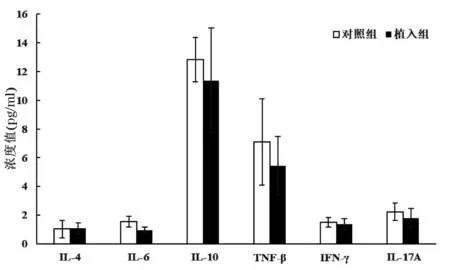
图6 术后第21 天小鼠血清Th1/Th2/Th17 细胞因子水平
3 讨论
镍及其化合物对机体免疫系统的毒性效应表现为对免疫应答的抑制作用,包括抑制胸腺生长(导致胸腺质量和大小下降、胸腺网状细胞变性坏死、淋巴细胞轻度减少、胸腺髓质疏松排列)[3],抑制脾脏质量和大小,减少红白髓内淋巴细胞数量[4],并显著降低外周血和免疫器官(胸腺、脾脏、回肠)中CD3+、CD3+/CD4+和CD3+/CD8+T 淋巴细胞的占比,以及抑制IL-2、IL-6、IL-10、IL-17、肿瘤坏死因子(tumor necrosis factor,TNF)-α 和IFN-γ mRNA 的表达[5]。在部分镍钛合金植入器械的临床使用中,发现其对人体免疫功能存在一定的影响。一项针对植入镍钛合金封堵器的先天性心脏病患者的研究发现,患者体内存在镍离子析出现象,且析出浓度与封堵器的直径呈正相关,析出的镍离子影响了患者T 淋巴细胞亚群的表达,主要表现为CD3+、CD3+/CD4+T 淋巴细胞占比的下降[6]。另一项针对使用镍铬合金烤瓷冠患者的研究发现,尿镍高水平组的血清IL-1β 水平显著低于尿镍低水平组[7]。虽然临床上有使用镍钛合金植入器械影响人体免疫功能的报道,但目前在镍钛合金植入器械临床应用前的生物相容性评价中关于免疫毒性的研究较少。
本实验室的前期研究发现,相当水平的镍钛合金植入未引起实验动物的全身毒性反应[8]。本研究进一步探讨了镍钛合金材料对免疫系统的潜在影响,结果发现,镍钛合金材料植入术后第14 天,小鼠脾脏CD8+T 淋巴细胞占比升高,血清IFN-γ 和IL-17A 水平升高,且均于术后第21 天恢复正常,小鼠的主要免疫器官脾脏和胸腺的脏器系数及其余各淋巴细胞占比未见明显变化,因此推测镍离子析出对机体免疫功能的影响可能是暂时性的。
众所周知,剂量决定毒性。引起机体免疫反应的剂量具有特殊性,即一定剂量的免疫原才会诱发机体的免疫反应。一项针对镍钛合金的溶出特性研究发现,某镍钛合金材料(长1 cm,直径2 mm,质量0.2 g)以0.9%氯化钠注射液为浸提介质,按0.2 g/ml 浸提比例于37 ℃浸提72 h 后,其浸提液中镍离子含量约0.002 mg/ml,是该研究使用的国内外各品牌镍钛合金材料中镍溶出量最多的[9]。为进一步探讨镍离子剂量对免疫系统的影响,根据本实验室前期研究得到的镍离子无明显损害作用剂量(no observed adverse effect level,NOAEL)0.25 mg/(kg·d)[6],选择3 个剂量的氯化镍溶液与弗氏完全佐剂等比例混合后注射至小鼠皮下(镍离子暴露剂量分别为0.25、0.025、0.0025 mg/kg),第1、7、14 天免疫小鼠。末次免疫后24 h 检测发现,0.25 mg/kg 和0.025 mg/kg 剂量组小鼠的NK 细胞(CD49)占比均低于佐剂对照组(分别降低45.3%和44.9%),0.0025 mg/kg 剂量组与佐剂对照组无显著差异;末次免疫后1 周 检测发现,0.25 mg/kg 和0.025 mg/kg 剂量组小鼠NK 细胞占比低于佐剂对照组(分别降低17.1%和20.8%),0.0025 mg/kg 剂量组与佐剂对照组无显著差异;此外,NK 功能实验发现,末次免疫后24 h 0.025 mg/kg 剂量组小鼠脾NK细胞对K562细胞的抑制率(17.2%)低于佐剂对照组(22.4%)。以上结果说明,1/10 NOAEL镍离子已经对小鼠的固有免疫功能产生了影响,抑制了NK 细胞的表达。1/10 NOAEL按0.2 ml/只计算,其镍离子暴露浓度约为0.0025 mg/ml,与本研究使用的镍钛合金材料的体外镍溶出量相当。但本研究却未发现镍钛合金材料对NK 细胞占比的明显影响,原因可能与机体的免疫状态有关(植入实验模型中未使用佐剂)。
尽管本研究未观察到不可逆的免疫系统变化,但是存在阶段性的有关炎症反应的IFN-γ、IL-17A 水平升高,相当剂量水平镍离子引起的NK 细胞占比及功能的下降,这些变化是否会引起机体的免疫损伤值得进一步研究。事实上,在许多镍钛合金植入器械临床使用失败的报道中,有镍过敏史的患者的失败率显著高于普通患者[10-11]。因此,在镍钛合金植入器械使用过程中,需始终关注其对免疫系统的潜在风险,并值得在镍致敏的动物模型上进行更深入的研究和探讨。
