鱼菜共生系统中麦穗鱼肠道菌群研究
2023-07-12张冀野王世兴刘东姣杜新科牟晋华申旭红
张冀野,王世兴,刘东姣,杜新科,牟晋华,申旭红
(中国农业大学烟台研究院,山东 烟台 264670)
我国是水产养殖大国,养殖面积和产量居世界首位[1]。随着水产养殖业的迅速发展,养殖水污染问题也日益凸显[2]。鱼菜共生模式是将传统水产养殖与水培蔬菜有机结合的生态友好型养殖模式[3],构建鱼-微生物群-植物的协同体系,将鱼类残饵和排泄物等含氮成分转化为毒性较小的硝酸盐,供植物生长[4]。该模式通过植物生长实现氮的转化和利用,有效控制可溶性含氮物浓度,达到水质净化和农业增产的双重目的[5]。
鱼类肠道菌群在维持鱼体健康中发挥重要作用,具有促进鱼类新陈代谢、增强免疫、调节神经内分泌以及激发肠上皮细胞的增殖等功能[6-8]。广义上,鱼类肠道菌群分属两大类:原籍菌群和外籍菌群[7]。原籍菌群能促进肠道吸收营养物质,抑制病原体的入侵和增殖,其中的益生菌对改善肠道菌群平衡有积极作用[8-10]。外籍菌群在正常情况下能保持肠道菌群动态平衡,但当养殖环境恶化时,极有可能恶性增殖,导致疾病发生[6]。鱼类肠道菌群的组成、结构和功能易受各种环境因素的影响[9]。近年来,鱼菜共生系统菌群多样性研究受到广泛关注,主要集中于植物根际和水环境微生物菌群[10,11]。Goddek 等[12]研究表明,鱼菜共生系统根际微生物菌群能有效促进植物生长;Sanchez 等[13]发现,鱼菜共生养殖水体中存在丰富的益生菌。有关鱼菜共生系统鱼体肠道菌群的研究尚少,主要为室外天然养殖水体鱼体肠道菌群研究[14,15]。本研究在环境可控的实验室条件下探究鱼菜共生模式对鱼体肠道菌群产生的影响,避免开放环境干扰,能够获得更接近实际的结果。
麦穗鱼(Pseudorasbora parva)个体较小,肉质细嫩,富含氨基酸,对水质敏感,是一种具有水质监测功能的潜在经济鱼类[16,17]。目前尚无针对麦穗鱼肠道菌群的研究。罗莎生菜(Lactuca sativa)和水蕹菜(Ipomoea aquatica)为大众餐桌常见的蔬菜,具有生长快,稳定性强的特点[18]。本研究选择麦穗鱼、罗莎生菜和水蕹菜,建立麦穗鱼-罗莎生菜和麦穗鱼-水蕹菜两种鱼菜共生系统,以单独养殖麦穗鱼的系统作为对照,研究不同系统中麦穗鱼肠道菌群的结构特点,为鱼菜共生系统鱼类肠道菌群研究及水产养殖业可持续发展提供理论参考。
1 材料与方法
1.1 材料
试验所用麦穗鱼捕捞于烟台市牟平区野外池塘,选取生长状况良好、规格相似的麦穗鱼108 尾,平均初始体长为(7.30±0.56)cm,平均初始体质量为(3.88±0.78)g,消毒,进行驯养与蔬菜暂养,后进行试验。罗莎生菜平均株高(13.85±0.92)cm;水蕹菜平均株高(26.10±1.84)cm,均购自山东寿禾种业。试验饵料按蓝鲫饲料与拉丝蛋白粉以1∶0.2 比例配置,粒径约1.0 mm。
养殖试验从2020 年11 月24 日起,至2021 年1 月4 日结束,持续6 周。养殖期间,麦穗鱼于每日早、中、晚定时投喂,及时补水以保持水体体积恒定,时刻保持水质良好,水质符合渔业水质标准。
1.2 方法
试验于中国农业大学烟台研究院实验室内完成。试验分为3 组:麦穗鱼-罗莎生菜(PL 组)、麦穗鱼-水蕹菜(PI 组);单养麦穗鱼的对照组(PT组)。每组设3 个重复。试验用9 个泡沫养殖箱,规格见图1,每个箱内养殖麦穗鱼12 尾。每个鱼菜共生养殖箱的箱体边缘都固定等面积蔬菜浮床(覆盖面积占水体面积的35%),浮床底部覆盖纱布以避免鱼类啃食。试验设计如图1。

图1 试验设计详图Fig.1 The schematic diagram of experimental tanks
1.3 肠道样品采集
试验结束时,从每个平行组随机取一尾健康麦穗鱼,用MS222 麻醉后,测量体质量和体长,用70%乙醇和无菌水冲洗鱼体,在无菌环境下完整取出每尾鱼的整个肠道(食道后端至肛门)。将每个处理组的3 个鱼体肠道混合为1 个样本,保存于-80℃冰箱中,直至进行微生物组分析。
1.4 DNA 的提取和高通量测序
利用E.Z.N.A.Soil DNA 试剂盒(Omega,美国)提取总群落基因组DNA。为确保提取出足够数量的高质量基因组DNA,使用Qubit 3.0(life,美国)测量DNA 浓度。
PCR 扩增16S rRNA 基因的V3-V4 区。采用KAPA HiFi Hot Start Ready Mix(TaKaRa Bio,日本)进行扩增,引物:正向(CCTACGGGNGGCWGCAG)和反向(GACTACHVGGGTATCTAATCC)。扩增程序为:95℃预变性3 min,随后进行25 次扩增循环(95℃变性30 s,55℃退火30 s,72℃延伸30 s),最后一轮循环结束后保持72℃延伸5 min(PCR 仪:ABI GeneAmp9700 型)。使用2%琼脂糖凝胶电泳检测扩增产物,利用AMPure XP beads 纯化扩增产物。使用Qubit 3.0 测定文库DNA 浓度,用生物分析仪(Agilent 2100,美国)对其进行质量控制。构建测序文库并在Illumina MiSeq 平台进行高通量测序(上海生工生物工程股份有限公司)。
1.5 生物信息学和统计分析
高通量测序对3 份肠道样品的原始数据进行质控处理,并对每个样品的reads 随机采样至相同的测序深度以达到抽平效果。将所有不包含引物的有效细菌序列移交至下游分析。试验筛选核苷酸相似度为97%的OTUs,并将其归一化以控制噪音。
用Mothur 1.43.0 分析物种丰度、Alpha 多样性指数。物种稀释曲线由PAST 制成。使用R 软件的hclust 函数构建聚类树。通过PICRUSt2 预测不同养殖系统中麦穗鱼的代谢活动,根据京都基因和基因组百科全书(KEGG)进行功能推断。采用Origin 绘制丰度堆积图和热图,并对数据进行单因素方差分析,描述性统计值以平均值±标准差(Mean±SD)表示,差异显著性水平为P<0.05,若存在显著性差异,再进行Duncan’s 多重比较以检验组间的差异显著性。
2 结果与分析
2.1 鱼类生长指标
经过6 周的养殖试验,3 种养殖系统中麦穗鱼体质量和体长均增加,但是,各组间末体质量和末体长差异不显著(P>0.05)(表1)。其中,PL 组和PI组的存活率均显著高于PT 组(对照组)(P<0.05)。
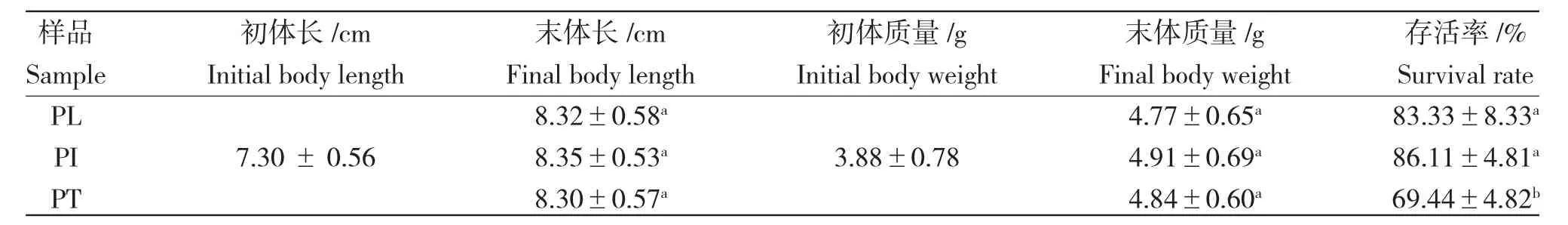
表1 不同养殖系统中麦穗鱼的生长情况和存活率Tab.1 Growth performance and survival rate of top mouth gudgeon P.parva in different farming systems
2.2 肠道菌群多样性
对样品进行测序共获得有效序列266 758 条,平均序列数88 919 条,PL 组、PI 组和PT 组序列数分别为92 529、95 925 和79 204 条。按照97%相似性对非重复序列(不含单序列)进行OTU 聚类,在聚类过程中去除嵌合体,共得到6 938 个OTU 的代表序列。稀释曲线如图2 显示,伴随测序深度的增加,各样本的OTU 数趋于平缓,说明测序质量可靠,测序结果能够反映不同养殖系统内麦穗鱼肠道菌群的组成。利用不同养殖系统中OTU 检出数目进行Alpha 多样性分析(表2)。其中,Coverage 指数反映测序结果的覆盖率,所有样本中的Coverage 指数均≥99.99%,表明样本中微生物被充分检出,测序质量较好。PI 组中Shannon 指数最高,其次是PT组,PL 组最低;PI 组同样具有最高的Simpson 指数,其次是PL 组,PT 组最低。Chao1 和Ace 指数反映物种丰富度,PI 组的Chao1 和Ace 指数最高,其次为PL 组,最后为PT 组。
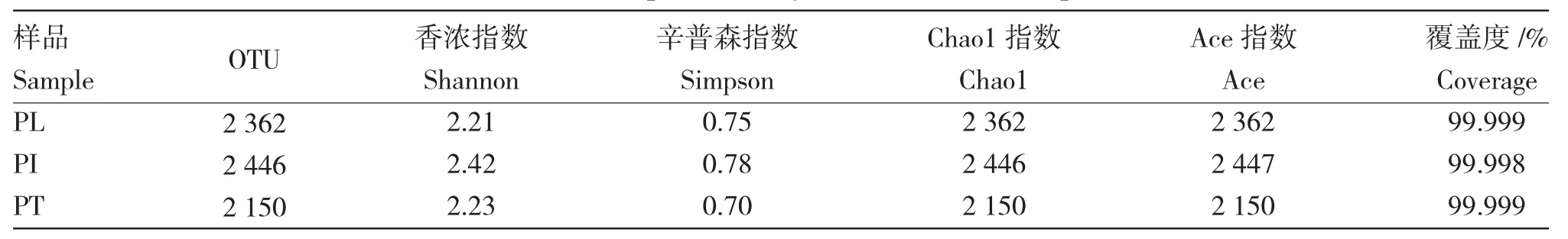
表2 样本多样性指数Tab.2 The Alpha diversity indices of three samples

图2 稀释曲线Fig.2 Rarefaction curve
通过加权Unifrac 距离构建UPGMA 聚类分析树(图3)。PI 组和PL 组的肠道微生物样本先聚为一支,两者与PT 组麦穗鱼肠道微生物样本的距离相对较远。

图3 层次聚类树Fig.3 Hierarchical clustering tree
2.3 肠道菌群结构
3 种养殖系统中共测出11 个门,其中不能被分类到任何已知类群的序列被认定为“未分类细菌”(unclassified Bacteria),对比分析了排名前5 位菌门的相对丰度。3 种养殖系统中麦穗鱼肠道菌群主要由变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteriota)和浮霉菌门(Planctomycetes)组成,但各菌门的比例不同(图4)。在PL 组中,以变形菌门(61.40%)、拟杆菌门(35.04%)和浮霉菌门(1.54%)为主,占总丰度的97.98%。在PI 组中,以变形菌门(65.05%)、拟杆菌门(26.00%)、厚壁菌门(4.09%)和放线菌门(3.28%)为主,占总丰度的98.42%。PT 组以变形菌门(81.52%)、拟杆菌门(15.33%)和厚壁菌门(1.15%)为主,占总丰度的98.00%。变形菌门在各组中占绝对优势,PT 组中变形菌门明显高于PL组和PI 组。PL 组和PI 组拟杆菌门占比明显高于PT 组,PI 组中厚壁菌门和放线菌门占比高于PL 组和PT 组。
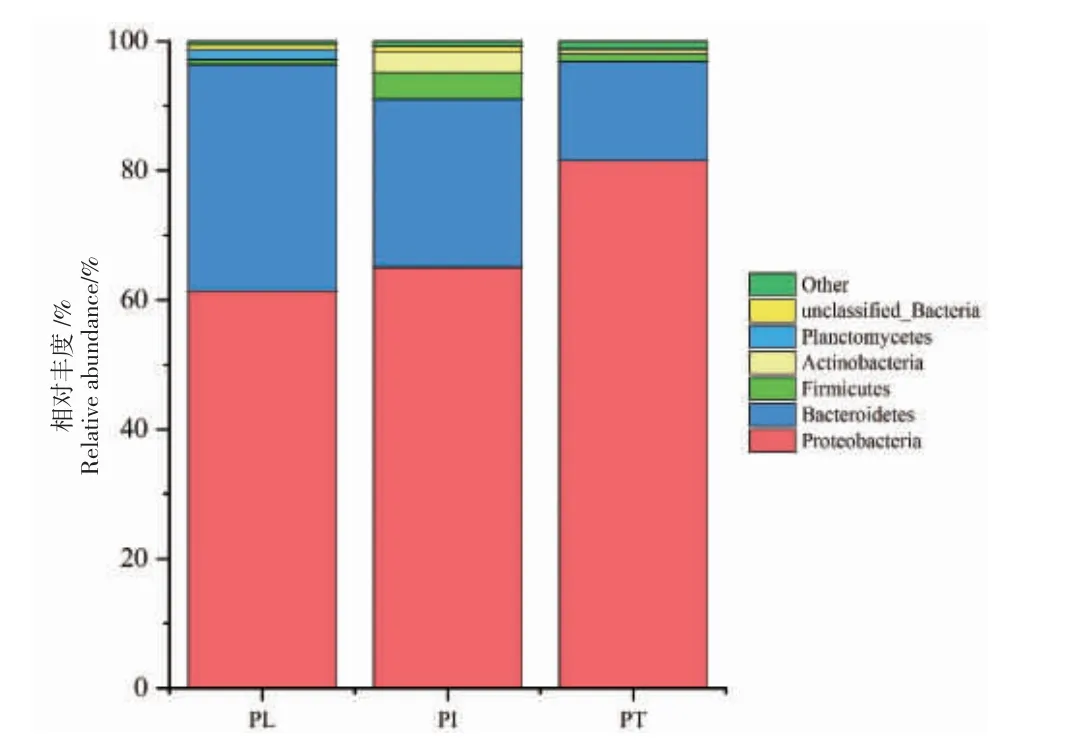
图4 门水平相对丰度堆积图Fig.4 The relative bacterial abundance at the phylum level
在属水平细菌相对丰度堆积图中(图5),3 个样本共鉴定出97 个属,丰度排名前20 的属占各组丰度的90%以上。在3 种养殖系统中,苯基杆菌属(Phenylobacterium)、沉积物杆状菌属(Sediminibacterium)和慢生根瘤菌属(Bradyrhizobium)依次为丰度前3 的优势菌属。PL 组的优势菌属依次为苯基杆菌属(42.82%)、沉积物杆状菌属(31.19%)、慢生根瘤菌属(4.33%)、嗜糖假单胞菌属(Pelomonas)(4.16%)和井杆菌属(Phreatobacter)(2.70%),占总丰度的85.20%;PI 组的优势菌属为苯基杆菌属(40.37%)、沉积物杆状菌属(22.45%)、慢生根瘤菌属(11.77%)、井杆菌属(4.59%)、Pontibacter(2.74%)和鞘氨醇单胞菌属(Sphingomonas)(2.25%),占总丰度的84.17%;PT 组的优势菌属为苯基杆菌属(54.23%)、沉积物杆状菌属(13.78%)、慢生根瘤菌属(9.91%)、Bosea(4.79%)和嗜糖假单胞菌属(2.69%),占总丰度的85.42%。两鱼菜组(PL 组和PI组)的苯基杆菌属丰度明显低于PT 组,而沉积物杆状菌属和井杆菌属丰度明显高于PT 组。PI 组的慢生根瘤菌属丰度高于PT 组和PL 组。仅在PT 组中检测到乳酸杆菌属(Lactobacillus)(1.10%)。

图5 属水平相对丰度堆积图Fig.5 The relative bacterial abundance at the genus level
2.4 肠道菌群功能
利用PICRUSt2 预测各养殖模式下麦穗鱼肠道细菌群落的功能组成,并通过KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对测序数据进行比对,除去与鱼体无关的功能通路,共得到29 种二级功能通路(图6)。在二级通路中,有12 种参与代谢(Metabolism),4 种参与遗传信息处理(Genetic Information Processing),3 种参与环境信息处理(Environmental Information Processing),3 种参与细胞过程途径(Cellular Processes),7 种参与机体系统(Organismal Systems)一级功能通路。

图6 PICRUSt2 预测麦穗鱼功能聚类热图Fig.6 Heat map of predicting function of topmouth gudgeon P.parva through PICRUSt2
KO(KEGG Orthology)丰度热图显示,两鱼菜组(PL 组和PI 组)首先聚集成一支,后与PT 组汇集。在遗传信息处理方面包含复制、修复(Replication and Repair)等四种二级功能通路,PL 组表达量最高,且与PI 组功能表达量更接近,均高于PT 组。PL组和PI 组的氨基酸代谢(Amino Acid Metabolism)、碳水化合物代谢(Carbohydrate Metabolism)、能量代谢(Energy Metabolism)等主要二级代谢功能通路的相似度和丰度高于PT 组。PI 组环境信息处理方面的表达量明显高于PL 组与PT 组。
功能预测结果的准确性可通过NSTI 值评估。利用PICRUSt 对人肠道微生物样品的预测结果较好,为0.03±0.02,其他哺乳动物肠道微生物预测结果为0.14±0.06,土壤样本为0.17±0.02[19]。本研究中,PL组、PI组、PT组的NSTI 值分别为0.097、0.090 和0.076,预测准确度较高,证明结果可靠。
3 讨论
肠道菌群在鱼体生长发育中具有重要作用[20]。本研究发现,两种鱼菜共生系统肠道菌群Alpha 多样性整体高于传统养殖系统,其中PI 组微生物群落各项指数均为最高(表2)。该结果与Ke 等[15]对尼罗罗非鱼(Oreochromis niloticus)的室外池养结果一致。聚类树与功能热图中PL 组和PI 组聚集更加紧凑,表明不同鱼菜共生系统对麦穗鱼肠道菌群的结构有趋同性影响。
本研究发现,变形菌门是麦穗鱼肠道菌群的优势门,与先前鲤科鱼肠道研究结果一致[21]。麦穗鱼肠道菌群的优势门还有拟杆菌门、厚壁菌门、放线菌门和浮霉菌门,这些菌门均也广泛存在于淡水鱼肠道中[18,22]。其中,拟杆菌门和厚壁菌门可通过产生多糖水解酶来降解膳食纤维,产生单糖和短链脂肪酸作为鱼类能量来源[23];浮霉菌门可参与复杂化合物代谢,在鱼体肠道中亦被发现具有多糖降解能力[24]。3 种养殖系统中麦穗鱼肠道菌群在某些优势门的丰度上存在差异,与PT 组相比,PL 组和PI 组中变形菌门丰度较低。Shin 等[25]将变形菌门丰度的升高作为疾病发生的潜在判断标志,故鱼菜共生模式可能对维持麦穗鱼健康起到积极影响。麦穗鱼存活率结果(表1)进一步显示,PL 组和PI 组的存活率均显著高于PT 组(P<0.05)。
属水平肠道菌群的组成分析表明,3 种养殖系统中丰度前三的优势菌属依次为苯基杆菌属、沉积物杆状菌属、慢生根瘤菌属,但丰度差异较大。PL 组和PI 组中苯基杆菌属丰度均低于PT 组。目前苯基杆菌属对鱼体影响未知,有待进一步研究。PL 组和PI 组的沉积物杆状菌属丰度明显高于PT 组。鱼类肠道菌群与养殖水环境中微生物菌群具有很强的相关性[26]。Van 等[27]研究发现,开口前虹鳟(Oncorhynchus mykiss)肠道中的第一优势菌属沉积物杆状菌属来源于其养殖水环境。本研究推测PL 组和PI 组水环境中也含有较高丰度的沉积物杆状菌属。沉积物杆状菌属具有硝化功能,可降低有机物污染,间接促进鱼体健康[27]。PL 组和PI 组麦穗鱼的存活率更高(表1),一定程度上印证了该推测。慢生根瘤菌属丰度PI 组>PT 组>PL 组,未体现出鱼菜共生模式与传统养殖模式的类别差异。该结果说明,鱼菜共生模式中,不同种类的蔬菜对鱼体肠道菌群的影响也不同。根瘤菌可以产生多种具有纤维素分解和果胶分解活性的酶,增强鱼类消化植物细胞壁的能力,从而提高饲料利用率[28]。本试验中,PI组慢生根瘤菌属促进麦穗鱼消化多糖的效力最高,PT 组次之,PL 组最低。
PT 组麦穗鱼肠道乳酸杆菌属的丰度明显高于PL 组和PI 组,这说明鱼菜共生模式可能对乳酸杆菌属在麦穗鱼肠道中定植产生负面影响。乳酸杆菌属被普遍认为是肠道益生菌,属内部分菌种已经被加工成口服微生物制剂以抑制病原体繁殖[29]。3 种养殖系统中麦穗鱼体质量与体长增加量未呈现显著差异(表1),可能与该因素有关。基于此,本研究建议在麦穗鱼鱼菜共生系统合理添加乳酸杆菌以增强鱼体健康。其他鱼种的鱼菜共生系统也建议将乳酸杆菌作为重点考虑使用的添加剂。
肠道菌群既能促进机体营养物质消化,又能与机体的代谢相互作用,影响宿主的正常生理功能[8]。PICRUSt2 揭示鱼菜共生模式中菌群对鱼体功能的影响(图6)。相较于PT 组,PI 组和PL 组的大部分代谢功能(包括氨基酸代谢、碳水化合物代谢、脂代谢等)、机体系统和遗传信息处理表达增强,有利于鱼体营养物质的利用及细胞功能的发挥,促进鱼类的生存和生长。故本研究构建的两种鱼菜共生系统对麦穗鱼肠道菌群结构均起正向效应。
PI 组在环境信息加工能力方面明显优于PL 组和PT 组(图6),说明PI 组麦穗鱼具有更强的抗逆性,能更好地维持肠道菌群的稳定性。虽然两种鱼菜共生系统对肠道菌群具有趋同影响,但PI 组麦穗鱼在肠道菌群多样性、肠道有益菌丰度和环境信息加工方面均优于PL 组。对该麦穗鱼鱼菜共生系统水质的研究发现,水蕹菜组的水质净化效果也要优于罗莎生菜组[30]。故本研究认为,麦穗鱼-水蕹菜系统功能整体优于麦穗鱼-罗莎生菜系统,其在长期养殖中可能会体现出更明显优势。
结论
本研究认为,麦穗鱼鱼菜共生系统能有效降低鱼体肠道变形菌门的丰度,提高沉积物杆状菌属的丰度。该系统显著提高麦穗鱼存活率,对其肠道健康有正向促进作用。相较于麦穗鱼-罗莎生菜系统,麦穗鱼-水蕹菜系统表现出更大的发展潜力。针对鱼菜共生系统麦穗鱼肠道乳酸杆菌相对不足的问题,建议向饲料中添加乳酸杆菌制剂,以提高系统生产力。未来鱼菜共生研究应充分利用宏基因组等新型测序技术探明肠道菌群与宿主鱼的互作关系,以设计出更加合理高效的鱼菜共生养殖模式。
