太子参及其复方中草药对大黄鱼几种抗氧化酶基因表达的影响
2023-07-12史晓丽郑德耀倪建成黄伟卿钟李强叶祖云阮少江
史晓丽,郑德耀,倪建成,黄伟卿,,钟李强,叶祖云,阮少江
(1.宁德师范学院生命科学学院福建省特色药用植物工程技术研究中心,福建 宁德 352100;2.宁德市鼎诚水产有限公司,福建 宁德3 521004)
大黄鱼(Larimichthys crocea)主要分布于在我国的黄海南部、东海、台湾海峡到南海雷州半岛以东,是我国最重要的海水养殖鱼类之一,2019 年产量达到22.6 万t,居于海水养殖鱼类之首[1]。但是,随着养殖规模的不断扩大,养殖密度增高、饵料质量风险和养殖环境变化等使得大黄鱼养殖病害频发,制约了产业的健康发展[1]。开发增强水产动物抗病能力的环保型饲料添加剂已成为水产养殖业的发展趋势[2]。
太子参(Pseudostellaria heterophylla)是一种传统的中药材,在临床上常被用做补虚药。太子参含有多糖、皂苷、氨基酸、微量元素等活性物质,具有抗疲劳、抗氧化、抗炎等多种药理活性[3-5]。在小鼠和猪的研究中证实,太子参可以增强机体的免疫力[6-8],但在水产动物中的研究很少。仅吴斌[9]报道了太子参多糖可增强福瑞鲤(FFRC strain common carps)的非特异性免疫功能,提高抗病力;姚勇[10]报道了太子参可以增强对虾的抗应激能力。目前仅见阮少江等[11]和黄伟卿等[12]报道了太子参提取液能显著提高大黄鱼的成活率和生长性能,改善肌肉营养,但是,太子参及其复方中草药对大黄鱼在分子水平及酶活水平的影响,仍未见报道。
本研究在大黄鱼饲料中添加不同浓度的太子参及其复方中草药,分析大黄鱼体内过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)以及谷胱甘肽还原酶(GR)的基因表达变化,为全面分析太子参对大黄鱼的影响奠定了理论基础。
1 材料与方法
1.1 材料
实验用大黄鱼来源于宁德市鼎诚水产有限公司自繁的健康大黄鱼幼鱼,平均体长为(25.28±0.91)cm,体质量为(36.14±7.18)g。实验所用太子参购买于福建宁德拓荣太子参种植专业合作社,所用党参、黄芪、甘草、枸杞、巴戟天、白术、当归、茯苓购自于福州承创堂药店有限公司。太子参提取液的制备参照阮少江等[11]的方法。实验分为不添加太子参提取液的对照组(C)和5 个实验组(E1~E5):E1 组饲料中太子参提取液的添加浓度为0.5%,E2~E5 组饲料中,太子参、党参、黄芪、甘草、枸杞、巴戟天等中草药提取液的添加浓度为1%,其中E2 组饲料中,太子参、党参、黄芪、甘草、枸杞、巴戟天的添加浓度分别为0.167%(总1%);E3 组饲料中,太子参的添加浓度为0.5%,其余中草药(同E2 组)的添加浓度分别为0.1%;E4 组饲料中,太子参、党参、黄芪、甘草、枸杞、巴戟天、白术、当归、茯苓的添加浓度分别为0.111%;E5 组饲料中,太子参的添加浓度为0.5%,其余中草药(同E4 组)的添加浓度分别为0.0625%。
养殖期间,每天投喂2 次,根据体质量变化在1%~2%之间,视摄食情况酌情调整。养殖水体水温在24℃~26℃之间,溶解氧量大于5.0 mg/L,氨氮小于0.2 mg/L,pH8.0 左右。养殖30 d 后,每组随机取3 尾健康个体,活体解剖,分离的肾脏和脾脏保存在液氮中备用。
1.2 总RNA 提取及cDNA 合成
使用Trizol 法提取大黄鱼脾脏和肾脏组织的总RNA,具体操作方法参照说明书(Invitrogen,美国)进行。RNA 提取完成后,采用紫外分光光度计检测RNA 的质量,琼脂糖凝胶电泳检测其完整性。按照PrimeScriptTMIV 1st strand cDNA Synthesis Mix(Takara)试剂盒说明书进行cDNA 第一链的合成,总反应体系为10 μL。10 μL 反应体系包含:5×Buffer 2 μL,Enzyme Mix Ⅰ0.5 μL,OligdT 0.5 μL,Random 6 mers 0.5 μL,RNA 1 μg,加水补至10 μL。
1.3 基因的组织表达分析
根据本实验室测序得到的大黄鱼转录组序列,使用NCBI 在线引物设计程序设计了引物,以βactin 作为内参基因,采用TB Green 预混合Ex TaqTM(Takara)试剂盒,用相对荧光定量PCR 检测GSH、CAT 和GR 基因在不同组织中的表达。反应体系如下:12.5 μL TB Green Ex TaqTM(TaKaRa),上下游引物各1 μL(2 μM),稀释后的cDNA 模板(1∶10 稀释)2 μL,加水补至25 μL。循环参数设置为:95℃预变性5 min;95℃15 s,60℃45 s,40 个循环。PCR 反应结束后分析熔解曲线。实验设置3 个平行,以平均值进行后续数据分析。根据2-△△Ct方法[13]计算每个基因的相对表达量,所得数据用SPSS19.0 进行单因素方差分析(One-Way ANOVA),比较均值的差异显著性(P<0.05)。
2 结果与分析
2.1 过氧化氢酶基因的组织表达分析
过氧化氢酶基因在大黄鱼肾脏和脾脏组织中的相对表达量见图1。肾脏组织中,除E2 组外,该基因在各实验组中均下调表达,尤其是E5 组,表达量仅为对照组的0.28 倍。E2 组中,该基因的表达量最高,为对照组的1.4 倍(P>0.05)。脾脏组织中,该基因在各实验组中均出现了不同程度的下调表达,尤其是E1 组,表达量仅为对照组的0.41 倍。
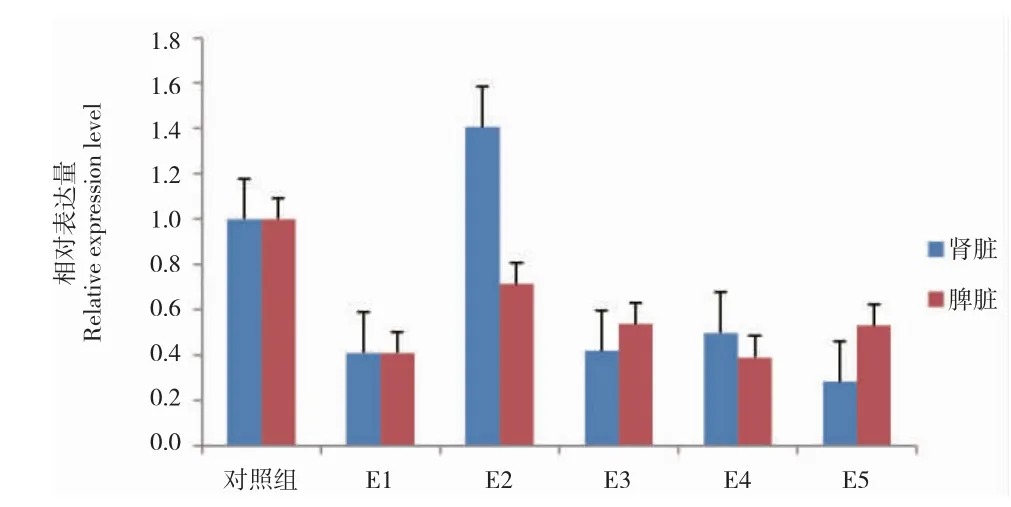
图1 饲料添加太子参对大黄鱼过氧化氢酶基因表达的影响Fig.1 The expression profiles of CAT mRNA in large yellow croaker L.crocea in each group
2.2 谷胱甘肽过氧化物酶基因的组织表达分析
谷胱甘肽过氧化物酶基因在大黄鱼肾脏和脾脏组织中的相对表达量见图2。在肾脏组织中,除E5 组外,该基因在各实验组中均下调表达,尤其是E3 组,表达量仅为对照组的0.57 倍(P>0.05)。E5组中,该基因的表达量最高,为对照组的1.15 倍。脾脏中,该基因在E3 和E5 组中上调表达,表达量分别为对照组的1.4 和1.13 倍,其余组中下调表达,尤其是E1 组下降的最多,表达量仅为对照组的0.65 倍(P>0.05)。

图2 饲料添加太子参对大黄鱼谷胱甘肽过氧化物酶基因表达的影响Fig.2 The expression profiles of GPx mRNA in large yellow croaker L.crocea in each group
2.3 谷胱甘肽还原酶基因的组织表达分析
谷胱甘肽还原酶基因在大黄鱼肾脏和脾脏组织中的相对表达量见图3。肾脏组织中,该基因在各实验组中均出现了不同程度的下调表达,尤其是E2组和E3 组的表达量仅为对照组的0.28 倍。脾脏组织中的表达情况和肾脏中类似,均下调表达,其中E2 组和E3 组中该基因的表达量分别为对照组的0.55 和0.50 倍(P>0.05)。
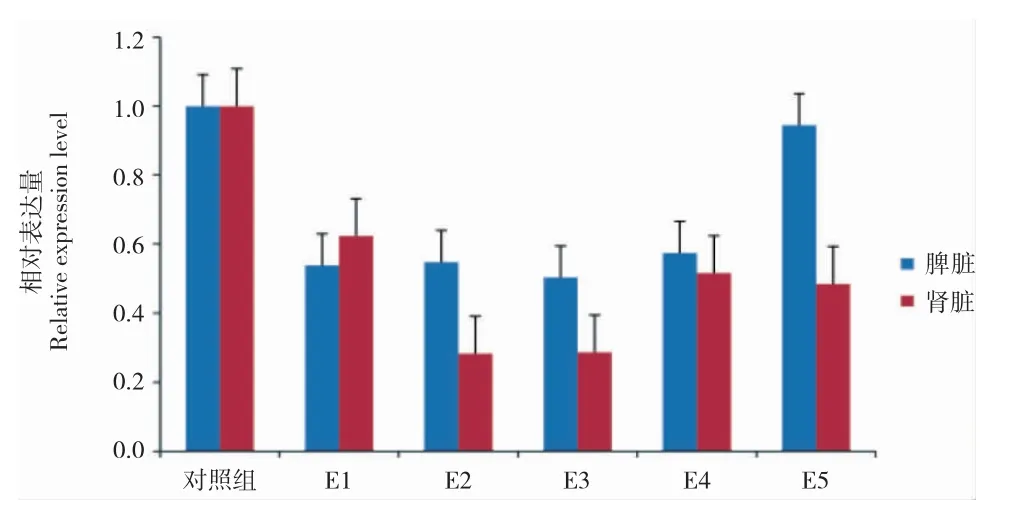
图3 饲料添加太子参对大黄鱼谷胱甘肽还原酶基因表达的影响Fig.3 The expression profiles of GR mRNA in Large yellow croaker L.crocea in each group

表1 引物序列及信息Tab.1 Primer sequences in qRT-PCR
3 讨论
本研究率先报道了饲料添加太子参等复方中草药对大黄鱼CAT、GPx 和GR 几种抗氧化酶基因表达的影响,为深入了解太子参对大黄鱼非特异性免疫的影响奠定了基础理论数据。
前期本课题组发现,大黄鱼饲料中添加不同浓度的太子参明显影响了大黄鱼的体质量,且随养殖时间的延长,体质量的绝对增加率均显著高于对照组(P<0.05)。攻毒实验也表明,实验组大黄鱼的死亡率明显下降(P<0.05),这说明太子参可以在一定程度上提高其免疫力[11]。本课题组还发现,实验组大黄鱼体内的细胞吞噬活性、血清SOD、CAT 等的酶活性也表现出了不同水平的上升(尚未发表)。但是,在本研究中,饲料中添加太子参等中草药后,饲喂30 d 时,肾脏和脾脏组织中的CAT、GSH、GR 的基因出现了下调表达,推测可能是因为中草药的药性较慢所致。
CAT、GPx 和GR 都是抗氧化相关的酶类。过氧化氢酶在机体的抗氧化防御中占有非常重要的地位。该酶和SOD 共同参与了机体内多余H2O2的清除过程。在亚东鲑(Salmo trutta fario)[14]、虹鳟(Oncorhynchus mykiss)[15]、吉富罗非鱼(GIFT,Oreochromis niloticus)[16]等鱼类饲料中添加大黄、黄芪、连翘、黄苓等复方中草药可以在一定程度上促进鱼类的抗氧化能力,但是随着添加量及养殖时间的差异,这种提高并不一定是100%。前期研究中发现,大黄鱼在食用添加太子参提取液的饲料之后,随着饲喂时间的延长(15~120 d),各实验组血液中CAT的酶活性表现出先下降再上升的趋势,30 d 和120 d 时,饲料添加0.5%太子参的实验组中,血液中CAT 的酶活性显著低于对照组(未发表数据)。本研究中,实验组1 的太子参添加剂量为0.5%,肾脏和脾脏组织中的CAT 的基因表达也下调,和本课题组之前的研究结果类似。谷胱甘肽还原酶也是一种重要的抗氧化酶,在生物体内的抗氧化系统中起关键作用。它可以催化氧化型谷胱甘肽(GSSG)还原为还原型谷胱甘肽(GSH),进而维持细胞中GSSG 和GSH 的动态平衡[17]。GR 主要分布在线粒体及胞浆中,而CAT 主要分布在过氧化物酶体内,所以GR比CAT 的分布更广泛,也是生物体内清除H2O2的最主要途径。
GPx 是一类广泛存在于需氧生物体内的重要抗氧化酶,它与SOD 和CAT 共同组成了生物体内重要的抗氧化还原系统,防止细胞膜和其他生物组织功能受到氧化应激的损伤[18]。鱼类中关于该酶的研究报道比较多,如斑马鱼(Danio rerio)、罗非鱼、草鱼(Ctenopharyngodon idellus)、虹鳟[19-23]等。这些研究多侧重于其基因结构和活性检测,且都集中在生态毒理学方面。斑马鱼在甲基汞胁迫下,GPx1a 和GPx1b 的mRNA 和酶活均下调表达[24];(Gobio gobio)在3,3,4,4,-四氯联苯的胁迫下,肝脏中的GPx1 的mRNA 下调表达,但其GPx 酶活并无显著变化[25]。研究发现,饥饿条件下大黄鱼GPx 的mRNA 表达和酶活均出现上升的趋势;而在锌离子胁迫下,GPxla 和GPxlb 的mRNA 均下调表达,酶活性则上调表达[17]。在病原菌侵染下,谢晓泽[18]发现大黄鱼脾脏中的GPx 基因在感染副溶血弧菌(Vibrio parahaemolyticus)后的96 h 内呈现出先下降后上升的趋势,而肾脏中的表达趋势并不显著,仅在感染后24 h 和72 h 出现了上调表达的趋势。溶藻弧菌(Vibrio alginolyticus)胁迫下,大黄鱼体内SOD 基因在肝脏中也呈现出上调表达趋势[26]。鱼类的肾脏和脾脏作为主要的免疫器官和造血部位,GPx、CAT、SOD 等抗氧化相关酶的上调表达有助于消除在血液循环过程中过量产生的H2O2,进而防止细胞损伤,尤其是环境条件不良或者外界病原刺激的条件下[26-28]。但是在饵料添加中草药后,这些抗氧化相关基因的表达是什么样子的,迄今为止并没有很多的研究。
中草药作为免疫添加剂应用在水产动物防治上,是新型渔药开发的一个重要方向。将大黄、党参等中草药投喂大黄鱼,大多数的非特异性免疫指标会随着饲喂时间的延长表现出一定的变化,如李梅芳等人发现,大黄鱼在投喂了中草药后的28 d 内,其血液中的超氧化物歧化酶、过氧化氢酶的酶活均随饲料投喂时间的延长而表现出先升后降的趋势,可以提高大黄鱼的非特异性免疫活性[29]。这和鲤(Cyprinus carpio)[30]、罗非鱼[31]、黄鳝(Monopterus albus)[32]等的研究结果类似。中草药的成分复杂,作用广泛,目前将中草药作为饲料添加剂的研究多数集中在使用效果上,不能解释药物的作用机理。虽然很多中草药的主要化学成分及其作用机理已研究清楚,但是多种中草药配伍后,化学药物成分更复杂,再加上不同的化学药物成分之间会发生各种化学和物理变化,即便是同种药物,炮制方法不同,化学成分、药性也会发生相应的变化[33]。在本研究中发现,各添加组在实验30 d 的时,肾脏和脾脏中的三种氧化酶的基因表达基本是下调表达,只有少数几个组中CAT 和GPx 出现了上调表达,推测可能是由于养殖时间不够长导致。鉴于本课题组只做了30 d 的对比,还需要进一步通过细菌感染实验去综合分析这些基因在转录及翻译水平的变化。
总之,本研究率先在大黄鱼的饲料中添加太子参、党参、黄芪、甘草、枸杞、巴戟天等中草药,从基因表达层面分析了几种抗氧化酶的变化,为深入了解中草药对大黄鱼的影响奠定了理论基础。虽然本实验发现几种氧化酶的基因表达受到了抑制,但是不可否认中草药添加作为一种更高效和安全的养殖手段,在改善机体免疫状态,提高机体自身的抗病能力上有很大的应用前景,符合“无抗化”养殖的趋势。
