信迪利单抗联合改良DCF 方案治疗晚期胃癌的临床研究
2023-07-11许沙沙
许沙沙
(山东省菏泽市巨野县人民医院 巨野 274900)
胃癌是发病率较高的消化系统恶性肿瘤,其发病率仅次于肺癌。由于我国居民生活节奏的加快、饮食结构的改变等因素,胃癌发病率呈逐年上涨趋势[1]。该病早期无特异性症状,未接受胃镜检查前较难确诊,待病情进展至中晚期,可出现上腹痛、消瘦、厌食等症状,对患者生命健康造成严重威胁。据相关数据显示,我国胃癌的病死率仅次于肺癌和肝癌[2~3]。临床对于晚期胃癌患者的治疗主要以化疗为主,改良DCF 方案(多西他赛+奥沙利铂+替吉奥)是目前临床较常用的化疗方案,相较于传统DCF 方案,疗效好且不良反应较少[4]。近年来有学者提出,化疗药物联合靶向药物可提高胃癌患者的治疗效果,延长生存期[5]。信迪利单抗是程序性死亡受体1(PD-1)抗体,可通过解除免疫抑制达到对肿瘤的抑制作用,在肺癌、结直肠癌等肿瘤的治疗中应用较多[6~7]。本研究探讨信迪利单抗联合改良DCF 方案对晚期胃癌患者血清肿瘤标志物水平的影响。现报道如下:
1 资料与方法
1.1 一般资料 选取2020年5月至2022年6月医院收治的晚期胃癌患者80 例为研究对象。男48例、女32 例;年龄42~77 岁,平均(53.92±5.34)岁;病程8 个月至4年,平均(1.71±0.37)年;肝转移57例,无肝转移23 例;分化程度:未分化癌26 例,低分化癌31 例,高分化癌23 例;病理分期:Ⅲb 期20例,Ⅲc 期29 例,Ⅳ期31 例。按随机双盲法将患者分为对照组和研究组,各40 例。两组基线资料比较,差异无统计学意义(P>0.05)。见表1。本研究经医院医学伦理委员会批准(批号:伦理字201900118 号)。
表1 两组基线资料对比(±s)

表1 两组基线资料对比(±s)
注:A 为未分化癌,B 为低分化癌,C 为高分化癌。
组别n性别(例)男女年龄(岁)病程(年)有无肝转移(例)有无分化程度(例)ABC病理分期(例)ⅢbⅢcⅣ对照组研究组t/χ2/Z P 404023250.2080.648171554.16±5.3053.70±5.190.3920.6961.67±0.391.73±0.370.7060.48229280.6100.805111214120.4300.6671516111210100.1540.87814151615
1.2 纳入与排除标准 (1)纳入标准:符合晚期胃癌诊断标准[8],并经病理学检查确诊;卡氏评分>60分;病理分期Ⅲb~Ⅳ期;预计生存期不低于3 个月;签署知情同意书。(2)排除标准:合并其他恶性肿瘤者;已发生全身广泛转移者;无法耐受至少3 个周期化疗者;治疗前接受过其他抗肿瘤方案治疗者;合并其他重要器官严重功能衰竭者;对本研究药物过敏者;合并精神疾病或认知障碍,依从性较差者。
1.3 治疗方法 对照组采用改良DCF 方案:第1天,多西他赛(国药准字H20093648)60 mg/m2静脉滴注1 h,注射用奥沙利铂(国药准字H20133094)130 mg/m2静脉滴注1~5 h;第1~14 天,早晚餐后口服替吉奥胶囊(国药准字H20100135)60 mg/m2。3 周为一个周期,共3 个周期。研究组在对照组基础上联合信迪利单抗治疗。于第1 天静脉滴注信迪利单抗注射液(国药准字S20180016),200 mg/次,3 周为一个周期,共3 个周期。
1.4 观察指标 (1)临床疗效:参考相关文献[9]制定标准。病灶完全消失且持续1 个月以上为完全缓解(CR);病灶体积缩小幅度超50%为部分缓解(PR);出现新病灶或原病灶体积缩小幅度低于25%为疾病进展(PD);未达上述标准为疾病稳定(SD)。比较两组客观有效率(ORR)、疾病控制率(DCR)。(2)血清肿瘤标志物水平:于入院时、治疗后采集两组肘静脉血5 ml,经离心(3000 r/min,5 min)获得血清,采用电化学发光免疫分析仪测定糖类抗原(CA)125、CA199、CA724、癌胚抗原(CEA)水平。(3)肿瘤细胞迁移能力:血清获得同上,采用全光谱流式细胞仪对肿瘤转移抑制因子CD9、CD63 和肿瘤促进因子CD168、CD151 水平进行测定。(4)免疫功能:血清获得同上,采用流式细胞仪测定T 淋巴细胞亚群(CD3+、CD4+、CD8+、CD4+/CD8+)水平。(5)不良反应发生情况:包括肝功能异常、恶心呕吐、骨髓抑制、甲状腺功能减退、蛋白尿、口腔黏膜炎等。
1.5 统计学方法 采用SPSS24.0 软件分析数据。肿瘤标志物、肿瘤促进/抑制因子、免疫功能指标等计量资料以(±s)表示,行t检验;ORR、DCR 及不良反应发生率等计数资料用%表示,行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效对比 研究组ORR、DCR 高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组临床疗效对比[例(%)]
2.2 两组血清肿瘤标志物水平对比 治疗后两组血清CA125、CA724、CA199、CEA 水平均较入院时降低,且研究组低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组血清肿瘤标志物水平对比(±s)

表3 两组血清肿瘤标志物水平对比(±s)
注:与本组入院时相比,*P<0.05。
CEA(ng/ml)入院时治疗后对照组研究组组别nCA125(U/ml)入院时治疗后CA724(U/ml)入院时治疗后CA199(mg/L)入院时治疗后4040 t P 67.91±9.6168.27±9.550.1680.86736.73±6.30*26.67±4.68*8.1070.00050.69±6.3351.08±6.170.2790.78132.15±4.96*23.95±4.42*7.8060.000452.56±30.25450.17±31.060.3490.728254.73±27.60*206.85±25.33*8.0840.00029.56±4.6229.14±4.580.4080.68416.65±2.99*11.38±2.65*8.3420.000
2.3 两组肿瘤细胞迁移能力对比 治疗后两组CD9、CD63 较入院时升高,CD151、CD168 较入院时降低,且治疗后研究组血清CD9、CD63 高于对照组,CD151、CD168 低于对照组(P<0.05)。见表4。
表4 两组肿瘤细胞迁移能力对比(±s)

表4 两组肿瘤细胞迁移能力对比(±s)
注:与本组入院时相比,*P<0.05。
CD168入院时治疗后对照组研究组组别nCD9入院时治疗后CD63入院时治疗后CD151入院时治疗后4040 t P 29.87±5.6330.04±5.580.1360.89375.59±7.40*83.24±7.66*4.5430.00036.91±5.2837.14±5.230.1960.84579.62±7.95*84.19±8.32*2.5120.01478.85±7.5479.62±7.480.4590.64841.02±5.22*37.90±5.06*2.7140.00880.26±6.3780.17±6.420.0630.95040.08±4.83*36.95±4.35*3.0460.003
2.4 两组免疫功能对比 入院时两组免疫功能对比无明显差异(P>0.05);治疗后研究组CD3+、CD4+、CD8+、CD4+/CD8+水平均高于对照组(P<0.05)。见表5。
表5 两组免疫功能对比(±s)

表5 两组免疫功能对比(±s)
注:与本组入院时相比,*P<0.05。
CD4+/CD8+入院时治疗后对照组研究组组别nCD3+(%)入院时治疗后CD4+(%)入院时治疗后CD8+(%)入院时治疗后4040 t P 63.05±7.5262.91±7.610.0830.93466.45±7.74*71.86±8.11*3.0520.00335.47±5.9235.60±5.870.0990.92237.96±5.91*43.04±6.15*3.7670.00028.66±4.1528.59±4.100.0760.94028.93±4.1731.02±4.41*2.1780.0321.24±0.251.25±0.270.1720.8641.31±0.18*1.39±0.12*2.3390.022
2.5 两组不良反应发生情况对比 研究组肝功能异常、恶心呕吐、骨髓抑制、甲状腺功能减退、蛋白尿、口腔黏膜炎发生率与对照组相当(P>0.05)。见表6。
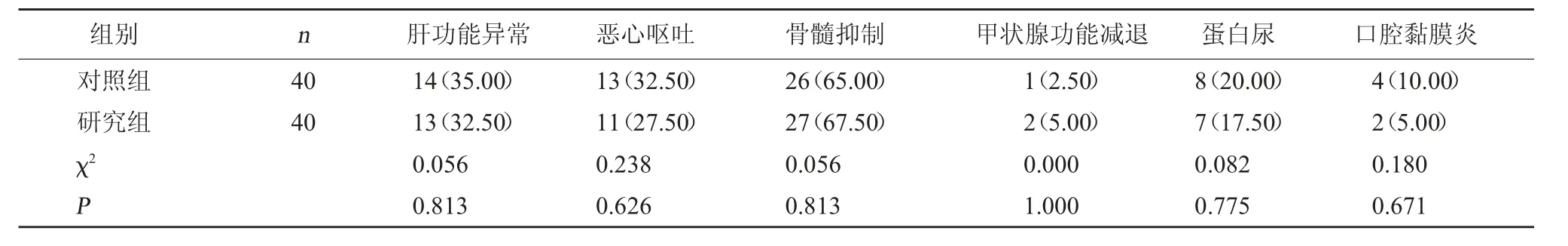
表6 两组不良反应发生情况对比[例(%)]
3 讨论
临床对于晚期胃癌患者的治疗主要以化疗为主,目前化疗方案尚无统一标准,一线化疗方案较多,但疗效存在一定差异。改良DCF 方案因不良反应较少、抗癌效果较强成为治疗晚期胃癌最常用的化疗方案。方案中奥沙利铂属第三代铂类化疗药物,对肾脏的毒性作用较轻微,周围神经炎较频发但后期可恢复;多西他赛属微管抑制剂,对胃癌的抑制作用较强;替吉奥是复方制剂,由替加氟、吉美嘧啶、奥替拉西钾组成,相比DCF 方案中的5-氟尿嘧啶,其血药浓度更高的同时,不良反应发生率较低[10~11]。
恶性肿瘤患者晚期多伴有免疫功能紊乱,且化疗易加剧该问题,导致患者免疫功能降低,不利于对肿瘤的抑制,影响化疗效果。因此,近年来有不少学者指出以免疫促进剂解除化疗患者的免疫抑制,进而提升化疗疗效[12]。信迪利单抗是PD-1 免疫抑制剂,由我国自主研发,对非小细胞肺癌、肝细胞癌的疗效较确切且应用较广泛,对于胃癌等肿瘤的治疗效果尚在开展中,暂无统一定论[13]。本研究结果显示,研究组ORR、DCR 分别是60.00%、87.50%,高于对照组的40.00%、70.00%,且治疗后研究组CD3+、CD4+、CD8+、CD4+/CD8+水平均高于对照组,与卫春燕等[14]的部分研究结果一致,提示信迪利单抗+改良DCF 方案治疗晚期胃癌的疗效较好,且有助于提高患者的免疫功能。究其原因在于,信迪利单抗可与PD-1 特异性结合,避免PD-1 与肿瘤中程序性死亡配体1、2 结合形成免疫抑制,进而激活T 淋巴细胞并提升其对肿瘤细胞的杀伤能力,逐步修复受损的肿瘤免疫监测系统,增强免疫应答能力[15]。
CA125、CA199、CA724、CEA 是胃癌诊断、预后评估的常见肿瘤标志物,其中CEA 是细胞膜结构蛋白,具有胚胎抗原特性,在结直肠癌、肺癌、胃癌等多种肿瘤疾病中均呈现不同程度的高表达;CA125 是所有上皮来源的肿瘤标志物,胃癌晚期发生腹膜种植转移的风险较高,故CA125 也呈现较高表达;CA724 因对胃部肿瘤的高敏感性又被称为胃癌抗原;CA199 主要来源于胰腺、胃、结肠等组织上皮,是消化道肿瘤的常见标志物,当出现胃部肿瘤时其表达明显升高[16~17]。CD9、CD63 同属肿瘤抑制分子,其中CD9 也叫运动蛋白1,可对细胞运动产生抑制;CD63 属跨膜蛋白超家族,参与多种肿瘤细胞侵袭、迁移过程;CD9、CD63 低表达可导致机体免疫监视能力降低,造成肿瘤细胞免疫逃逸。CD168、CD151 同属肿瘤促进分子,两者高表达提示肿瘤细胞的增殖、迁移能力较强。其中CD151 可黏附周围组织,参与肿瘤细胞浸润、转移过程;CD168 是一类细胞表面受体,该分子结合透明质酸受体后可激活酶联级联反应,有助于细胞迁移[18]。本研究结果显示,治疗后研究组血清CA125、CA724、CA199、CEA、CD168、CD151 水平均低于对照组,CD9、CD63 水平高于对照组,提示信迪利单抗+ 改良DCF 方案治疗晚期胃癌可有效降低肿瘤标志物表达,抑制肿瘤细胞的增殖、迁移,具体原因可能与信迪利单抗改善患者免疫功能有关。
综上所述,采用信迪利单抗+改良DCF 方案治疗晚期胃癌可有效提高DCR,降低肿瘤标志物表达,并有助于患者免疫功能的提高、肿瘤细胞迁移的抑制,且不会显著增加不良反应发生风险。
