猴樟根系适应碱胁迫的代谢组学分析1)
2023-07-10韩浩章张丽华李素华赵荣王芳
韩浩章 张丽华 李素华 赵荣 王芳
(宿迁学院,宿迁,223800)
猴樟(CinnamomunbodinieriLevl.)为樟科、樟属常绿乔木,多分布于云南、贵州、湖南西北部、四川东部、湖北等省分的山地、林区和城市道路,是我国重要的林用、绿化和经济树种[1]。我国关于猴樟的研究起步较晚,前人通过对猴樟生长特性的分析,明确了猴樟作为绿化树种进行应用的可能性[2-3],但我国许多地区苗圃建设和城市绿化过程中栽培土壤质量较差,因建筑垃圾回填等原因使得土壤pH在8.4~9.0之间,土壤密度大,有机质质量分数低,矿质营养元素缺乏,直接影响猴樟的生长发育。苗木栽植后普遍表现为生长缓慢、叶片黄化、抗性降低等,生产栽培过程中采用的人工换土、药液灌根、树干挂水、叶面喷肥等措施的效果也并不理想[4],因此限制了猴樟的推广应用。
当植物暴露于非生物胁迫时,可以通过调节由信号、基因、功能蛋白、代谢物及表型组成的复杂系统来维持体内生长过程,其中代谢物被认为是连接表型和基因型的桥梁,能及时反映植物的生理状态。代谢组学分析能检测并筛选出逆境条件时植物体内具有重要生物学意义和统计学显著差异的代谢物[5-6],已广泛用于不同物种的逆境胁迫机理研究。Goufo et al.[7]发现,在豇豆(Vignaunguiculata)根中,氨基酸、可溶性糖以及原花青素的积累,与干旱胁迫起始阶段的感知密切相关。盐胁迫时,西伯利亚白刺(Nitrariasibirica)根部,γ-氨基丁酸、天冬酰胺、天冬氨酸、苹果酸、草酰乙酸及延胡索酸等代谢物质量分数明显增加[8]。Lu et al.[9]研究表明,高羊茅(Festucaarundinacea)和星星草(Puccinelliatenuiflora)中,酮戊二酸、乌头酸、脯氨酸、可溶性糖和山梨糖等代谢物在混合盐碱胁迫时大量积累。从代谢通路来看,盐胁迫时,多年生黑麦草(Loliumperenne)显著差异代谢物主要富集于淀粉和蔗糖代谢通路、半乳糖代谢通路、丝氨酸和苏氨酸代谢通路、乙醛酸和二羧酸代谢通路、光合碳循环代谢通路等[10]。棉花(Gossypiumhirsutum)在盐碱胁迫时,代谢产物变化最明显的代谢通路是色氨酸代谢、精氨酸和脯氨酸代谢与柠檬酸循环(TCA循环)[11]。由此可见,代谢组分析为植物适应逆境胁迫的分子机理研究提供了新的证据。樟属植物遗传多样性丰富,种间耐碱性差异较大,目前关于樟属植物耐碱机理研究仍较少[12]。我们前期的转录组分析表明,碱敏感猴樟叶片苯丙氨酸、酪氨酸和色氨酸的生物合成通路、精氨酸和脯氨酸代谢通路、异喹啉生物碱生物合成通路、植物——病原菌互作通路、类胡萝卜素生物合成通路等相关基因表达量在碱胁迫时明显上调[13],但对猴樟根系适应碱胁迫的机制并不了解。因此,本研究以猴樟根系为研究对象,采用水培培养技术,研究碱胁迫时代谢物的积累和代谢途径,以期从代谢组学角度,为解析猴樟适应碱胁迫的分子机理提供参考。
1 材料与方法
试验材料:试验在宿迁学院樟属植物种苗基地进行,于2020年8月采种,低温层积后,于2021年2月播种,选择正常生长、长势一致的猴樟幼苗为试验材料,苗高(30±2)cm。
试验设计:试验采用水培培养技术,将幼苗移入塑料水培箱(营养液体积为38 L)中培养,营养液配方为0.5倍的霍格兰营养液,采用蒸馏水进行配制,采用KT板(厚度为2 cm)进行固定,期间采用增氧泵24 h充氧。试验设2个处理,材料培养3周后,根据课题组前期研究,向各处理营养液中加入Na2CO3,浓度分别为0(对照)、20 mmol/L(浓度≥30 mmol/L则出现幼苗逐步死亡现象)[14],营养液pH分别为7.58、9.49。分别于处理之后的6、48 h随机选取各重复幼苗根部须根系,分别标注为HCK6(对照处理6 h)、HT6(Na2CO3处理6 h)、HCK48(对照处理48 h)、HT48(Na2CO3处理48 h),液氮速冻后,于-80 ℃冻存,每处理3个生物学重复。
代谢物提取、检测:取液氮研磨后的样品40 mg,参考郭家鑫等[11]的方法进行代谢物提取,采用超高效液相色谱系统(岛津,LC-30)进行分离,采用质谱仪(赛默飞世尔科技公司QE Plus)进行质谱分析。
数据质量与稳定性验证:采用MS-DIAL软件完成原始数据的基线对齐、保留时间矫正和解卷积等工作。采用精确质量数匹配(质量偏差<2×10-5)和二级谱图匹配(质量偏差<0.02 u)的方式进行代谢物结构鉴定,检索人类代谢组数据库(HMDB)及上海拜谱生物科技有限公司自建的代谢物标准品库。运用正交偏最小二乘方判别分析(OPLS-DA)进一步修正由偏最小二乘回归建立的代谢物表达量与样品类别之间的关系模型,依据OPLS-DA得分图上的预测主成分区分组间变异。
差异代谢物筛选与功能注释:差异代谢物筛选条件为:(1)OPLS-DA模型得到的变量权重值>1;(2)单变量统计分析结果(P值)<0.05。依据HMDB数据库对各比较组的差异代谢物进行分类统计,采用京都基因与基因组百科全书(KEGG)系统进行通路分析。对差异代谢物的注释结果进行差异丰度得分的计算,利用差异丰度得分对代谢通路进行整体趋势分析。当差异丰度得分为-1时,表示该通路中所有代谢物的丰度均下降,当差异丰度得分为1时,表示该通路中所有代谢物的丰度均上升,越趋近于1或-1,表示该通路整体表达情况越倾向于上调或下调。
2 结果与分析
2.1 碱胁迫时猴樟根系差异代谢物筛选
图1为HT6和HCK6、HT48和HCK48组合正、负离子模式的OPLS-DA分析结果,横坐标上预测主成分以0为中心点,将各组合中的两组样品明显分离开,说明各组合中样品组间代谢物表达量差异显著。

A为HT6和HCK6正离子模式;B为HT6和HCK6负离子模式;C为HT48和HCK48正离子模式;D为HT48和HCK48负离子模式。
由碱胁迫处理6、48 h的猴樟根系显著差异次生代谢产物韦恩图可知,碱胁迫处理6 h时,HT6和HCK6组合共鉴定到正离子模式差异显著的次生代谢产物126个,鉴定到负离子模式差异显著的次生代谢产物143个,共计269个;碱胁迫处理48 h后,HT48和HCK48组合共鉴定到正离子模式差异显著的次生代谢产物194个,鉴定到负离子模式差异显著的次生代谢产物166个,共计360个。两组共有的差异代谢物分别是正离子模式95个和负离子模式99个。碱处理48 h后的表达量差异显著次生代谢产物数量比碱处理6 h的增加了91个,其中正离子模式的增加了68个。
2.2 碱胁迫时猴樟根系差异代谢物分类
由表1、2可知,当碱胁迫处理6 h时,HT6和HCK6组合正离子模式表达差异代谢物主要包括生物碱类、聚酮类、苯丙素类和萜类;负离子模式差异代谢物包括萜类、核酸、聚酮类、有机酸类、生物碱类、碳水化合物和脂类。当碱胁迫处理48 h时,HT48和HCK48组合正离子模式差异代谢物主要包括生物碱类、聚酮类、类固醇类、苯丙素类、甾醇类酯和萜类;负离子模式差异代谢物包括聚酮类、萜类、生物碱类、核酸、抗生素和脂类。
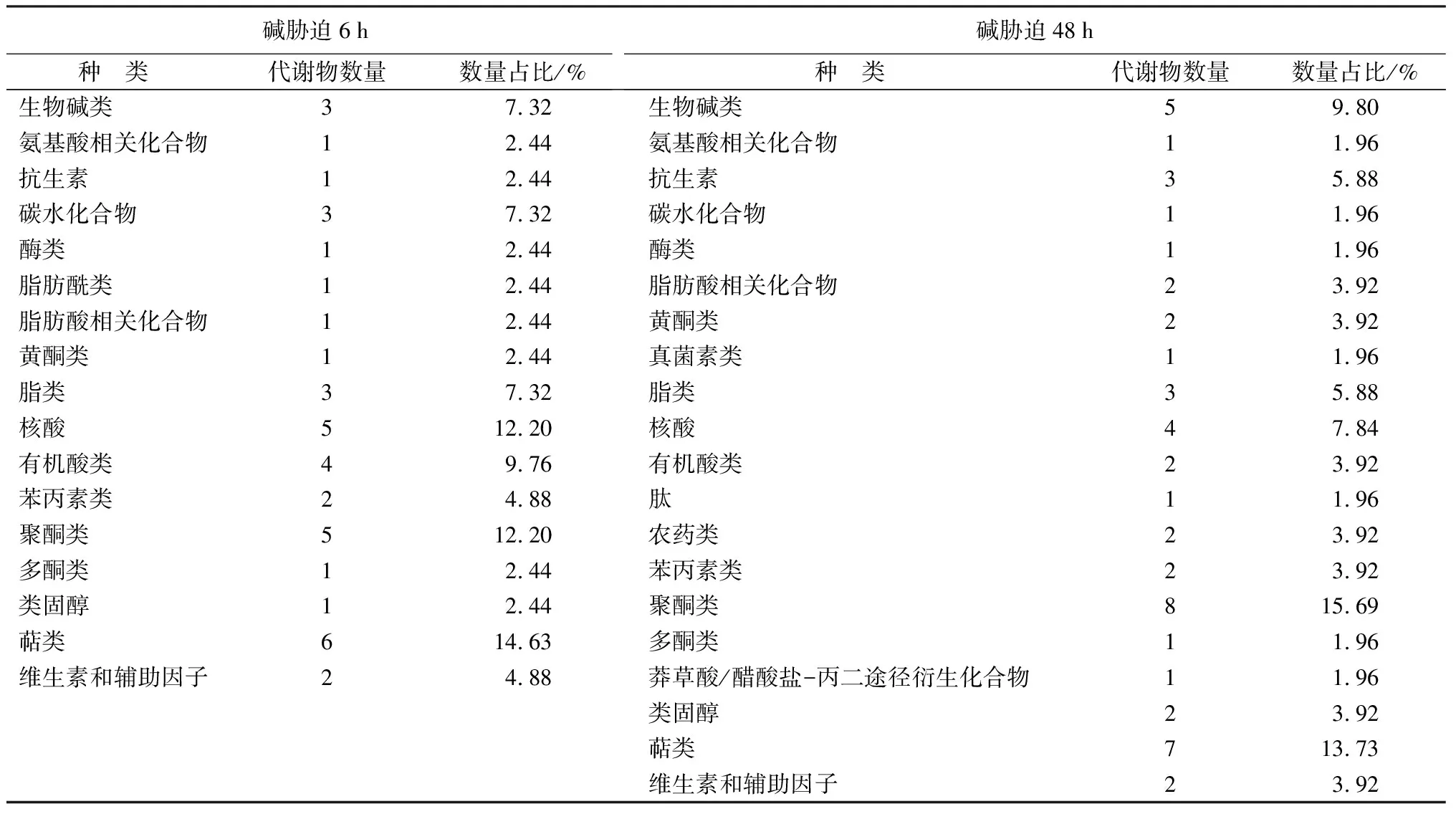
表2 碱胁迫6、48 h时猴樟根系负离子模式差异代谢物种类
2.3 碱胁迫时猴樟根系差异代谢物KEGG通路分析
在植物体中,多种代谢物通常相互协调完成不同的生物学任务,差异丰度得分可以捕捉到通路中整体代谢物相对于对照组增加或减少的趋势。由表3可知,碱胁迫处理6 h时,HT6和HCK6组合中能鉴定出差异代谢物主要富集的30条KEGG通路,其中嘧啶代谢通路和玉米素生物合成通路最为显著;由表4可知,富集的30条KEGG通路中,大部分显著下调或趋于下调,只有脂肪酸生物合成通路和丙氨酸、天冬氨酸和谷氨酸代谢通路显著上调,而托烷、哌啶和吡啶生物碱的生物合成通路、嘧啶代谢通路、磷酸转移酶系统(PTS)通路和苯丙烷生物合成通路趋于上调,其余通路无明显变化。
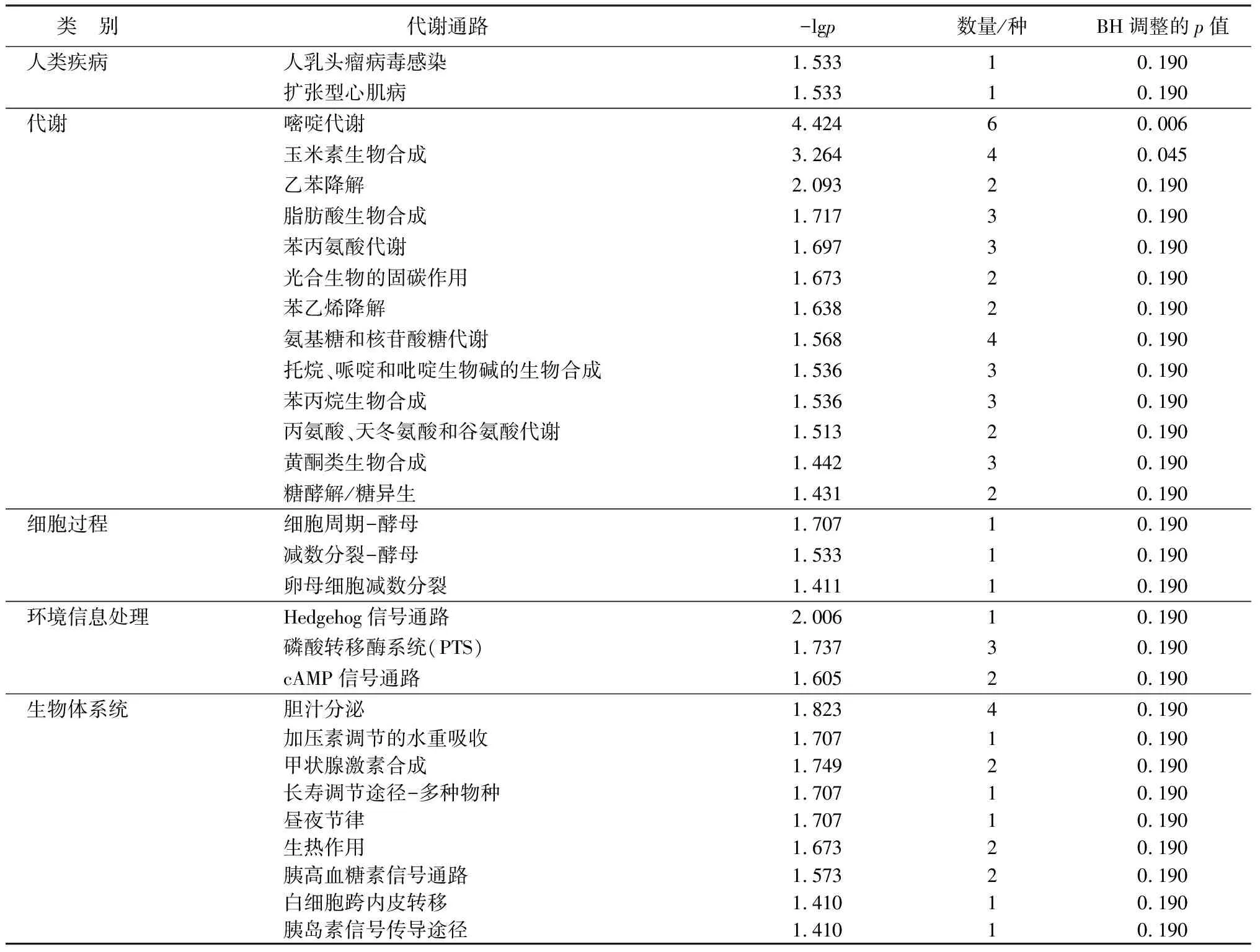
表3 碱胁迫6 h时猴樟根系差异代谢物KEGG通路分析结果

表4 碱胁迫6 h时猴樟根系差异代谢物KEGG通路的差异丰度得分
如表5所示,碱胁迫处理48 h时,HT48和HCK48组合中,能鉴定出差异代谢物主要富集的30条KEGG通路,其中醛固酮合成与分泌、皮质醇合成和分泌、库欣综合征、卵母细胞减数分裂、孕酮介导的细胞成熟、胆汁分泌、嘧啶代谢、胰岛素抵抗、黄酮类生物合成、光合生物的固碳作用、卵巢类固醇激素生成、黄酮和黄酮醇生物合成通路最显著;如表6所示,富集的30条KEGG通路中只有半乳糖代谢通路和黄酮类生物合成通路趋于上调,而托烷、哌啶和吡啶生物碱生物合成通路整体无显著变化,其余通路均显著下调或趋于下调。
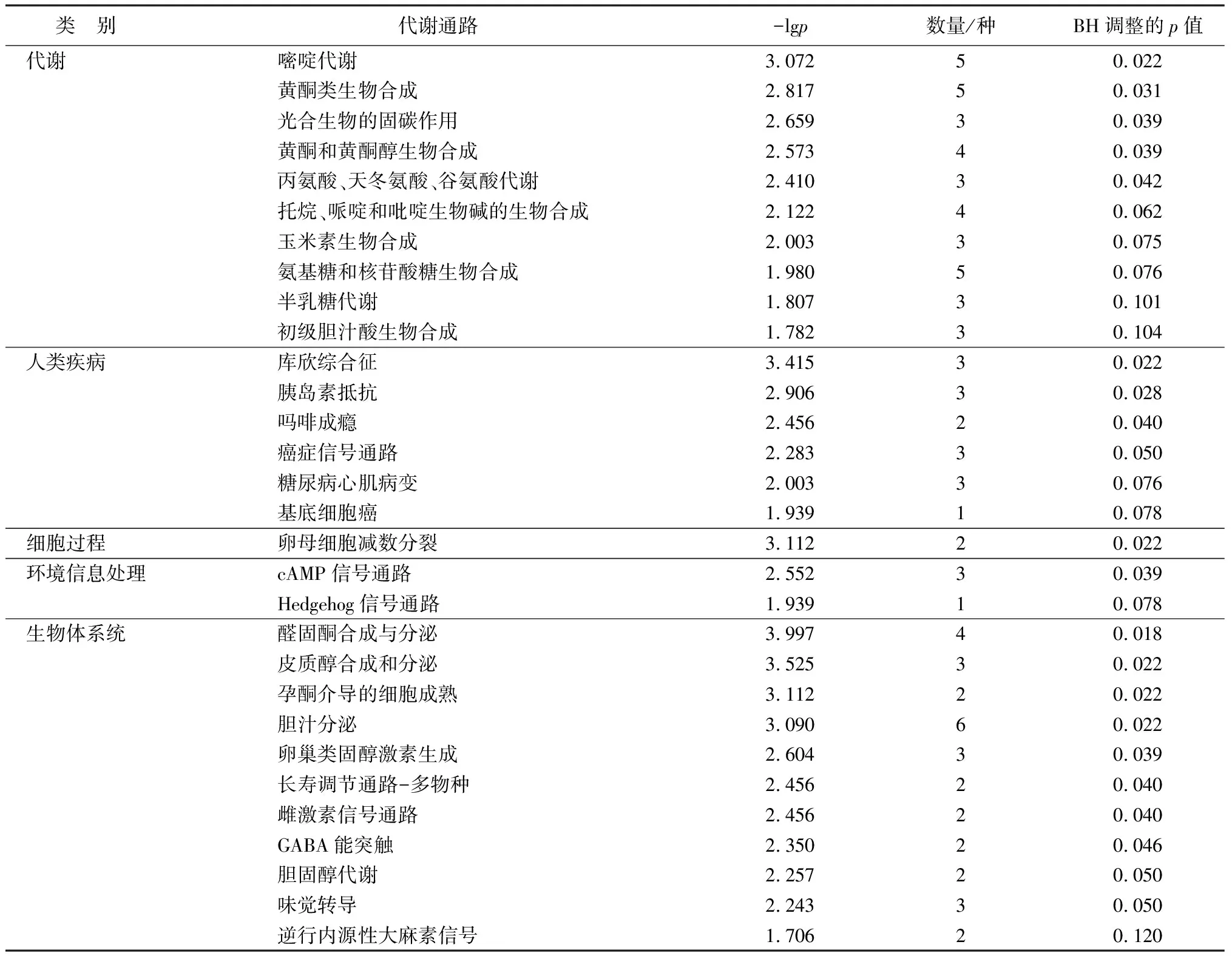
表5 碱胁迫48 h时猴樟根系差异代谢物KEGG通路分析结果

表6 碱胁迫48 h时猴樟根系差异代谢物KEGG通路的差异丰度得分
2.4 碱胁迫时猴樟根系差异代谢物质量分数变化
由表7可见,碱胁迫处理6 h时,HT6和HCK6组合中鉴定出脂肪酸生物合成通路中的丙二酸、月桂酸、棕榈酸、亚油酸质量分数显著上升;丙氨酸、天冬氨酸和谷氨酸代谢通路中N-乙酰天冬氨酰谷氨酸、草酰乙酸、2-氧代丁酸质量分数显著上升;托烷、哌啶和吡啶生物碱的生物合成通路中的千里光碱和东莨菪碱质量分数显著上升,胡椒碱质量分数显著下降;嘧啶代谢通路中尿苷5’-二磷酸、尿苷、尿嘧啶、丙二酸质量分数显著上升,尿苷一磷酸(UMP)的显著下降;磷酸转移酶系统通路海藻糖、N-乙酰氨基甲酸质量分数显著上升,水杨苷质量分数显著下降;苯丙烷生物合成通路中的苹果酸芥子酰、丁香素质量分数显著上升;半乳糖代谢通路中的水苏糖质量分数显著上升,UDP-葡萄糖质量分数显著下降;黄酮类生物合成通路中的高圣草素、(-)-表儿茶素、松木素质量分数显著下降。
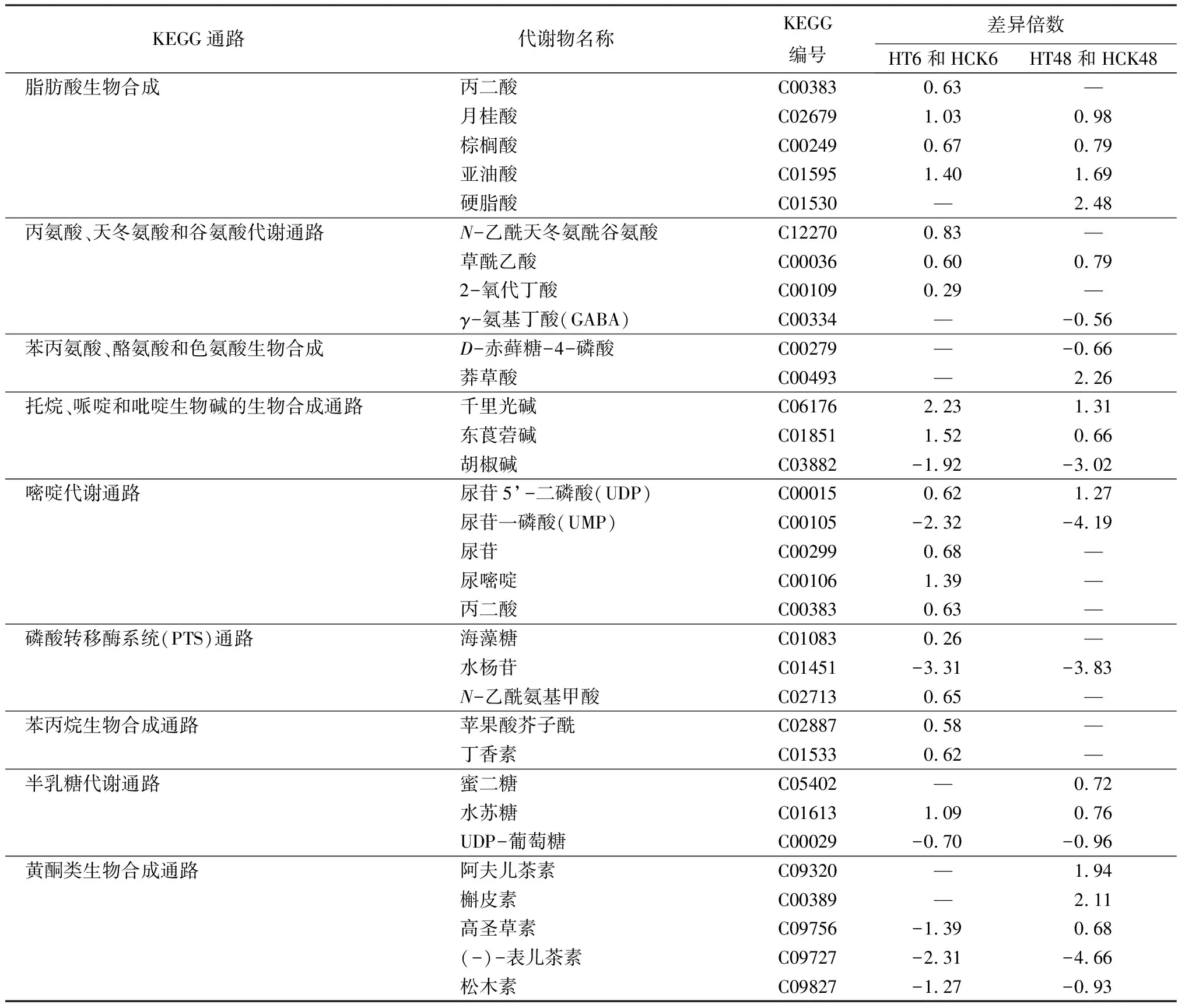
表7 筛选出的关键差异代谢物
碱胁迫处理48 h时,HT48和HCK48组合中鉴定出脂肪酸生物合成通路中的月桂酸、棕榈酸、亚油酸、硬脂酸质量分数显著上升;丙氨酸、天冬氨酸和谷氨酸代谢通路中草酰乙酸质量分数显著上升,γ-氨基丁酸(GABA)质量分数显著下降;苯丙氨酸、酪氨酸和色氨酸生物合成通路中的莽草酸质量分数显著上升,D-赤藓糖-4-磷酸质量分数显著下降;托烷、哌啶和吡啶生物碱的生物合成通路中的千里光碱和东莨菪碱质量分数显著上升,胡椒碱质量分数显著下降;嘧啶代谢通路中尿苷5’-二磷酸质量分数显著上升,尿苷一磷酸质量分数显著下降;磷酸转移酶系统通路水杨苷质量分数显著下降;半乳糖代谢通路中的蜜二糖、水苏糖质量分数显著上升,UDP-葡萄糖质量分数显著下降;黄酮类生物合成通路中的阿夫儿茶素、槲皮素、高圣草素质量分数显著上升,(-)-表儿茶素、松木素质量分数显著下降。
3 结论与讨论
植物在逆境胁迫的基因表达与环境因素共同作用,伴随代谢通路和代谢物质量分数的变化,代谢物积累既有时空积累的特异性,又存在适应逆境的多样性。目前,已发现许多代谢物在盐胁迫时显著上调,盐胁迫明显提高了狗牙草(Cynodondactylon)氨基酸、可溶性糖、有机酸以及可溶性糖醇等37种代谢物的质量分数[15];油菜(Brassicanapus)通过促进三羧酸循环,积累糖类和肌醇代谢物,适应盐胁迫[16];椰子(Cocosnucifera)在盐胁迫时,黄酮类代谢物质量分数及其合成相关的基因表达量明显提高[17],这些代谢物的积累有利于维持植物胞内渗透调节、清除氧化损伤和稳定蛋白质功能。最近的代谢组分析发现,植物根系适应盐胁迫和碱胁迫的机理存在差异,生物碱和类胡萝卜素参与了垂丝海棠(Malushalliana)适应碱胁迫[18];棉花(Gossypiumhirsutum)主要通过三羧酸循环代谢、色氨酸代谢、精氨酸和脯氨酸代谢通路适应碱胁迫[11]。与对照相比,碱胁迫处理6 h时,猴樟根系共鉴定到表达量差异显著的次生代谢产物269个,包括生物碱类、聚酮类、有机酸类、核酸、苯丙素类和萜类等;碱胁迫处理48 h时,共鉴定到表达量差异显著的次生代谢产物360个,主要包括聚酮类、生物碱类、核酸、脂类、苯丙素类、抗生素和萜类等。可见,碱胁迫时间越长,参与适应碱胁迫的代谢物种类越多,猴樟受到的影响也越大。植物体内维生素、类黄酮、木质素、生物碱、花青素等多种次生代谢物的前体来源是莽草酸途径[19],碱胁迫处理48 h时,猴樟根系苯丙氨酸、酪氨酸和色氨酸生物合成途径中的D-赤藓糖-4-磷酸表达量显著下调,而莽草酸表达量显著上调,莽草酸途径与此时代谢物的大量合成有关。
逆境胁迫时,植物体内代谢物积累具有系统性和特异性。本试验结果显示,当碱胁迫处理6 h时,KEGG通路中大部分显著下调或趋于下调,只有脂肪酸生物合成和丙氨酸、天冬氨酸和谷氨酸代谢通路显著上调,而托烷、哌啶和吡啶生物碱的生物合成通路、嘧啶代谢通路、磷酸转移酶系统通路和苯丙烷生物合成通路趋于上调。因此,在碱胁迫处理前期,猴樟主要通过提高根系氨基酸、糖类、有机酸和生物碱的质量分数适应碱胁迫。脂肪酸是生物膜的重要成分和细胞中的重要能源物质,还是一些逆境适应信号合成的前体物质[21]。在许多植物中已观察到盐碱胁迫会使细胞膜脂质量分数、组分发生改变,细胞膜的结构和功能受到伤害[22]。碱胁迫处理时,脂肪酸代谢相关通路中棕榈酸、亚油酸、月桂酸质量分数的提高,除了利于维持生物膜的稳定性外,还可通过促进茉莉酸等激素信号的传递及时适应NaHCO3和NaCl的胁迫[23]。氨基酸代谢被证明参与多种逆境胁迫[8,24],碱胁迫处理6 h时,丙氨酸、天冬氨酸、谷氨酸代谢通路中,N-乙酰天冬氨酰谷氨酸、草酰乙酸和2-氧代丁酸质量分数显著上升,N-乙酰天冬氨酰谷氨酸和草酰乙酸参与天冬氨酸的合成,而2-氧代丁酸参与亮氨酸和缬氨酸的合成,植物体内氨基酸的积累参与了活性氧的清除和细胞损伤的修复[25]。值得注意的是,碱胁迫处理48 h时,丙氨酸、天冬氨酸、谷氨酸代谢通路中草酰乙酸质量分数依然显著上升,而γ-氨基丁酸质量分数显著下降。γ-氨基丁酸是高等植物中重要的N代谢中间产物,其质量分数下降与三羧酸循环回补作用有关[26],而草酰乙酸质量分数上升除了利于调节根际pH外,也参与了三羧酸循环,三羧酸循环与猴樟耐碱性密切相关。植物体内的生物碱通常受茉莉酸等信号诱导合成[27],多数生物碱在根部合成后,进入木质部,通过三磷酸腺苷结合盒转运体运输进入其他器官发挥作用[28]。碱胁迫处理6 h和48 h时,托烷、哌啶和吡啶类生物碱合成通路中,千里光碱和东莨菪碱质量分数显著上升。外源化学药剂处理提高植物耐盐性的同时,也会伴随东莨菪碱质量分数的提高[29],千里光碱也具有明显的抗氧化活性[30],可以认为生物碱类主要通过其抗氧化活性参与猴樟耐碱性。糖类代谢物是许多非盐生植物的主要渗透调节物质,能够维持逆境下细胞膜及原生质体的稳定,降低细胞中酶类的降解,还能通过三羧酸循环为植物适应逆境胁迫的代谢过程提供能量[18]。碱胁迫处理6 h时,磷酸转移酶系统通路趋于上调,猴樟根系对糖类的转运和利用能力提高,同时代谢物海藻糖和N-乙酰氨基甲酸质量分数显著上升,海藻糖作为渗透剂,保障了细胞膜和蛋白质功能稳定[31],还通过其抗氧化活性提高植物耐碱性[32]。嘧啶代谢通路相关基因通常在逆境胁迫下上调表达[33],碱胁迫处理6 h时,嘧啶代谢通路中,尿苷5’-二磷酸、尿苷、尿嘧啶和丙二酸表达量上调,尿苷主要参与核酸合成,而碱胁迫能促进核酸合成[34],核酸合成有助于猴樟适应短时间碱胁迫。碱胁迫处理48 h时,尿苷5’-二磷酸表达依然显著上调,此时尿苷5’-二磷酸作为糖基供体合成的参与者,促进黄酮类物质的糖基化过程[35-36]。苯丙烷类代谢是花青素、黄酮、花色素苷、香豆素、肉桂酸及木质素等多种代谢产物的合成途径[37],受茉莉酸等激素信号调控[38-39],相关基因在碱性和低铁条件下表达显著上调[40]。碱胁迫处理6 h时,苯丙烷合成途径中的苹果酸芥子酰、丁香素质量分数显著上升,苹果酸芥子酰和丁香素均参与木质素合成[41],苹果酸芥子酰是芥子酸酯代谢途径中的主要成员,还与脱落酸代谢合作调控叶片气孔关闭和根系生长[42-43],从而提高猴樟耐碱性。
随着碱胁迫时间的延长,猴樟生长发育受到的影响逐步加重。当碱胁迫处理48 h时,KEGG和差异丰度得分结果显示,只有半乳糖代谢通路和黄酮类生物合成通路趋于上调,其他通路均显著下调或趋于下调,猴樟根系适应碱胁迫的途径发生改变。有研究表明,半乳糖代谢通路相关基因在盐碱胁迫时会上调表达[44],促进糖类质量分数的增加[45],提高植物抗性。碱胁迫处理48 h时,半乳糖代谢通路中的蜜二糖、水苏糖质量分数显著上升,UDP-葡萄糖质量分数显著下降。水苏糖是由1分子蔗糖和2分子D-吡喃半乳糖通过α-1,6-糖苷键连接而成的四糖,又能通过β-呋喃果糖苷酶分解为蜜二糖和D-半乳糖,同时在碱胁迫6 h时的质量分数也显著上升,水苏糖主要作为渗透保护剂调控猴樟耐碱性[46],但也有报道指出,水苏糖是引起地黄等植物连作障碍的主要因素[47],因此,水苏糖对猴樟根系耐碱性的作用还需要进一步研究。UDP-葡萄糖是黄酮类物质糖基化的供体,UDP-葡萄糖质量分数在碱胁迫后期显著下降,与黄酮类代谢物大量合成有关[35-36]。黄酮类化合物通常以苷与苷元的形式广泛存在于植物体内,具有抗生物和非生物胁迫的功能[48]。碱胁迫处理48 h时,黄酮类生物合成通路中的阿夫儿茶素、槲皮素、高圣草素质量分数显著上升,而(-)-表儿茶素和松木素质量分数显著下降。高圣草素、阿夫儿茶素、槲皮素均被证明与植物抗盐有关[17,49],能增强植株对氧化胁迫的耐受性,减缓活性氧诱导的细胞氧化损失[20,50],黄酮类物质主要通过其抗氧化活性在猴樟碱胁迫后期起主导作用。
综上所述,植物对盐、碱胁迫的适应机制不尽一致,生物碱类、聚酮、有机酸类、核酸、苯丙素类、脂类、抗生素和萜类均参与猴樟耐碱胁迫过程。碱胁迫时间越长,猴樟受到的影响越大,参与适应碱胁迫的代谢物种类越多,这与莽草酸途径有关。KEGG和差异丰度得分结果显示,当碱胁迫处理6 h时,KEGG通路中大部分显著下调或趋于下调,只有脂肪酸生物合成通路和丙氨酸、天冬氨酸和谷氨酸代谢通路显著上调,而托烷、哌啶和吡啶生物碱的生物合成通路、嘧啶代谢通路、磷酸转移酶系统通路和苯丙烷生物合成通路趋于上调,猴樟通过提高氨基酸、糖类、有机酸和生物碱的质量分数适应初期碱胁迫;当碱胁迫处理48 h时,KEGG通路中只有半乳糖代谢通路和黄酮类生物合成通路趋于上调,其他通路均显著下调或趋于下调,猴樟主要依靠黄酮类物质抵抗碱胁迫后期的氧化胁迫,茉莉酸代谢等信号调控在猴樟适应碱胁迫过程起重要作用。
