微小RNA-6779-5p对白细胞介素-1β诱导软骨细胞损伤的影响及机制研究
2023-07-09左淑飞秦艺璐郭占非边彩月范文强
左淑飞, 梁 舒, 秦艺璐, 吴 洁, 张 超, 郭占非, 边彩月, 范文强
(新乡市中心医院/新乡医学院第四临床学院 风湿免疫科, 河南 新乡, 453000)
骨关节炎是一种关节疾病,患者常伴有慢性疼痛、关节僵硬以及身体残疾等特征,发病率和年龄有关[1-2]。骨关节炎的治疗方法有手术治疗、非药物治疗(例如运动、减肥和物理治疗)和药物治疗,而在药物治疗相关方案中,中西医结合治疗具有绝对优势[3-5]。微小RNA(miRNAs)是一类单链的RNAs, 包含18~25个核酸,不具有编码蛋白的能力,能够通过结合基因非编码区调控基因表达[6-7]。既往研究[8]主要关注miRNAs对肿瘤发展的影响,但炎性相关疾病的发病机制也涉及miRNAs。研究[9]显示, miRNAs通过介导肠道屏障稳态、炎症反应和细胞自噬进程参与炎症性肠病。miRNAs能通过调节宿主防御功能、炎性因子以及抑炎因子的表达来介导包括细菌性肺炎和病毒性肺炎在内的呼吸系统炎症性疾病发展[10]。研究表明一些miRNAs如miR-29b-5p[11]、miR-1271[12]以及miR-146a[13]可能参与调控骨关节炎的发病进程。miR-6779-5p属于miRNA家族成员,但尚无相关研究阐明骨关节炎发展是否涉及miR-6779-5p。
研究[14-16]揭示白细胞介素-1β(IL-1β)能通过核因子κB(NF-κB)信号轴调控软骨损伤。ZHANG J M等[17]采用IL-1β诱导的骨关节炎细胞模型证明中度机械应激能够通过调控线粒体功能和活性氧清除参与软骨细胞凋亡。GUO X等[18]采用IL-1β诱导的骨关节炎细胞模型证明了毛蕊异黄酮参与骨关节炎的发生发展。本研究通过瞬时转染的方法将商业合成的miR-6779-5p模拟物转染到IL-1β诱导软骨细胞,通过细胞计数试剂盒8(CCK-8)法、5-乙基-2′-脱氧尿苷(EdU)实验、流式细胞仪以及荧光素酶报告实验分析miR-6779-5p对骨关节炎发展的影响及机制,现报告如下。
1 材料与方法
1.1 主要试剂
采用体外细胞分子生物学实验。实验在新乡市中心医院风湿免疫科实验室进行,于2023年2月28日完成。主要试剂有: IL-1β(广州赛业科技); RNA提取试剂盒(北京天根生化科技); 白细胞介素1受体相关激酶3(IRAK3)和甘油醛-3-磷酸脱氢酶(GAPDH)一抗抗体以及二抗抗体(武汉华美生物); CCK-8试剂盒、BCA定量试剂盒、胎牛血清、蛋白分子量标准、蛋白酶抑制剂、琼脂糖和NP-40(上海碧云天技术); MiRcute miRNA isolation kit、TGrinder H24R组织研磨低温均质仪、细胞增殖试剂盒和miR-6779-5p模拟物(广州锐博科技); Lipofectamine 2000转染试剂、Dulbecco改良Eagle培养基(DMEM)、聚偏氟乙烯膜、pcDNA3.1载体、磷酸缓冲液、减血清培养基(美国Thermo Fisher公司); IRAK3过表达载体(南京金斯瑞生物); 点直接突变试剂盒和凋亡检测试剂盒(上海翊圣生物); 本实验中所用的其他一抗抗体(美国CST公司)。主要仪器有: 蛋白电泳仪和转模仪(美国Invitrogen公司); 蛋白成像系统(美国UVP公司); 流式细胞仪(美国Thermo Fisher公司); TGrade Lite金属浴和TGyrate mini涡旋混匀仪(北京天根生化科技)。
1.2 实验方法
1.2.1 人体软骨组织: 人体软骨标本的收集得到了新乡市中心医院伦理委员会的同意,所有参与者均提供了知情同意书。23例骨关节炎软骨组织是从骨关节炎患者中收集而来, 19例正常软骨组织由创伤性截肢者提供,这些组织在收集后储存在-80 ℃冰箱。
1.2.2 细胞培养: 人软骨细胞(CHON-001, 上海酶研生物)培养在添加有10%胎牛血清和1%抗生素的DMEM培养基中,并于37 ℃的培养箱中培养。
1.2.3 诱导实验: 根据所需培养孔数量准备细胞, CHON-001细胞汇合度达到90%左右时用胰酶进行消化,消化时间依据显微镜下细胞状态而定。将细胞接种到12孔板中,待细胞密度达到50%~70%时,将IL-1β(0、5、10、15 ng/mL)加到所需孔中,并放置到培养箱中维持24 h[19]。将添加0 ng/mL IL-1β(即添加同体积的磷酸缓冲液)的培养孔标记为0 ng/mL组,将添加5、10和15 ng/mL IL-1β的培养孔分别标记为5 ng/mL组、10 ng/mL组和15 ng/mL组。
在细胞转染的前1 d, 按照实施转染实验的时间,调整CHON-001细胞密度并接种到12孔板中,培养过夜,将Lipofectamine 2000转染试剂和miR-6779-5p或miR-NC在旋涡震荡仪上混匀,参照说明书的要求静置15 min, 随后依次将混合液加到培养孔中,将培养皿在操作工作台上轻轻摇晃后放置在培养箱中孵育48 h, 随后与10 ng/mL IL-1β或者同体积的磷酸缓冲液孵育24 h,并标记为control组、IL-1β组、IL-1β+miR-NC组以及IL-1β+miR-6779-5p组。以同样方法标记IL-1β+miR-6779-5p+pcDNA组和IL-1β+miR-6779-5p+IRAK3组。
1.2.4 实时定量聚合酶链反应(qRT-PCR)分析RNA表达: 利用NanoDrop-1000设备检测提取的RNA浓度。样品浓度提前稀释到规定的浓度范围,根据商业化的反转录试剂盒操作步骤合成cDNA。将cDNA稀释5倍,参照以下标准设置20 μL定量体系定量RNA表达: 2 μL cDNA模板、上游引物和下游引物各0.5 μL、10 μL SuperReal PreMix Color和7 μL双蒸水。将cDNA稀释5倍,参照以下标准设置20 μL定量体系定量miRNA表达: 2 μL cDNA模板、miRNA特异引物和mRQ 3′引物各0.5 μL、10 μL TB Green Advantage Premix和7 μL双蒸水。基因的定量是在IQ5热循环仪上进行的。以2-△△Ct法分析基因表达,引物序列见表1。

表1 定量分析引物序列
1.2.5 细胞活力分析: 将CHON-001细胞在96孔板上培养并接受细胞转染以及IL-1β处理操作,随后根据CCK-8试剂盒的说明将CCK-8试剂加入培养孔中, 4 h后检测样品光密度值。
1.2.6 细胞增殖实验: 将经过细胞转染和IL-1β处理的软骨细胞培养在96孔板上2 h(实验前已加入标准浓度50 μmol/L EdU), 随后根据说明书的要求将多聚甲醛加入培养孔中。在软骨细胞和4′, 6-二脒基-2-苯基吲哚(DAPI)染色液孵育后,利用荧光显微镜分析EdU阳性的细胞。
1.2.7 细胞凋亡分析: 采用结合缓冲液将细胞重悬,随后将细胞和膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)以及碘化丙啶避光孵育10 min。采用流式细胞仪分析细胞凋亡率。
1.2.8 双荧光素酶报告实验: 采用PCR技术将包含预测miR-6779-5p结合位点的IRAK3 3′非编码区(3′UTR)扩增并插入到pmirGLO载体,命名WT-IRAK3 3′UTR。采用点直接突变试剂盒将IRAK3 3′UTR中的5′-CCTCCCAG-3′突变成5′-GGAGGGTC-3′, 以相同方式构建MUT-IRAK3 3′UTR。将报告质粒和miR-6779-5p或miR-NC转染到软骨细胞中,48 h后采用双荧光素酶报告实验试剂盒检测荧光素酶活性。
1.2.9 蛋白表达分析: 采用NP-40裂解液裂解样品以提取样品蛋白,蛋白浓度分析利用BCA试剂盒完成。根据测定的蛋白浓度,计算20 μg蛋白所需体积,将相应体积的蛋白样品采用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)处理。将聚偏二氟乙烯(PVDF)膜在脱色摇床中和稀释过的IRAK3、GAPDH、p-P65、P65、IκBα和p-IκBα一抗抗体在4 ℃环境下孵育12 h。PVDF膜在脱色摇床经过洗涤后与二抗孵育2 h。最后利用图像分析系统分析PVDF膜。
1.3 统计学分析
2 结 果
2.1 miR-6779-5p在骨关节炎患者软骨组织和IL-1β刺激的CHON-001细胞中低表达
本研究首先利用GEO数据库(GEO数据登录号: GSE175961)筛选了骨关节炎患者中表达异常的miRNAs, 并罗列了表达较低的前7位miRNAs(图1A); 随后又鉴定了前2位miRNAs的表达量(miR-1285-5p和miR-6779-5p), 与miR-1285-5p相比, miR-6779-5p在骨关节炎患者中表达降低,差异有统计学意义(P<0.05)(图1B); miR-6779-5p在骨关节炎患者软骨组织中的表达较正常对照组降低,差异有统计学意义(P<0.05)(图1C), 且IL-1β处理能够在CHON-001细胞中呈浓度依赖性地减少miR-6779-5p的表达,差异有统计学意义(P<0.05)(图1D)。
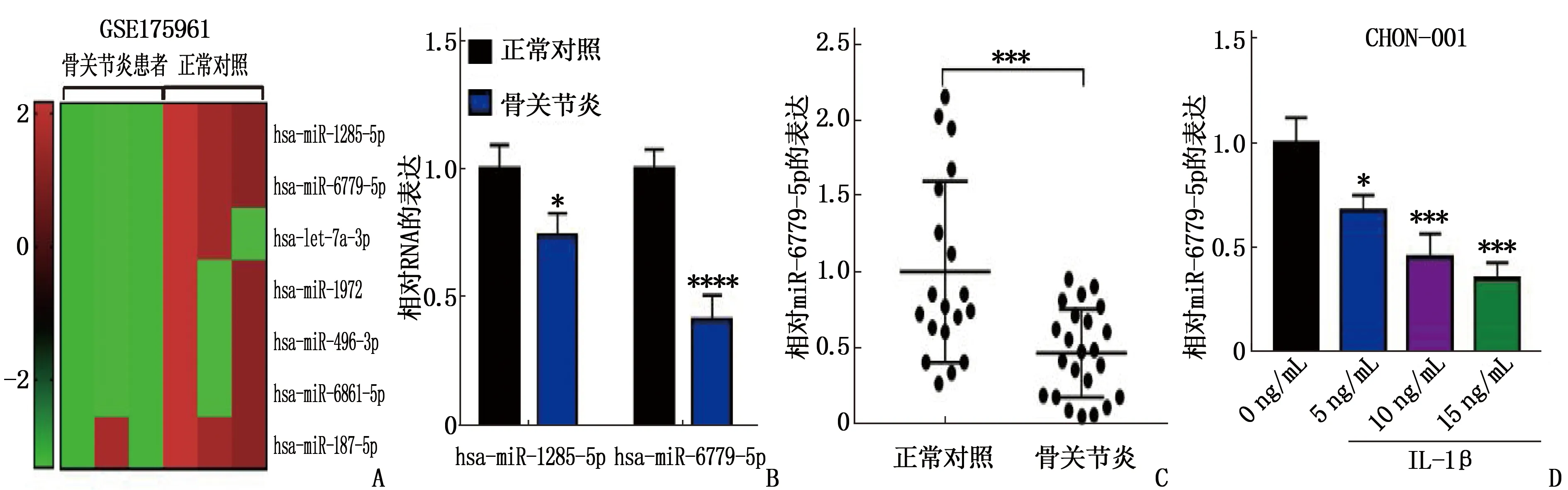
A: GEO数据库分析骨关节炎患者中表达较低的前7位miRNAs; B、C: miR-1285-5p以及miR-6779-5p表达分析,与正常对照组比较, *P<0.05, ***P<0.001, ****P<0.000 1; D: 不同浓度IL-1β处理对CHON-001细胞miR-6779-5p的表达影响,与0 ng/mL比较, *P<0.05, ***P<0.001。
2.2 miR-6779-5p模拟物减弱了IL-1β诱导的软骨细胞损伤
与control组相比, IL-1β组中miR-6779-5p的表达降低,差异有统计学意义(P<0.05); 与IL-1β+miR-NC组比较, IL-1β+miR-6779-5p组中miR-6779-5p的表达升高,差异有统计学意义(P<0.05)(图2A)。与control组相比, IL-1β组中软骨细胞活力和EdU阳性率降低,细胞凋亡率增加,差异有统计学意义(P<0.05); 与IL-1β+miR-NC组比较, IL-1β+miR-6779-5p组中软骨细胞活力和EdU阳性率升高,细胞凋亡率降低,差异有统计学意义(P<0.05)(图2B、2C、2D)。

A: miR-6779-5p和IL-1β处理对miR-6779-5p表达的影响; B、C、D: miR-6779-5p和IL-1β处理对细胞活力、增殖和凋亡的影响(放大400倍)。与IL-1β比较, ***P<0.001, ****P<0.000 1; 与IL-1β+miR-NC比较, **P<0.01, ***P<0.001。
2.3 miR-6779-5p和IRAK3的关系鉴定
IRAK3和miR-6779-5p结合位点见图3A。本研究发现,相对荧光素酶活性在WT-IRAK3 3′UTR和miR-6779-5p共转染后降低,差异有统计学意义(P<0.05), 但在MUT-IRAK3 3′UTR和miR-6779-5p共转染后相对荧光素酶活性变化差异无统计学意义(P>0.05)(图3B)。IRAK3在骨关节炎患者软骨组织中的表达较正常对照组更高,差异有统计学意义(P<0.05)(图3C), 且在骨关节炎患者软骨组织中的表达与miR-6779-5p表达呈负相关(P<0.05)(图3D)。IL-1β处理能够在CHON-001细胞中呈浓度依赖性地增加IRAK3的表达,差异有统计学意义(P<0.05)(图3E)。
2.4 miR-6779-5p通过结合IRAK3减弱IL-1β诱导的软骨细胞损伤
与control组相比, IL-1β组中IRAK3的表达升高,差异有统计学意义(P<0.05); 与IL-1β+miR-NC组比较, IL-1β+miR-6779-5p组中IRAK3的表达降低,差异有统计学意义(P<0.05)(图4A)。与control组相比, IL-1β组中软骨细胞活力和EdU阳性率降低,细胞凋亡率增加,差异有统计学意义(P<0.05); 与IL-1β+miR-NC组比较, IL-1β+miR-6779-5p组中软骨细胞活力和EdU阳性率升高,细胞凋亡率降低,差异有统计学意义(P<0.05)(图4B、4C、4D)。然而, IRAK3过表达后减弱了miR-6779-5p对IRAK3表达、细胞活力、细胞增殖以及细胞凋亡的影响,差异有统计学意义(P<0.05)(图4A、4B、4C、4D)。

A: IRAK3表达分析; B、C: miR-6779-5p和IRAK3对细胞增殖的影响(放大400倍); D: miR-6779-5p和IRAK3过表达在IL-1β处理的软骨细胞中对细胞凋亡的影响。与control组比较, ****P<0.000 1; 与IL-1β+miR-NC比较, **P<0.01, ***P<0.001;与IL-1β+miR-6779-5p+IRAK3比较, *P<0.05, **P<0.01。
2.5 miR-6779-5p在IL-1β处理的软骨细胞中通过介导IRAK3调控NF-κB通路
miR-6779-5p模拟物在IL-1β诱导的软骨细胞中减少p-P65和P65比值以及p-IκBα和IκBα的比值,差异有统计学意义(P<0.05), 但是这些影响在IRAK3过表达后缓解,差异有统计学意义(P<0.05)。见图5。
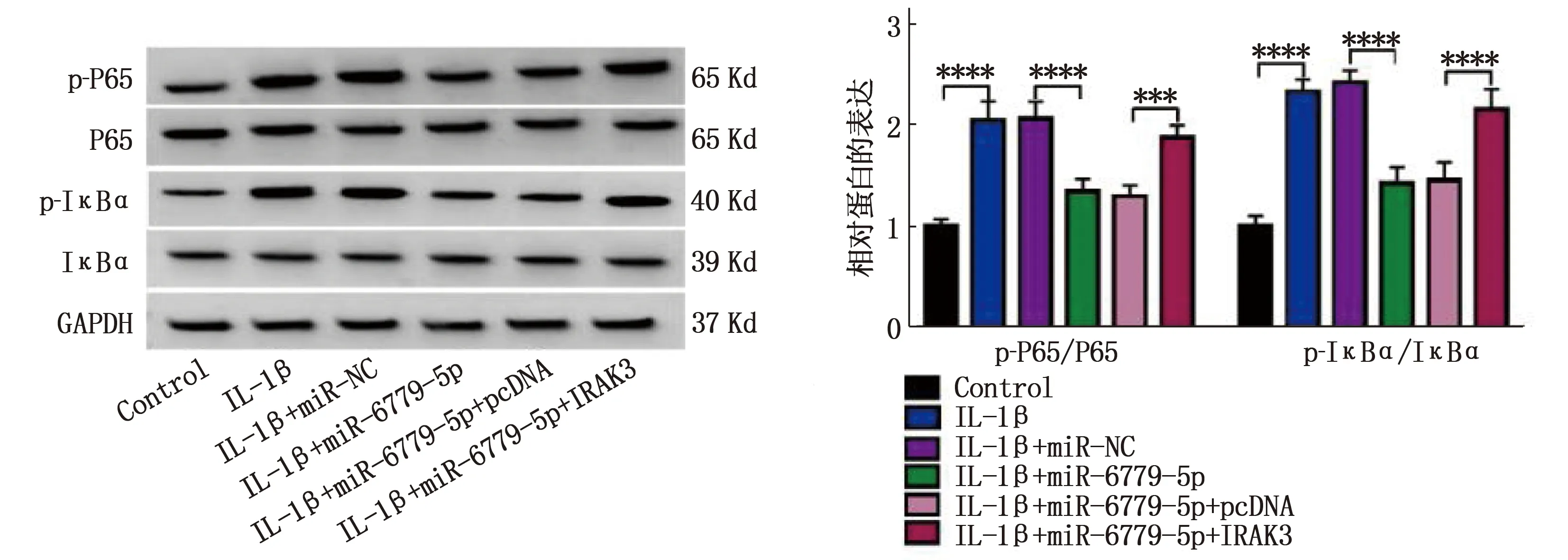
与control组比较, ****P<0.000 1; 与IL-1β+miR-NC比较, ****P<0.000 1;与IL-1β+miR-6779-5p+pcDNA比较, ***P<0.001, ****P<0.000 1。
3 讨 论
miRNAs的特殊基因沉默特性使得这类非编码RNAs参与不同疾病的发展过程[6, 20-21]。骨关节炎发病机制涉及miRNAs, miRNAs的低表达会造成骨骼生长缺陷[22]。这些小RNAs介导软骨细胞凋亡和增殖[23-24]。最近的研究数据[25-26]指出miR-6779-5p与肿瘤恶性有关,但尚无数据报道其是否参与骨关节炎的发生发展。本研究运用GEO数据库筛选发现miR-6779-5p表达在骨关节炎患者中显著降低,并且qRT-PCR分析证实了此结果; 本研究结果还表明miR-6779-5p在IL-1β诱导的软骨细胞中表达下调,且呈剂量依赖性。此外, miR-6779-5p逆转了IL-1β对软骨细胞增殖的抑制作用和对凋亡的促进作用。
miRNAs在转录后水平通过和靶基因结合来介导基因表达,进而调控细胞分化、致癌性转化以及细胞增殖等生物学进程[27]。本研究分析发现miR-6779-5p靶标IRAK3。IRAK3属于IRAK家族成员,该家族蛋白是一类胞浆蛋白,在先天性免疫中具有重要作用[28]。此外,体外的骨关节炎模型[29]揭示IRAK3下调有助于关节软骨损伤的恢复,相关机制涉及miR-33b-3p对IRAK3的靶向调控作用。研究[19]指出IRAK3参与骨关节炎发展,本研究数据表明IRAK3高表达促进骨关节炎软骨细胞损伤,说明IRAK3在骨关节炎关节软骨中表达增加以及IRAK3有助于骨关节炎发展。不同的是,本研究指出IRAK3结合miR-6779-5p调节软骨细胞损伤。研究[28, 30]显示IRAK3过表达减弱了miR-6779-5p对细胞增殖和凋亡的影响。鉴于IRAK3能够通过激活NF-κB通路参与炎症反应,本研究又分析了miR-6779-5p在IL-1β处理的软骨细胞中是否通过介导IRAK3调控NF-κB通路,结果显示miR-6779-5p减少p-P65和P65比值以及p-IκBα和IκBα的比值,但是这些影响在IRAK3过表达后得到缓解,说明了骨关节炎的发病进程可能涉及miR-6779-5p/IRAK3/NF-κB通路调控。
综上所述, miR-6779-5p通过抑制IRAK3/NF-κB通路的激活来挽救IL-1β诱导的软骨细胞损伤,表明miR-6779-5p可能是治疗骨关节炎的潜在靶点。但本研究只利用骨关节炎的细胞模型鉴定miR-6779-5p/IRAK3/NF-κB通路在骨关节炎发展中的作用,后期还应开展相应的动物模型实验来验证此通路在骨关节炎发展中的作用。
