槲皮素通过调控miR-431-5p/鼠双微基因4信号通路抑制类风湿关节炎成纤维样滑膜细胞侵袭和促进凋亡
2023-07-09左淑飞崔玉荣秦艺璐范文强
梁 舒, 左淑飞, 崔玉荣, 秦艺璐, 高 晓, 韩 琛, 范文强
(河南省新乡市中心医院/新乡医学院第四临床学院, 1. 风湿免疫科, 2. 妇科妇瘤二科, 河南 新乡, 453000)
类风湿关节炎(RA)主要损坏关节,女性发生率高于男性[1-3]。RA病理表现通常为免疫细胞浸润、关节软骨和骨破坏,研究[4]表明,基因和环境因素影响RA发生。若治疗不及时, RA患者通常会出现晨僵、关节强直、关节破坏、畸形甚至残疾[5-6]。近些年,药学方面取得的显著进展为治疗RA提供了新方案[7]。槲皮素是一种类黄酮,具有广泛的有益作用和生物活性,研究[8]指出其具有抗高血压、抗炎、抗血管生成、抗衰老和神经保护的潜力。滑膜炎症受槲皮素的调控,其能抑制炎症细胞因子产生和成纤维样滑膜细胞(FLSs)增殖和运动,还能通过减少基质金属蛋白酶的产生来减弱骨损伤,提示槲皮素具有治疗RA的潜力[9]。但目前槲皮素调控RA疾病的机制还不明确,研究[10]指出槲皮素可通过介导微小RNAs(miRNAs)表达来调控RA进程。miRNAs 是一类非编码RNAs,能调控先天免疫及获得性免疫,一些miRNAs在RA患者关节腔室亚细胞群中表达异常,且能通过调控炎性细胞因子产生和滑膜细胞增殖介导RA发展[11-13]。研究[14-15]表明, miR-431-5p具有抑制RA进程的潜力,但未有明确证据表明槲皮素对RA的调控机制涉及miR-431-5p。因此,本研究围绕miR-431-5p是否参与槲皮素对RA的调控展开探讨。
1 材料与方法
1.1 主要试剂和仪器
RNA抽提试剂盒、无RNA酶水、miR-431-5p抑制剂(anti-miR-431-5p)、抑制剂对照(anti-miR-NC)、miR-431-5p模拟物(miR-431-5p)、模拟物对照(miR-NC)、mRNA荧光定量PCR试剂盒、miRNA荧光定量PCR试剂盒、鼠双微基因4(MDM4)过表达载体、pcDNA 3.1(+)载体和反转录试剂盒购自上海吉玛制药技术有限公司; TGem Pro分光光度计、蛋白定量试剂盒、定点突变试剂盒、DAB底物显色试剂盒和组织研磨低温均质仪购自天根生化科技(北京)有限公司; 荧光素酶活性检测试剂盒、基底膜基质、细胞凋亡检测试剂、蛋白提取试剂盒、CCK-8试剂盒、MDM4和GAPDH一抗抗体、甲醛和结晶紫购自北京索莱宝科技有限公司; 酶标仪、显微镜、羊抗兔二抗抗体购自美国Thermo Fisher公司; 槲皮素(货号#Q4951)购自德国Merck公司。
1.2 实验方法
1.2.1 RA滑膜组织收集: 该研究得到本院伦理委员会同意。收集不同年龄阶段在本院接受膝关节镜手术的RA患者(27例,平均46岁)和接受骨折手术的非RA患者(25例,平均45岁)的滑膜组织。所有患者均签署知情同意书,收集的组织及时储存在-80 ℃环境中。
1.2.2 类风湿关节炎成纤维样滑膜细胞(RA-FLSs)分离及培养: 在无菌条件下,将收集的RA滑膜组织和正常滑膜组织用剪刀剪成体积约为1 m3的组织块,放于添加有Ⅰ型胶原蛋白的细胞培养基(DMEM)中,在培养箱中消化2 h。随后将消化的滑膜组织用细胞过滤网过滤去除多余杂质。将过滤的细胞通过离心收集,收集后的细胞移至含有完全培养基的培养皿中,并放置于5%二氧化碳培养箱中培养,每3 d传代1次,2~5代的FLSs用于本实验研究。
1.2.3 RA-FLSs处理与分组: RA-FLSs汇合度在90%~100%时,传代培养于12孔板,细胞铺板密度依据后期处理细胞时间而定,待细胞汇合度达75%左右时,将浓度为10、20、30 μmoL的槲皮素分别加入不同培养孔中,对照孔添加二甲基亚砜,以此分为0 μmoL槲皮素处理、10 μmoL槲皮素处理、20 μmoL槲皮素处理以及30 μmoL槲皮素处理细胞,培养2 h后,收集细胞用于RNA表达分析。RA-FLSs汇合度达75%左右时,转染anti-miR-431-5p、anti-miR-NC、miR-431-5p、miR-NC、MDM4过表达载体和pcDNA(3.1+)载体,转染后48 h,在每孔中添加20 μmoL的槲皮素或者二甲基亚砜(对照),继续培养2 h, 以此分为对照组、槲皮素组、槲皮素+anti-miR-NC组、槲皮素+anti-miR-431-5p组、miR-NC组、miR-431-5p组、miR-431-5p+pcDNA组以及miR-431-5p+MDM4组,收集细胞用于后续实验。
1.2.4 基因表达分析: 利用组织研磨低温均质仪研磨组织样品。采用RNA抽提试剂盒提取研磨后的组织和细胞样品RNA。采用TGem Pro分光光度计定量RNA浓度后,使用mRNA荧光定量PCR试剂盒和miRNA荧光定量PCR试剂盒定量基因表达,利用2-△△Ct法分析定量数据。定量引物序列见表1。

表1 定量引物序列
1.2.5 细胞活力: 将接受转染和槲皮素处理的RA-FLSs接种到96孔板,按照说明书要求将CCK-8试剂加入相应的培养孔中,细胞孵育4 h后,运用酶标仪分析样品。
1.2.6 流式细胞仪实验: 将接受转染和槲皮素处理的RA-FLSs用结合缓冲液重悬,悬浮的细胞样品根据操作手册分别和Annexin V-FITC以及碘化丙啶避光孵育10 min。用流式细胞仪分析细胞样品,以确定细胞凋亡率。
1.2.7 Transwell实验: 将经过转染和槲皮素处理的RA-FLSs接种到提前孵育有基质的培养板上室,该Transwell小室加有不含胎牛血清的培养基,含有15%胎牛血清的培养基加入到相应的Transwell小室下室作为化学引诱物。细胞培养24 h后,将细胞和甲醛以及结晶紫共孵育,最后用显微镜观察下室细胞数量。
1.2.8 荧光素酶活性分析: 为了分析miR-431-5p和MDM4的关系,本研究首先利用Starbase在线数据库预测miR-431-5p是否含有MDM4 3′UTR结合位点。根据预测的结合位点在生物公司构建了 MDM4荧光素酶实验所用的载体(WT-MDM4 3′UTR以及MUT-MDM4 3′UTR)。 其中MUT-MDM4 3′UTR的构建需参照点直接突变试剂盒的说明。将WT-MDM4 3′UTR以及MUT-MDM4 3′UTR和miR-431-5p或miR-NC转染到RA-FLSs中, 48 h后用商业试剂盒检测荧光素酶活性。
1.2.9 MDM4蛋白表达: 用蛋白提取试剂盒提取收集样品蛋白,提取的蛋白用蛋白定量试剂盒分析,根据测定的蛋白浓度,将相应体积的蛋白样品进行二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)。将带有蛋白条带的聚偏氟乙烯膜和MDM4、GAPDH一抗过夜孵育,最终用DAB底物显色试剂盒分析聚偏氟乙烯膜。
1.3 统计学分析
2 结 果
2.1 miR-431-5p在滑膜组织、FLSs以及槲皮素诱导RA-FLSs中的表达
miR-431-5p在RA患者滑膜组织和RA-FLSs中的表达低于正常对照组织和对照细胞,差异有统计学意义(P<0.05), 见图1A、1B。miR-431-5p在不同浓度槲皮素处理的RA-FLSs中,其表达呈剂量依赖性增高,差异有统计学意义(P<0.05), 见图1C。
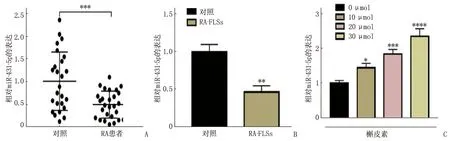
A: miR-431-5p在RA患者滑膜组织和正常滑膜组织中的表达分析,与对照比较, ***P<0.001;B: miR-431-5p在FLSs中的表达分析,与对照比较, **P<0.01; C: miR-431-5p在不同浓度槲皮素处理的
2.2 miR-431-5p和槲皮素对RA-FLSs凋亡、侵袭的影响
转染anti-miR-431-5p后,槲皮素处理对miR-431-5p表达的促进作用得到缓解,差异有统计学意义(P<0.05), 见图2A。与对照组比较,槲皮素组RA-FLSs活力降低,细胞凋亡率增加,侵袭细胞数减少,差异有统计学意义(P<0.05); 与槲皮素+anti-miR-NC组相比,槲皮素+anti-miR-431-5p组的RA-FLSs细胞活力增加,细胞凋亡率降低,侵袭细胞数增加,差异有统计学意义(P<0.05), 见图2B、2C、2D。

A: miR-431-5p表达分析; B: RA-FLSs活力分析; C: RA-FLS凋亡分析; D: 侵袭能力分析(放大倍数为100倍)。
2.3 miR-431-5p在RA-FLSs中结合MDM4
miR-431-5p包含MDM4的结合位点,见图3A。miR-431-5p和WT-MDM4 3′UTR共转染导致了RA-FLSs中荧光素酶活性降低,差异有统计学意义(P<0.05), 但miR-431-5p和MUT-MDM4 3′UTR共转染对RA-FLSs中荧光素酶活性无影响,差异无统计学意义(P>0.05), 见图3B。MDM4在RA滑膜组织中的表达高于对照滑膜组织,差异有统计学意义(P<0.05); 且RA滑膜组织中MDM4的表达与miR-431-5p呈负相关,差异有统计学意义(P<0.05), 见图3C、3D。MDM4在RA-FLSs中的蛋白表达高于正常滑膜组织来源FLSs中的表达,差异有统计学意义(P<0.05), 见图3E。

图3 miR-431-5p在RA-FLSs中结合MDM4
2.4 miR-431-5p通过MDM4调控RA-FLSs的凋亡和侵袭
miR-431-5p组的MDM4蛋白表达低于miR-NC组,差异有统计学意义(P<0.05); miR-431-5p+MDM4组的MDM4蛋白表达高于miR-431-5p+pcDNA组,差异有统计学意义(P<0.05), 见图4A。与miR-NC组比较, miR-431-5p组中RA-FLSs细胞活力降低,细胞凋亡率增加,侵袭细胞数减少,差异有统计学意义(P<0.05); 与miR-431-5p+pcDNA组比较, miR-431-5p+MDM4组中RA-FLSs细胞活力增加,细胞凋亡率降低,侵袭细胞数增加,差异有统计学意义(P<0.05), 见图4B、4C、4D。
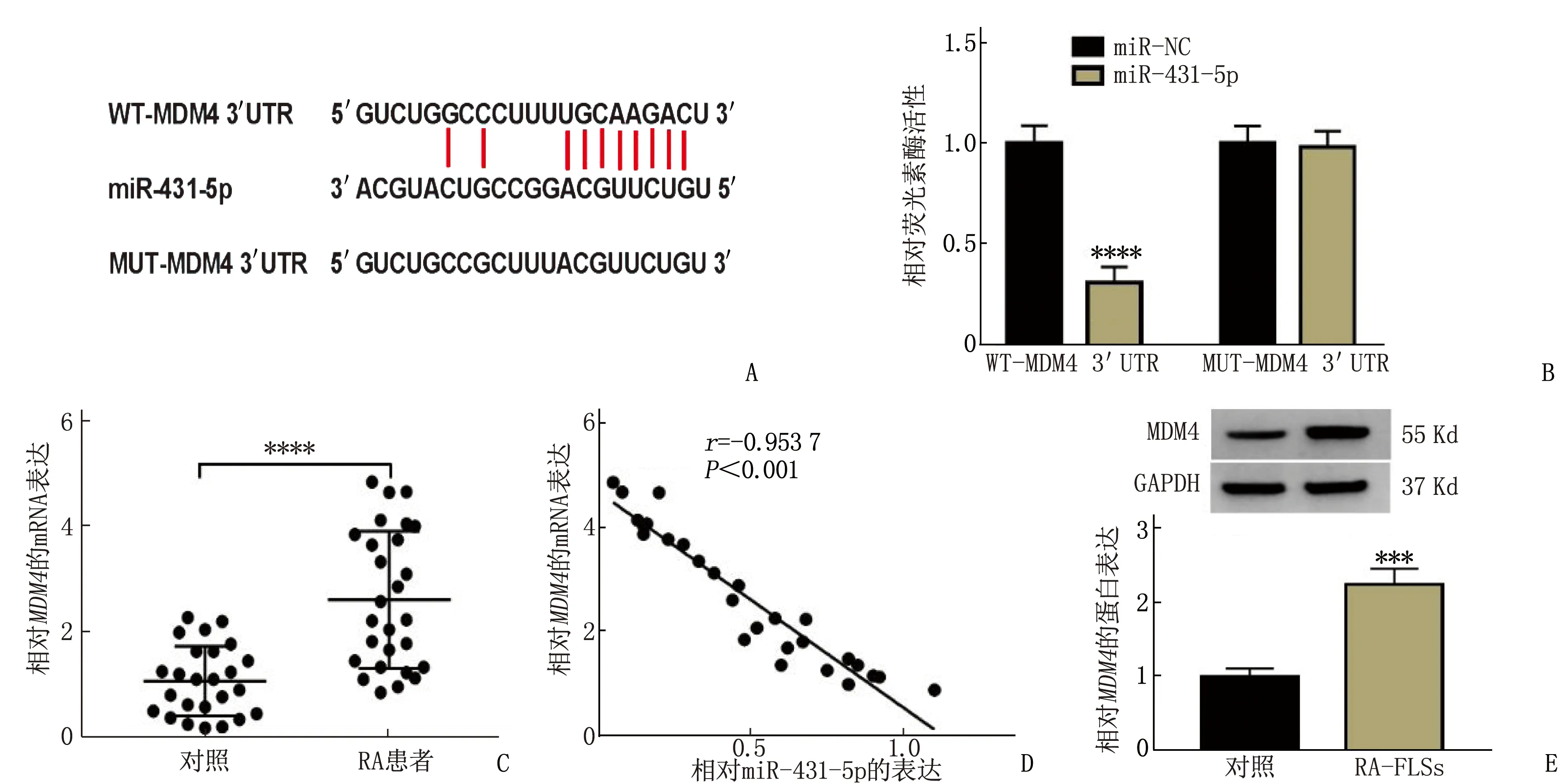
A: miR-431-5p和MDM4结合位点; B: miR-431-5p和MDM4结合关系鉴定; C:MDM4mRNA表达分析;
D: miR-431-5p和MDM4表达相关性分析; E: MDM4蛋白表达检测。
与miR-NC比较, ****P<0.000 1; 与对照比较, ***P<0.001, ****P<0.000 1。
2.5 槲皮素和MDM4对RA-FLSs凋亡和侵袭的影响
槲皮素组的MDM4蛋白表达低于对照组,差异有统计学意义(P<0.05); 槲皮素+MDM4组的MDM4蛋白表达高于槲皮素+pcDNA组,差异有统计学意义(P<0.05), 见图5A。与对照组比较,槲皮素转染组的RA-FLSs活力降低,细胞凋亡率增加,侵袭细胞数减少,差异有统计学意义(P<0.05); 与槲皮素+pcDNA组比较,槲皮素+MDM4组的RA-FLSs细胞活力增加,细胞凋亡率降低,侵袭细胞数增加,差异有统计学意义(P<0.05), 见图5B、5C、5D。

A: MDM4蛋白表达分析; B: RA-FLSs细胞活力检测; C: RA-FLSs凋亡率检测; D: RA-FLSs侵袭数检测(放大倍数为100倍)。
3 讨 论
槲皮素在蔬菜和水果中广泛表达,对关节和关节外表现均有影响,能够抑制氧化应激、促进RA-FLSs凋亡、降低自身抗体水平以及减弱肠神经系统的神经退行性过程[9]。在机制研究方面,相关学者[10, 16-19]已指出,槲皮素能通过抑制中性粒细胞炎症活动、减少腺甙脱氨酶产生来调控miR-26b、miR-20a、miR-146a和miR-485的表达,限制RA进程。槲皮素通过介导miR-431-5p表达来调控RA中FLSs表型变化。本研究结果表明,在槲皮素处理的RA-FLSs中miR-431-5p表达上调,但miR-431-5p在RA滑膜组织和RA-FLSs中表达下调,这些结果和WANG Y J等[14]的研究一致。此外,本研究发现,在anti-miR-431-5p转染后,槲皮素处理导致的RA-FLSs凋亡促进和侵袭抑制得到缓解,说明槲皮素能通过上调miR-431-5p表达来调控RA-FLSs凋亡和侵袭。
研究[20]指出, p53在类风湿关节炎滑膜成纤维细胞中低表达,且能调控此类细胞侵袭进程。内源性抑制剂能诱导p53的磷酸化, MDMx蛋白家族成员是一种p53调控蛋白,其中成员MDM4是p53的磷酸化内源性抑制剂之一。研究[21]指出,该蛋白通过结合p53反式激活区域来影响其转录功能。研究[22]表明,芍药苷抑制RA-FLSs增殖、运动和炎症, MDM4过表达能够减弱芍药苷对RA-FLSs的影响。miR-34a-3p表达上调抑制FLSs增殖,其可通过结合MDM4 3′非编码区的547~554位点来调控细胞增殖。本研究证实,MDM4是miR-431-5p的一个靶基因,MDM4在RA患者滑膜组织和RA-FLSs中表达显著上调,且与miR-431-5p表达呈负相关。此外, MDM4过表达减弱了槲皮素或miR-431-5p对RA-FLSs侵袭和凋亡的调控作用[23]。
综上所述,槲皮素可通过调控miR-431-5p/MDM4通路来抑制RA-FLSs侵袭和促进细胞凋亡。槲皮素可能是治疗RA的替代药物,开发miR-431-5p药物制剂可能对限制RA发展具有帮助。但本研究仅收集了27例RA患者滑膜组织和25例对照滑膜组织,样品量较少,后期研究应扩大样品量; 此外,还需采用鼠模型实验,以鉴定槲皮素是否通过调控miR-431-5p/MDM4通路抑制RA进展。
