绵羊大肠杆菌和艾美尔球虫混合感染病原分离与病理组织学观察
2023-07-05王景松郭亚男王健霖王建东张正刚刘红燕李继东
王景松,郭亚男,王健霖,王建东,张正刚,刘红燕,李继东
(1.宁夏大学农学院,银川 750021;2.宁夏农林科学院动物科学研究所,银川 750002)
【研究意义】羊腹泻是羊场常见疾病之一,该病多发生于新生羔羊,以粪便性状改变、脱水为主要临床特征[1]。引起羊腹泻的病原种类较多且复杂,主要包括细菌、病毒、寄生虫等,如:大肠埃希菌(Escherichiacoli)、产气荚膜梭菌(Clostridiumperfringens)、沙门氏菌(Salmonella)、轮状病毒(Rotavirus)、艾美尔球虫(Eimeria)和隐孢子虫(Cryptosporidium)等[2-7]。不同的病原体其所造成的临床症状和病理变化较为相似[8],因此给临床用药带来困难。羔羊腹泻全年都可发病,在冬春季多发[9],严重危害畜牧业的发展。【前人研究进展】羊大肠杆菌病是由致病性大肠埃希氏菌引起的急性传染病,以严重腹泻、败血症及生长发育受阻为特征,严重时可引起死亡,分为败血症型和肠炎型两种[10]。该病主要通过消化道传播成为羊养殖业危害最大的疾病之一[11]。羊球虫病是由艾美尔球虫属球虫引起的一种羊消化道疾病,以羊只下痢,渐进性消瘦、贫血、发育不良,甚至死亡为临床症状[12]。羊球虫病在世界范围内广泛分布,现已报道公认的绵羊球虫有类绵羊艾美尔球虫(E.ovinoidalis)、槌形艾美尔球虫(E.crandallis)和阿撒地艾美尔球虫(E.ahsata)等14种;山羊球虫有妮氏艾美尔球虫(E.ninakohlyakimovae)、阿氏艾美尔球虫(E.arloingi)、柯察艾美尔球虫(E.kocharli)和家山羊艾美尔球虫(E.hirci)等13种[13-14]。大肠杆菌和球虫对山羊和绵羊均易造成感染,对6周龄以下的羔羊危害更大,感染率和死亡率高[12,15]。由于新生羔羊的体液调节和神经调节功能不完善,抵抗力差,胃肠道内环境紊乱,大肠杆菌和球虫极易侵入机体,进而引起羔羊腹泻等一系列症状[16]。【本研究切入点】宁夏回族自治区2021年羊存栏量6.77×106只,出栏量6.46×106只,羊产业已成为宁夏畜牧业发展的重点和农民增收致富的重要途径。但羊腹泻病一直是制约养殖业发展的主要因素之一,而大肠杆菌性腹泻和艾美尔球虫性腹泻目前是养殖场常发病。【拟解决的关键问题】本研究通过对绵羊大肠杆菌和艾美尔球虫混合感染的病原体开展病原分离鉴定以及病理组织学变化研究,旨在为该疾病的诊断和采取有效的防控措施提供科学基础。
1 材料与方法
1.1 材料
1.1.1 病料 2021年6月宁夏某规模化绵羊场从某地购买24只6~8月龄杜泊羊。饲养3 d后出现群发性腹泻,第2日死亡1只,后又相继死亡2只,共死亡3只,其它羊只被毛粗乱无光泽,采食量下降,消瘦,精神沉郁,体温略高,粪便呈粥样且恶臭。
剖检的病羊肠壁水肿、增厚,褶皱增多,肠道溃疡,有出血点,肠系膜淋巴结肿大坏死(图1-A);肠粘膜脱落,肠绒毛消失,粪便稀薄(图1-B)。为确诊病因,采集3只病死羊的脾脏、肠系膜淋巴结、空肠、回肠、结肠和盲肠组织进行病原学诊断及病理组织学观察。
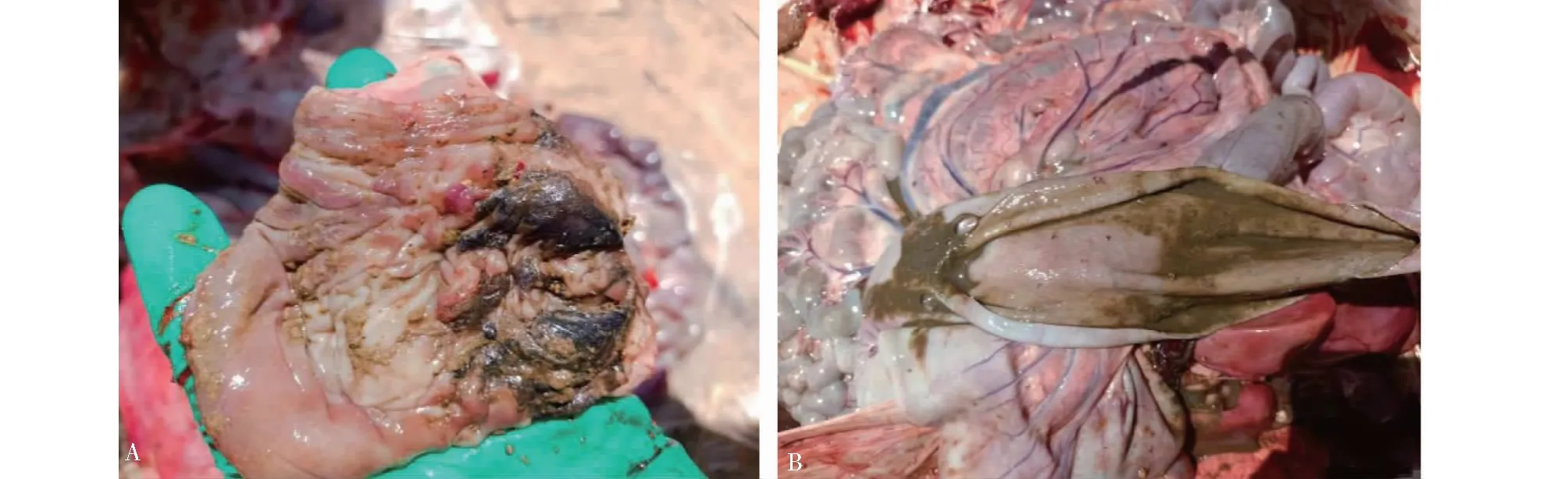
图1 病羊剖检肠道病理变化
1.1.2 主要试剂 细菌基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;DNA胶回收试剂盒,购自OMEGA公司;2 ×TaqMarker Mix和DL-2000 Marker,购自宝生物工程(大连)有限公司;脱纤维羊血,购自Hyclcome有限公司;LB液体培养基,购自上海中科生物技术开发有限公司;伊红美蓝琼脂,购自青岛高科园海博生物技术有限公司;产气荚膜梭菌鉴别培养基,购自CHROMagar公司。
1.1.3 引物设计与合成 根据GenBank中登录的大肠杆菌基因全序列,参考李仕林[17]的方法合成16S rRNA通用引物(表1),引物由生工生物工程(上海)股份有限公司合成。

表1 扩增E.coli 16S rRNA基因片段的引物序列信息
1.2 方法
1.2.1 病原的分离 将无菌采集的3只病死杜泊羊的脾脏和肠系膜淋巴结表面火焰灭菌,剪取一定量的深部组织,在无菌操作条件下接种至伊红美蓝琼脂、血平板和产气荚膜梭菌鉴别培养基中,每份病料样品各接种2份。37 ℃恒温箱中倒置培养 24 h后,观察菌落生长状况、菌体形态及其是否有杂菌,挑取单个菌落进行革兰氏染色并镜检。使用一次性接种环,挑取可疑单一菌落,在新的平板上采用三字划线法涂板,倒置于 37 ℃ 恒温培养箱中培养 24 h,待新平板上长出新菌落,再次挑取单一菌落至LB液体培养基中扩增,进行革兰氏染色,在显微镜下观察其形态。
根据麦克马斯特法计算每克粪便中的卵囊数(Oocysts per gram of feces, OPG):取粪便2 g,放入烧杯中,先加水5 mL,搅拌混匀后,加饱和盐水至60 mL,混匀后用铜筛网过滤,吸取滤液,注入麦克马斯特计数板的计数室内,静置5 min后,在显微镜下计数两个刻度室中的卵囊数。两个计数室的虫卵数的平均值乘以200,即为每克粪便中的虫卵或卵囊数:
OPG=(n1+n2)/2/0.15×60/2 =A×200
(1)
式中,(n1+n2)/2为平均每个计数室内卵囊数A,2表示所用粪便克数为2 g,0.15表示每个计数室有效体积为0.15 mL,60表示粪液总体积为60 mL[18]。
1.2.2 16S rRNA基因序列扩增与测序 取培养物2 mL,12 000 r/min 离心10 min,然后使用细菌基因组 DNA 提取试剂盒对沉淀物进行基因组 DNA 的提取。使用上述的大肠杆菌16S rRNA引物扩增大肠杆菌纯培养物 16S rRNA 基因序列,预计扩增片段大小分别为 1465 bp。
50 μL PCR反应体系:模板2 μL,27F、1492R各1 μL(20 μmol/L),2×TaqPCR Mix 25 μL,ddH2O 21 μL;16S rRNA PCR反应条件为:95 ℃预变性5 min,94 ℃变性50 s,57 ℃退火1 min,72 ℃延伸90 s,30个循环,72 ℃终延伸10 min,4 ℃结束反应。
PCR 产物经 1.0%的琼脂糖凝胶电泳分析后,用凝胶回收试剂盒纯化回收PCR产物,将PCR纯化产物送上海生工生物工程技术服务有限公司测序。
1.2.3 病原菌同源性比较与遗传进化分析 使用 DNA Star 软件将分离菌株测序结果与 GenBank 中的标准株序列进行同源性比较,采用 MEGA 7.0软件中的邻接法(Neighbor-joining,NJ)依据 16S rRNA 序列构建分离株系统发育树,并进行遗传进化分析。
1.2.4 病理组织学观察 将无菌采集肠系膜淋巴结、空肠、回肠、结肠和盲肠的组织浸泡于100 mL/L的福尔马林溶液,固定7 d后,固定组织经全自动脱水机脱水,石蜡包埋组织,并对其进行切片, H.E.染色。染色结束后采用3DHISTECH(Hungary)生产的Pannoramic 250数字切片扫描仪对切片进行图像采集,并观察具体病变。
2 结果与分析
2.1 菌落形态
平板于37 ℃恒温培养箱中倒置培养24 h后,可观察到伊红美蓝琼脂上形成有金属光泽的黑色单一菌落(图2);血平板上有中等大小、具有溶血圆的灰色圆形单一菌落(图3);产气荚膜梭菌鉴别培养基中无菌落生长。挑取伊红美蓝平板和血平板上的单一菌落进行革兰氏染色,光学显微镜下观察可见两端钝圆的红色革兰氏阴性短杆菌(图4)。
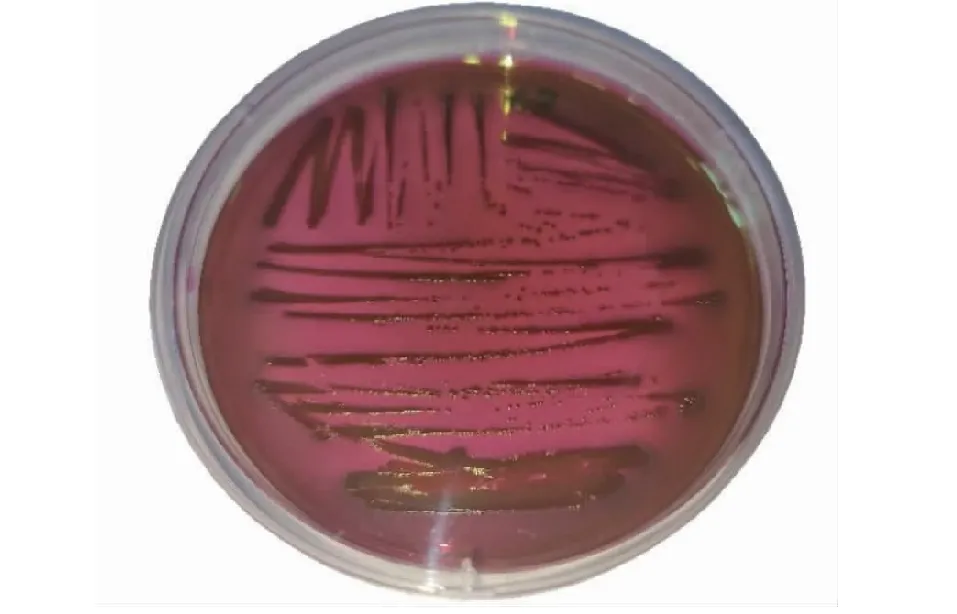
图2 大肠杆菌分离株在伊红美蓝培养基上的形态

图3 大肠杆菌分离株在血平板上的形态
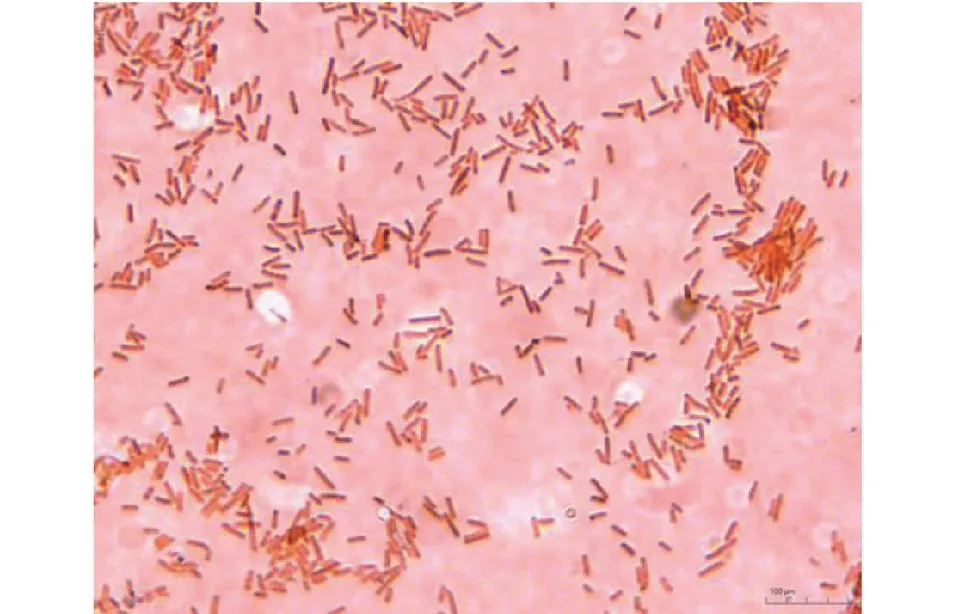
图4 两端钝圆阴性短杆菌(1000×)
2.2 粪便虫卵数量及形态特征
粪便采用麦克马斯特法进行寄生虫卵检测发现,粪便中仅见艾美尔球虫卵,平均OPG为2200。孢子化后镜检可见艾美尔球虫卵囊呈黄棕色,卵圆形,大小为28.14 μm × 19.65 μm,卵囊壁两层,表面光滑,有极帽,内有4个孢子囊,与卵囊壁界限明显(图5),符合阿撒他艾美尔球虫(E.ahsata)卵囊的形态特征。

图5 孢子化的艾美球虫卵囊(400×)
2.3 病原菌同源性比较及遗传进化分析
对分离得到的3株菌株病原菌16S rRNA扩增产物进行分析发现,16S rRNA扩增片段的序列大小约为1465 bp(图6)。经测序,16S rRNA序列大小为1465 bp;16S rRNA序列同源性比较结果显示,NXWZ001、NXWZ002和NXWZ003与GenBank中的大肠杆菌标准菌株ATCC 44102、U 5/41、NBRC 102203同源性最高。构建的系统发育树结果表明,NXWZ001、NXWZ002和NXWZ003与已报道的大肠杆菌ATCC 44102、U 5/41、NBRC 102203株遗传距离最近,支持率高达98%(图7)。
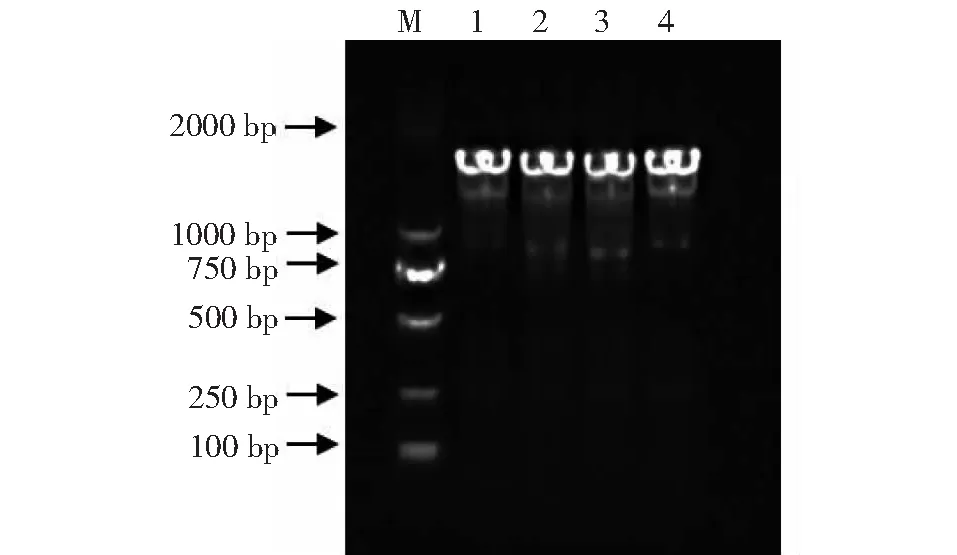
M. DNA 标准 DL 2000;1. 阳性对照;2~4. 扩增产物。

M.DNA标准DL 2000;1.阳性对照;2~4.扩增产物。
2.4 病理组织学变化
肠系膜淋巴结皮质内和副皮质区内淋巴小结结构模糊,淋巴细胞数量显著减少,细胞排列疏松,较多中性粒细胞浸润,血管扩张淤血(图8)。回肠黏膜层绒毛坏死,黏膜上皮结构丢失,固有层溶解内见嗜酸性圆形体,为球虫裂殖体,腺上皮细胞间质少量中性粒细胞浸润、胞质内见球虫(图9)。空肠黏膜层绒毛坏死,黏膜上皮结构丢失,固有层溶解,间质少量中性粒细胞浸润,腺腔内可见球虫裂殖体,呈镰刀状(图10)。结肠黏膜层完全溶解,仅剩细胞轮廓,局部区域黏膜层缺失,类似溃疡灶,可见多量弱嗜碱性短杆状物质沉积,为细菌菌体(图11)。盲肠黏膜层不同程度溶解,细胞结构模糊,血管充血、溶血,并有少量中性粒细胞浸润(图12)。

图8 肠系膜淋巴结病理组织切片(H.E.,400×)

图9 回肠病理组织切片(H.E.,400×)

图10 空肠病理组织切片(H.E.,400×)

图11 结肠病理组织切片(H.E.,400×)

图12 盲肠病理组织切片(H.E.,400×)
3 讨 论
羊腹泻的病因复杂多样,主要有细菌性、病毒性、寄生虫性、应激性、气候因素、饲养管理因素等[19]。绵羊大肠杆菌是γ-变形菌纲、肠杆菌目、肠杆菌科、埃希氏菌属的一员,属于革兰氏阴性短杆菌,两端圆形,大多数有荚膜和鞭毛,能运动,无芽孢,兼性厌氧生长。患病羊主要临床症状以精神沉郁、腹泻、食欲减退为主,严重时可引起死亡[20]。1952年我国首次在新疆和内蒙古地区发现那波里大肠杆菌病[21]。艾美尔球虫属于艾美耳科、艾美耳属的一种原虫,羔羊和成年羊都能够感染,但对羔羊危害较大,感染后主要是发生下痢、发育不良、体型渐进性消瘦、贫血等,严重时发生死亡[13]。
本研究在腹泻绵羊组织和小肠内容物病料样本的病原分离过程中,发现伊红美蓝琼脂上的形态为紫黑色、表面湿润、边缘带有金属光泽的圆形菌落;在血平板上的形态呈中等大小、灰白色、不透明的圆形菌落;挑取单菌落,革兰氏染色阴性,镜检呈散在存在、两端钝圆、红色短杆菌,与Shabana等[22]报道的大肠杆菌菌落形态一致。在16S rRNA基因序列PCR扩增、测序、同源性比较与遗传进化分析中,PCR扩增片段大约为1465 bp,通过琼脂糖凝胶电泳结果分析片段大小与阳性对照一致,测序结果在NCBI中BLAST进行序列同源性比较显示分离得到的3株菌株与大肠杆菌同源性支持率高达98%。因此,通过分离菌株的菌落形态、革兰氏染色镜检结果、生物学特性分析、16S rRNA引物扩增产物的测序结果,证实得到的细菌为大肠杆菌。
应用麦克马斯特法进行小肠内容物和腹泻粪便中寄生虫检测,通过显微镜检测到黄棕色、卵圆形、卵囊壁两层、表面光滑、有极帽,可观察到4个孢子囊,且与卵囊壁界限明显的球虫卵囊,依据卵囊颜色、大小和形态特征等可判断为阿撒他艾美尔球虫[15],与夏晨阳等[23]对羔羊粪便中球虫卵的检测形态特征一致。根据OPG<1.0×104为轻度感染,OPG 1.0×104~1.0×105为中度感染,OPG≥1.0×105为严重感染的判断标准[24],王利明等[25]对新疆车库县绵羊球虫感染情况研究表明,羊球虫OPG为20~258 600;轻度感染羊占25.7%,中度感染羊占65.7%,重度感染羊占8.6%,中重度感染羊占总羊只74.3%,但各羊只均没有明显的腹泻症状。本研究羊群艾美尔球虫的平均OPG为2200,属于轻度感染。
国内对绵羊大肠杆菌和艾美尔球虫混合感染对肠组织的病理组织变化暂为空白,因此本研究不仅为该疾病的诊断和有效防控提供一定的科学依据,同时也填补了其中的一些空白。在病理组织学观察中发现,大肠杆菌和球虫混合感染对羊肠组织有不同程度的损伤,其中以肠系膜淋巴结、回肠、空肠、结肠和盲肠等组织充血、淤血以及肠粘膜溶解脱落等明显特征。淋巴结是重要的免疫器官,在识别和清除体内的抗原性异物中具有重要作用[26]。本病例的肠系膜淋巴结肿大坏死,淋巴小结结构模糊,淋巴细胞减少,血管扩张淤血,并且有中性粒细胞浸润,表明病羊免疫功能下降,机体易受到其他病原的侵害。在回肠和空肠病理组织切片中可见大量镰刀状的球虫裂殖体,表明了球虫侵入绵羊肠道后主要在回肠和空肠的黏膜层进行裂体生殖并对肠道造成损伤;在结肠病理组织切片中有大量细菌菌体沉积物,并出现溃疡灶,表明大肠杆菌黏附在黏膜表面进行繁殖,并产生大量毒素使肠粘膜出现溃疡灶。闫志强等[27]在球虫感染对鸡盲肠组织病理学的影响中发现,分别使鸡口服3×104、2×104和1×104个孢子化球虫卵囊,结果显示均可造成盲肠黏膜层充血,大量炎性细胞浸润,并在腺上皮细胞内见大量虫体,与本研究观察到的结果相似。由此可见病羊的消化系统遭到大肠杆菌毒素和艾美尔球虫的损坏,因此引起绵羊腹泻。
4 结 论
通过剖检观察、细菌病原分离、寄生虫检测、16S rRNA PCR的分子生物学试验,构建系统发育树及其病理组织学观察等一系列鉴定方法,证明宁夏某规模化绵羊场引起绵羊羔羊腹泻的病因为大肠杆菌和球虫混合感染。经分析,该病发生由饲养环境变化、长途运输及饲料突变等因素造成羊只应激,抵抗力下降,肠道菌群紊乱,最终导致绵羊群体发病。
