外来植物刺萼龙葵对土壤细菌群落结构和功能的影响
2023-07-05寇紫倩刘煜光彭伟秀史宝胜
寇紫倩,刘煜光,彭伟秀,史宝胜
(河北农业大学园林与旅游学院,河北 保定 071000)
【研究意义】外来植物入侵由于对本土生物多样性、生态系统功能和入侵土地稳定性产生巨大威胁而备受世界各国重视[1-3]。我国多次开展外来入侵植物调查,刺萼龙葵(Solanumrostratum)被确定为25种A级风险植物之一[4]。它起源于北美洲,1981 年首次在我国被发现,目前已在吉林、山西、河北等地被广泛报道[5]。刺萼龙葵具有较强的繁殖力,在田间常与农作物争夺养分和生长空间,造成经济损失[6],并且刺萼龙葵通体具刺且有毒[7],牲畜误食后可引起中毒,甚至死亡[8],被列为《国家重点管理外来入侵物种名录(第一批)》中的重点防治物种[9]。【前人研究进展】很多国内外学者对刺萼龙葵的入侵扩散机制进行了探讨,包括遗传特性、生殖、扩散途径、化感等方面的研究[10-13];也有一些生态分布、土壤特性方面的调查,据报道,刺萼龙葵主要分布在荒地(坡)、路边、林地、过度放牧的草地、田间的地头等长期缺乏人工管理的地块中[14]。外来植物入侵后土壤微生物群落、土壤理化性质必然会发生一系列改变[15],尤其是土壤微生物群落结构,被认为土壤生态系统的预警指标,对维持植物生长起着重要作用[16]。目前关于刺萼龙葵引起土壤微生物群落结构变化的研究较少,且报道不一。如曲波等[17]发现刺萼龙葵入侵并没有使土壤可培养真菌多样性产生明显变化,从建民等[5]利用平板培养法测定了刺萼龙葵根际土中的细菌、放线菌和霉菌的菌落数,发现菌落数随光照和人流量的增加而增加,而王慧敏[18]发现刺萼龙葵根际土壤细菌如放线菌、亚硝化单胞菌多样性和相对丰度降低。【本研究切入点】目前,国内外对刺萼龙葵入侵地土壤微生物的研究或过于片面,或对其进行人工干预,尚未有对自然条件下刺萼龙葵入侵地的土壤微生物进行研究,因此,本文对未经人工干扰的刺萼龙葵入侵地的土壤微生物进行研究,揭示刺萼龙葵入侵对土壤微生物的影响。在对河北省外来入侵植物的调查中,发现刺萼龙葵在张家口宣化区的种群数量较大,扩散迅速,严重威胁其他植物多样性,危害当地生态环境。尤其在没有经过人工耕作扰动的荒地、荒滩等废弃地生长旺盛,属于刺萼龙葵自然生长地,也是调查刺萼龙葵对自然生态影响的典型样地。【拟解决的关键问题】本研究对外来植物刺萼龙葵生长严重的荒地,分析刺萼龙葵根际土、根围土以及对照土壤的理化性质、土壤微生物代谢活性和微生物群落结构,为阐明其入侵、扩散机制,以及绿色防控提供理论依据。
1 材料与方法
1.1 调查区域
调查区位于河北省张家口宣化区(40°41′55″~40°41′58″ N,114°46′55″~114°47′01″ E),半干旱大陆性季风气候,海拔591~600 m,降水多集中于夏季,年降水量300~400 mm,向阳坡,坡度35~37.8°,沙质土壤,土著植物种类主要为碱蓬草(Suaedaglauca,34%)、虎尾草(Chlorisvirgata,21%)、狗尾草(Setariaviridis,20%)、茵陈蒿(Artemisiacapillaris,5%)等,入侵样地中主要植物种类为碱蓬草(Suaedaglauca,1%)、虎尾草(Chlorisvirgata,2%)、狗尾草(Setariaviridis,13%)、茵陈蒿(Artemisiacapillaris,2%),所有样地均为自然样地,不受人为干扰。
1.2 土壤样品采集与处理
2020年7月初,在河北省张家口宣化区刺萼龙葵严重入侵区域(自然荒地),随机选择5 m×5 m的刺萼龙葵盖度在40%~60%的入侵样地(植被除了刺萼龙葵外,还有土著植物狗尾草、茵陈蒿等)以及只生长土著植物的对照样地,两种样地各重复3个,所有样地间距至少10 m,并保证坡向、坡度、光照和基质基本一致。每个样地挖10株刺萼龙葵,使用无菌刷子从根部收集残留土壤[19],标为根际土(GJ);距离刺萼龙葵10~20 cm按照梅花五点取样法进行土钻取样(土钻直径3 cm)[20],标为根围土(GW);对照样地在土壤裸露区土钻取样,标为对照土(CK);将每个样地的根际土、根围土以及对照样地的土壤分别单独混和。之后,将混合土样分为三部分,一部分(10 g 通过2 mm孔径的筛子)装在单独的无菌离心管中,-80 ℃保存,用于微生物多样性分析;一部分(100 g)装在单独的无菌塑料袋中,并立即保存在4 ℃冰箱,用于微生物代谢分析;一部分(200 g)土壤样品在室温下风干,通过尼龙网(孔径为0.25 mm)过筛,并用于土壤的理化性质。
1.3 土壤理化性质测定

1.4 土壤细菌代谢活性和功能多样性分析
采用Biolog-ECO微平板法:在室温下称取10 g新鲜土壤放入120 mL锥形瓶中,加入90 mL 0.85%无菌的NaCl溶液,摇床震荡30 min(200 r/min),静置15 min。用NaCl溶液对悬浮液进行稀释1000倍,将上清液接种到Biolog®生态板(150 μL/孔,Biolog公司, USA),25 ℃恒温培养168 h,每次间隔24 h用Synerqy仪器(Gene company limited,USA)在590 nm波长下测定各孔的吸光度值。根据Dobranic and Zak将碳源分为6类:胺类、氨基酸类、碳水化合物类、羧酸类、聚合物类和酚酸类[24]。
1.5 土壤细菌群落组成及结构多样性分析
采用利用试剂盒(Omega Bio-tek, Norcross, GA, U.S.)提取土壤细菌总DNA,利用细菌通用引物338F (5’-ACTCCTACGGGAGGCAGCAG-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3~V4 可变区进行PCR扩增[25],每个样本重复3次,共计9个样本。高通量测序送至上海美吉生物医药科技有限公司,利用Miseq PE300测序仪(Illumina Inc, San Diego, CA, USA)完成。
1.6 数据处理与统计分析
1.6.1 土壤Biolog-ECO微平板数据分析 平均颜色变化率(Average well color development,AWCD)是指微平板孔的平均颜色变化率,代表土壤微生物的整体代谢活性:
(1)
Shannon 指数(H′) 是表征微生物多样性的常用指标:
(2)
H′=-Σqilnqi[S=(Ai-A0)>0.25]
(3)
式中:Ai为所测定的31个碳源孔的吸光值;A0为对照孔的吸光值。
1.6.2 土壤高通量测序数据分析 原始测序序列用fastp[26]软件对进行质控,使用FLASH[27]软件进行拼接。使用UPARSE[28]软件对序列进行OTU聚类并剔除嵌合体[28-29]。利用RDP classifier[30]对每条序列进行物种分类注释,比对Silva 16S rRNA数据库(v138),设置比对阈值为70%。
利用Uparse7.0.1090版本对OTU聚类,并且使用Usearch7.0版本进行OTU统计,利用Mothur软件计算Alppha多样性指数(Shannon、 Chao)和相对丰度;利用R语言工具制群落Bar图、PCoA(Principal co-ordinates analysis)和相关性Heatmap;利用LEfSe(LDA effect size), 在门到属水平上,阐释引起微生物群落结构组间差异的主要贡献类群;利用PICRUSt方法将现有的16S rRNA基因测序数据与KEGG数据库对比, 比较功能基因在代谢通路上的丰度差异。
1.6.3 统计分析 利用SPSS 20.0对土壤理化性质和Biolog®生态板中31种碳源的利用率进行组间差异性检验和单因素方差(One-way ANOVA)分析。
2 结果与分析
2.1 刺萼龙葵对土壤理化性质的影响

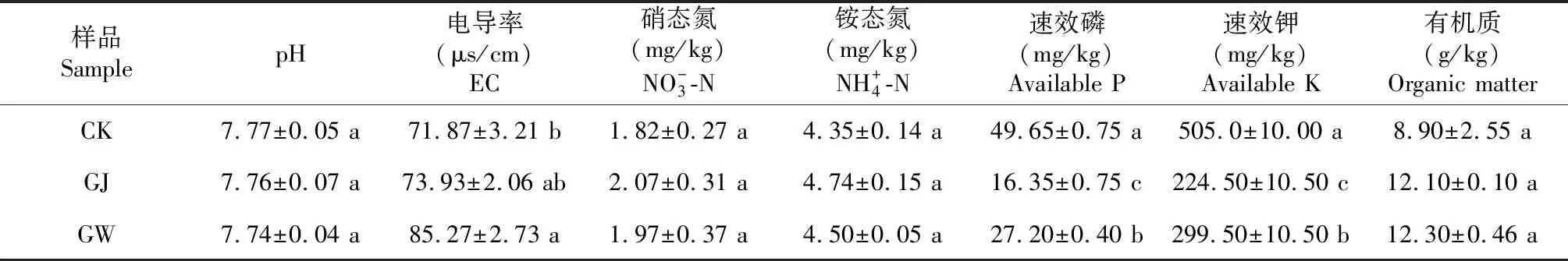
表1 刺萼龙葵覆盖地与对照土壤的理化性质
2.2 刺萼龙葵对土壤微生物代谢活性和功能的影响
Biolog方法通过测定微生物对31种碳源的利用情况,得到微生物群落代谢特征,该方法灵敏度高,分辨力强,被广泛应用于土壤微生物群落研究中。本研究通过AWCD指数发现,覆盖地的土壤微生物代谢活性高于对照样地 (图1-A),其中根际部位的微生物代谢活性最强,根围次之,说明根际微生物的代谢活性与刺萼龙葵的定植生长密切相关,根际微生物对底物的代谢越强,表明其吸收利用土壤中养分的能力也越强。同时Shannon指数分析(图1-B)表明覆盖地细菌的底物代谢多样性升高,且表现为GJ>GW>CK,对6类碳源的利用情况也证实这一点(图1-C),根际和根围土壤微生物对6类碳源均有不同程度利用,总体利用率远远高于CK,而对照缺少对酚醛类碳源的利用,可见刺萼龙葵根际微生物能利用土壤中更多种类的物质,为促进刺萼龙葵营养生长提供了极大可能;同时也暗示了刺萼龙葵的定殖生长导致根际与根围的土壤微生物群落与对照产生了差异。
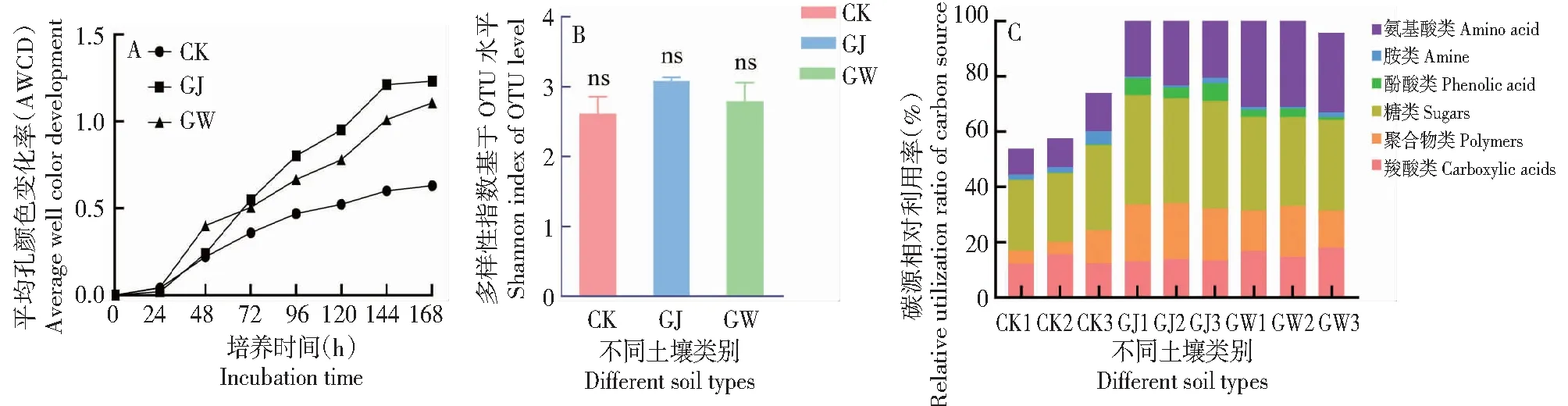
图1 刺萼龙葵对土壤细菌代谢活性的影响
2.3 刺萼龙葵对土壤细菌群落组成和结构的影响
在细菌分类水平上对各样品中细菌群落组成和结构变化进行比较(图2)。刺萼龙葵GJ、GW的细菌组成有36门680属,对照39门823属,差异门类所占比例不到1%,在门水平上,3个样本间的优势细菌菌群结构无显著差异(图 2-A),其中放线菌门(Actinobacteriota)在3个样本中占据了较高比例,为26.8%~34.6%,其次为变形菌门(Proteobacteria,17.7%~23.7%)、绿弯菌门(Chloroflex,13.3%~16.5%)、酸杆菌门(Acidobacteriota,6.5%~17.0%)。但不同土壤样品在属水平上的细菌菌群丰度差异明显,与CK样地相比,有的菌群在GJ样地中丰度提高,有的菌群丰度降低;如鞘脂菌属(Sphingobium)丰度为0.316%,而CK样地为0.004%,相对丰度提高79 倍。芽球菌属(Blastococcus)的丰度为1.3%,而CK样地为0.8%,相对丰度提高1.7倍;节杆菌属(Arthrobacter,4.3%)和芽孢杆菌属(Bacillus,2.2%)分别提高1.5和1.4倍。而o_Rokubacteriales(0.6%)的相对丰度降低3.3倍,芽单胞菌科(Gemmatimonadaceae,5%)的相对丰度降低1.3倍。
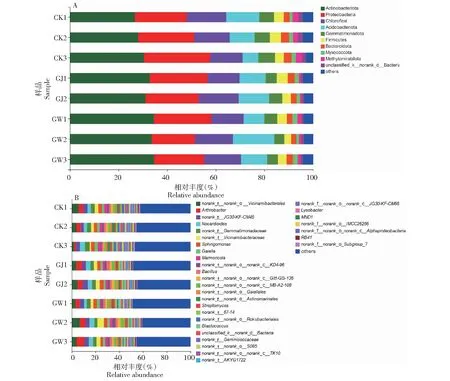
图2 土壤细菌门和属水平上的群落组成
基于OTU的分类水平对刺萼龙葵GJ、GW与对照土壤中的土壤微生物群落alpha多样性指数进行分析,结果表明,与对照样地相比,GJ与GW的Shannon指数(P<0.05,图 3-A)下降,Chao指数(图3-B)略有升高,说明GJ和GW土壤微生物物种多样性显著降低,但其物种相对丰度提高。基于unweighted unifrac 距离的主坐标分析(PCoA,图 3-C)发现,刺萼龙葵入侵地GJ、GW与未入侵样地CK之间没有重叠部分,样本点距离较远,表明GJ、GW细菌群落组成结构与CK差异较大,RDA结果显示,速效磷和速效钾是影响微生物群落结构的主要驱动因子(图 3-D)。为确定组间的显著性差异物种,本研究进一步使用LEfSe分析(阈值>3),由图4-A可知,CK样地的差异指示种为p_Methylomirabilota、暖绳菌目(Caldilineale)、o_IMCC26256、o_Rokubacteriales、f_WX65和 g_norank_f_Geminicoccaceae;GJ土壤中差异指示种为鞘脂菌属、红细菌属(Rhodobacter);GW土壤中差异指示种为:o_Frankiales、o_Microtrichales、地嗜皮菌科(Geodermatophilaceae)、微枝形杆菌属 (Microvirga)、芽球菌属。以上物种均对刺萼龙葵入侵土壤和未入侵土壤之间群落结构组成的差异起到重要影响。另外,组间显著性差异检验结果中(图 4-B),刺萼龙葵的生长显著提高了鞘脂菌属(Sphingobium)、芽球菌属(Blastococcus)、红色杆菌属(Rubrobacter)的丰度,并显著减少了g_norank_f__WX65、假单胞菌属(Pseudomonas)和g_norank_f_norank_o_Rokubacteriales的丰度。
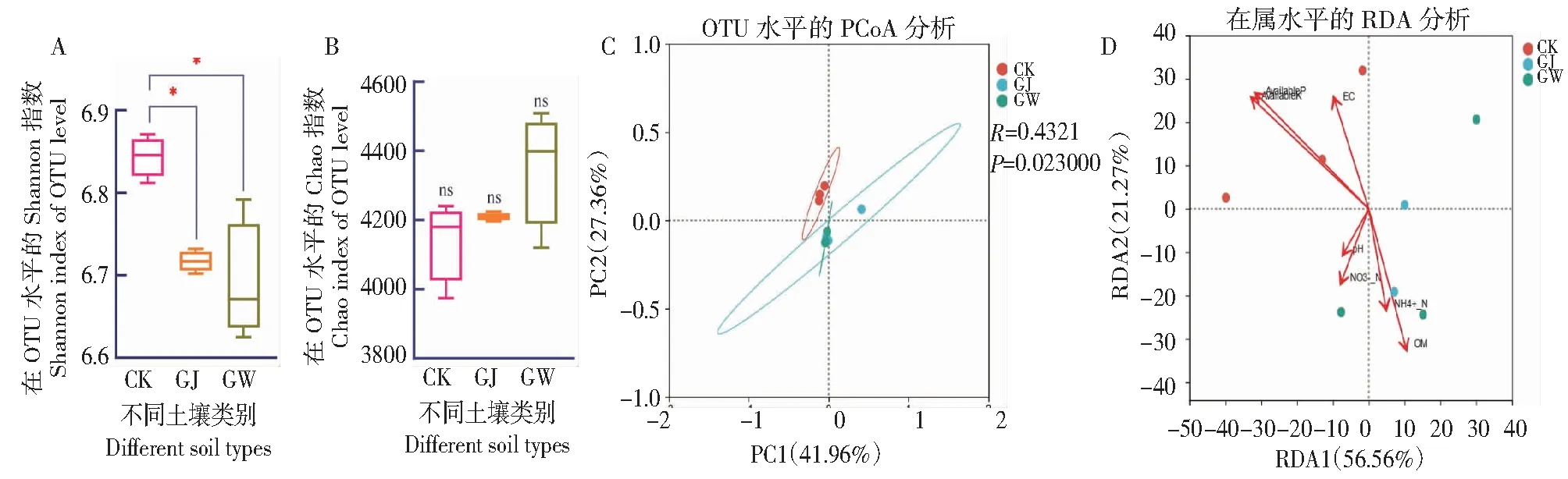
图3 土壤微生物多样性比较及群落结构
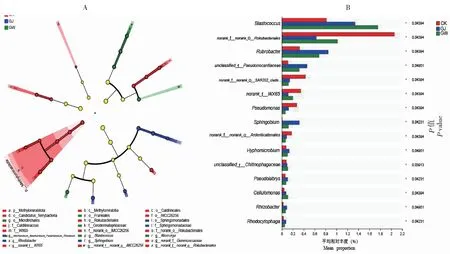
A. Lefse分析图; B. 组间差异性显著分析(*代表P<0.05)。
2.4 营养物代谢功能与细菌群落的相关性分析
土壤速效磷、速效钾含量在刺萼龙葵GJ、GW土壤中显著降低,且土壤微生物的底物代谢多样性显著增强,该营养物的显著变化与土壤微生物群落组成存在一定相关性。在属类水平下差异物种对细菌群落组成与营养因子进行相关性Heatmap分析(图5),结果表明,速效磷和速效钾与g_norank_f_norank_o_Rokubacteriales、g_norank_f_Gemmatimonadaceae和大理石雕菌属(g_Marmoricola)呈显著正相关(P<0.05),与g_Sphingobium、g_Rubrobacter呈显著负相关(P<0.05);聚合物类、酚酸类、氨基酸类和铵态氮含量与鞘脂菌属呈显著性正相关(P<0.05)。

Carboxylic. 羧酸类;Polymers.聚合物类; Sugar. 糖类; Phenolic. 酚醛; Amines. 胺类; Amino. 氨基酸类;*表示P<0.05,**表示P<0.01,***表示P<0.001。

图6 刺萼龙葵覆盖地土壤与对照土壤的PICRUSt功能预测
2.5 刺萼龙葵对土壤微生物群落的功能预测
运用PICRUSt软件对刺萼龙葵GJ、GW土壤与对照土壤的微生物群落功能进行预测,结果发现代谢通路在3个水平上的信息及其丰度,Pathway level 1有6条代谢通路,Pathway level 2有46条代谢通路,Pathway level 3有412条代谢通路。刺萼龙葵GJ、GW土壤与对照土壤的微生物群落代谢通路相似,但是代谢通路的相对丰度不同。分析发现,刺萼龙葵的入侵显著提高了甘氨酸、丝氨酸和苏氨酸代谢、戊糖和葡萄糖醛酸相互转化和糖酵解/糖异生相对丰度(图 6)。
3 讨 论
土壤是生态系统营养物质的主要积蓄场所,为植物提供必须的营养和水分[30],外来植物入侵通过改变入侵地土壤的养分含量,创造有利于自身生长或抑制周围其他植物生长的土壤环境[31]。赵晓红等[32]研究发现刺萼龙葵入侵显著提升了速效磷和速效钾的含量,这与本研究结果不同。可能是因为本研究地土壤为沙质土壤,营养贫瘠,保水保肥能力较差,而赵晓红研究地为灌淤土,营养充足。本研究地土壤较贫瘠,刺萼龙葵可利用的养分较少,为满足其生长发育,刺萼龙葵可能会大量吸收土壤中的矿物质,导致速效磷和速效钾含量显著降低。这也使得本地植物生长所需养分不足,在竞争中缺乏优势,从而改变地上植被群落结构。研究发现,植被与土壤为统一生态系统,地上植物群落发生改变,土壤生态系统也会随之改变[33]。土壤微生物作为土壤生态系统的组成部分[34],具有驱动植物生长所必需的几种功能,例如营养循环[35]。因此,本研究推测刺萼龙葵可能通过直接或间接的途径改变土壤养分循环,进而改变土壤微生物群落,使其在适宜环境下大肆入侵与扩散。土壤微生物作为土壤生态系统中的重要组成部分,在植物生长、土壤肥力、营养循环等方面发挥着重要作用[36]。Biolog微平板可以最大限度的保留微生物群落原有的代谢特征,本研究利用Biolog微平板对入侵土壤中的微生物群落进行培养,结果发现,刺萼龙葵入侵显著提高了土壤微生物的代谢活性和碳源利用率,这与前人的研究结果一致[32]。对土壤微生物不同碳源利用率的研究可以揭示微生物群落代谢的详细信息,本研究发现,与未入侵样地相比,刺萼龙葵入侵显著提高了对糖类、聚合物类、氨基酸类、羧酸类和酚酸类的利用率,表明刺萼龙葵入侵改变了土壤微生物对碳源的利用,其中根际处的微生物碳源利用率高于根围,与前人研究结果相同[32]。糖类、氨基酸类和羧酸类是植物根系分泌物的主要成分。本研究中刺萼龙葵对糖类的利用率最大,这可能是因为实验地为沙质土壤,保水保肥能力较差,糖类物质具有亲水和保水的作用,对土壤团聚体的比例和结构具有重要作用,有利于提高土壤保水保肥能力,土壤微生物对糖类、聚合物类、氨基酸类利用率的提高,有利于土壤有效养分转化。羧酸类与病菌的感染密切相关,酚酸类是重要的化感物质,会抑制植物生长[37]。因此推测,刺萼龙葵根系可能会分泌某些特殊物质,这些物质会在根际处大量聚集对刺萼龙葵入侵有益的微生物,改善土壤环境,促进微生物代谢活性,调节养分供给,为其入侵提供有利条件。
外来植物成功入侵的原因之一是促进根际土壤微生物群落结构发生变化、强化微生物群落功能,从而为外来之物提供更有利的土壤微环境,加剧其入侵进程[38]。Biolog-ECO仅表现了部分土壤微生物特征,为充分了解土壤微生物群落结构,本研究利用高通量测序进一步研究分析。刺萼龙葵入侵显著降低了微生物群落多样性,这与前人的研究结果一致[39]。这可能与刺萼龙葵根际分泌物有关。郝丽娟等[40]通过高效液相色谱法分离了刺萼龙葵体内黄酮等芳香族次生代谢物质,这些物质可能为化感物质,并且本研究也通过Biolog微平板发现,刺萼龙葵入侵提高了对化感作用中重要物质-酚酸类的利用,说明某些微生物能适应酚酸环境,并以其作为碳源进行生长。因此本研究推测,刺萼龙葵根系会分泌化感物质,创造酚酸环境,在根际土壤微生物群落选择中起着关键作用[41]。入侵植物不仅会改变土壤微生物的多样性,还会改变土壤细菌群落的组成[42]。本研究中的PCoA证实了刺萼龙葵入侵改变了土壤微生物群落组成,并且结合RDA结果发现,在属水平上,土壤细菌群落组成的变化与土壤速效磷、速效钾密切相关。这可能是因为K、P是微生物细胞结构的重要组成物质,微生物对K、P养分具有一定的依赖[43]。这表明土壤速效磷和速效钾是影响土壤细菌群落组成的主要驱动因素[43-44]。
营养物质的改变会影响微生物群落组成,反过来微生物群落结构的变化也会改变土壤营养循环,为外来植物的入侵提供有利条件[45]。在本研究中,入侵地多为禾本科植物[46],Sphingobium在入侵土壤根际处丰度显著增加,其丰度与酚酸类碳源利用率呈显著正相关,与速效磷、速效钾含量呈显著负相关。研究发现,Sphingobium具有分解木质素释放酚酸类化感物质,抑制植物生长的功能[47]。因此本研究推测,刺萼龙葵入侵改变了土壤养分循环,显著提升Sphingobium丰度,分解木质素释放酚酸类物质,抑制其他植物生长,疯狂掠夺养分,有利于刺萼龙葵入侵与定殖。现今,对刺萼龙葵入侵土壤微生物群落结构的变化与土壤理化性质相关性的研究鲜有报道,土壤理化性质对其入侵机制的影响还未可知,需要更深入、系统的研究。
目前关于外来植物入侵对土壤微生物群落功能的研究鲜有报道。刺萼龙葵入侵过程中,植物群落和土壤理化性质的变化也会引起土壤微生物群落的变化,其群落功能也会发生变化。PICRUSt高通量测序可以通过与数据库比对,将微生物的变化情况和生物功能相联系[48]。氨基酸是蛋白质的基本单元,参与多种生理活动,同时也是许多次生代谢物的前体,在植物信号、胁迫防御等方面发挥重要作用[49]。本研究中,刺萼龙葵的生长显著提高了糖代谢和氨基酸代谢方面相关途径的丰度,例如戊糖和葡萄糖醛酸相互转化、糖酵解/糖异生、甘氨酸、丝氨酸和苏氨酸代谢等方面的功能。研究发现,糖酵解是碳水化合物代谢的关键途径[50],戊糖和葡萄糖醛酸相互转化是糖代谢的重要环节[51],它们为植物和微生物的生长发育提供所需的营养。这表明刺萼龙葵入侵地土壤微生物参与了植物代谢过程,为其生长提供营养,以满足刺萼龙葵生长需要。
4 结 论
本研究通过分析刺萼龙葵入侵地土壤微生物群落的变化发现,刺萼龙葵入侵改变了土壤养分循环,显著降低了土壤细菌群落的多样性,改变了土壤微生物群落结构,提高了Sphingobium的相对丰度。以及与微生物代谢相关途径基因丰度,如戊糖和葡萄糖醛酸相互转化等方面的功能,为刺萼龙葵的入侵提供能量。本研究为理解植物入侵后土壤细菌群落的变化和驱动模式提供了进一步信息,并对微生物的相关功能进行预测,有助于阐明刺萼龙葵的入侵机制。
