黄瓜类钙调蛋白CML8与性型分化主效基因编码蛋白的互作分析
2023-07-05许俊强张新梅张国平张应华
许俊强,张新梅,吕 霞,苏 甜,张国平,张应华,许 彬
(1. 云南农业大学云南省滇台特色农业产业化工程研究中心, 昆明 650201;2. 云南农业大学园林园艺学院, 昆明 650201)
【研究意义】黄瓜(CucumissativusL.)是葫芦科黄瓜属蔬菜作物,是研究植物性型分化的模式植物。依雌花、雄花、两性花的不同组合,可以将黄瓜植株划分8种类型,大多数的黄瓜通常以雌雄异花同株为主[1],且受遗传背景、环境因子、激素水平等多种因素的控制。【前人研究进展】Yin和Quinn[2]提出黄瓜发育“单一激素控制黄瓜花型表现假说”。调控黄瓜性型分化的基因主要有F/f、M/m、A/a、In-f、Tr、gy等[3],性型表现主要受F、M和A基因的调控;F基因可加强雌花提早发育[4]。Bai等[5]发现,黄瓜雌蕊原基形成时期CsACS2(1-aminocyclopropane-1-carboxylatesynthase2)较高表达可能引起雄蕊败育;Pan等[6]证明,黄瓜乙烯响应因子31(Ethylene response factor 31,CsERF31)能直接结合M(即ACS2)基因的启动子并促进其表达,补充提出了“乙烯-CsERF31-M-乙烯”正反馈调节机制模型。M基因抑制雄花的形成和发育;A基因位于F基因上游,其作用是抑制雌花发育,增强雄性花[7]。F、M和A基因共同调控植物产生雌花、雄花和两性花,Trebitsh等[8]发现基因CsACS1G(1-aminocyclopropane-1-carboxylatesynthase1G),且CsACS1G即是F基因[9];Li等[10]证实M基因为CsACS2基因;A基因被证实为CsACS11(1-aminocyclopropane-1-carboxylatesynthase11),促进心皮发育[11]。CsWIP1(wild-typep53-inducedphosphate1)作为心皮抑制剂抑制CsACS11[1],而CsWIP1也可抑制CsACS2和CsACO2(1-aminocyclopropane-1-carboxylicacidoxidase2)的表达,在性型分化中起非常关键作用[12-13];黄瓜ACS1G在花蕾早期表达,并与ACO2共同产生乙烯抑制WIP1并激活ACS2以启动雌蕊发育,ACS1G的早期表达绕过了需要ACS11产生乙烯,从而建立雌蕊发育的优势途径[14]。目前有三类钙信号系统:钙依赖型蛋白激酶(CDPKs)、钙调蛋白CaMs(Calmodulin)和类钙调蛋白CMLs(Calmodulin-like)、钙感应蛋白CBLs (Calcineurin B-like)。其中CaMs、CMLs和CBLs只含有EF-hand基序而没有CDPKs的激酶结构域,故只能与Ca2+结合后发生构象变化并与下游的蛋白结合而发挥作用[15-16]。CaMs和CMLs是真核细胞及其在行使植物生物功能过程的重要Ca2+传感器[17]。Ca2+和CaM可能参与了一些植物的花芽分化过程[18]。易籽林等[19]推测花芽分化前首先要有钙积累,然后从贮藏部位释放活化成Ca2+,刺激CaM含量上升,启动花芽分化的发端过程。而CMLs参与植物的多种生理生化及生长发育过程,在不同胁迫下(干旱、盐胁迫、低温、高温、ABA、H2O2、SA及MeJA),BoCML39基因在根和叶片中均增加表达[20];BoCML49促进结球甘蓝花粉萌发和花粉管伸长[17]。管晓艳[21]推测,黄花苜蓿MfCML29和MfCML1参与调控植物Fe营养平衡;Nie等[22]在大白菜中假设了BrCMLs蛋白的相互作用网,发现BrCML2、BrCML6、BrCML15和BrCML25共同表达,可能参与花的发育和其他生物学功能。拟南芥AtCML8促进植物对植物病原细菌的免疫力,超表达CML8增强植物对病原菌的抗性[23-24]。但CMLs在植物性型分化过程中的研究未有报道。【本研究切入点】Ca2+作为生物体中的第二信使,参与了生物的生长发育和对外界刺激的应答反应,CMLs作为钙信号系统成员之一,CML8能否参与植物性型分化过程,还未有报道。【拟解决的关键问题】对黄瓜CMLs功能的研究处于起步阶段,对钙信号参与黄瓜性型分化的研究甚少,通过克隆得到黄瓜CML8基因,探究黄瓜CML8编码蛋白与性型分化主效基因编码蛋白F(ACS1G)、M(ACS2)及A(ACS11)之间的互作关系,以期望为钙信号系统参与植物性型分化过程提供参考。
1 材料与方法
1.1 试验材料
试验材料为黄瓜雌性系“100-1”,由云南农业大学滇台特色农业产业化工程研究中心实验室保存。植物总 DNA、RNA 提取试剂盒购自天根生化科技(北京)有限公司;pEASY-Blunt Simple Cloning Kit、大肠杆菌感受态细胞Trans1-T1、Trans2K PlusⅡ DNA Marker、TransStart FastPfu Fly DNA 聚合酶等均购自北京全式金生物技术有限公司; qPCR 试剂盒、反转录试剂盒等购自ABM(美国)公司;酵母双杂交系统及相关培养基购自Clontech(美国)公司;限制性内切酶购自TAKARA;北京擎科生物科技有限公司(昆明)合成引物及测序。
1.2 试验方法
1.2.1 材料种植 2021年3—6月在云南农业大学滇台中心温室种植,于2~4片真叶期每隔7 d喷施AgNO3300 mg/L,共喷施3次,诱导雌性系黄瓜产生雄花及两性花。
1.2.2 黄瓜总RNA和DNA的提取 各取黄瓜雄花、雌花及两性花100 mg,液氮速冻后置于-80 ℃冰箱保存。采用天根公司试剂盒提取DNA和RNA,RNA用1%琼脂糖凝胶电泳并进行浓度检测,于-80 ℃保存。用5×All-In-One RT Master Mix Kit合成第一链cDNA,反应体系与程序:总RNA 2 μg,AccuRT Reaction Mix(4×) 2 μL,RNase Free H2O 至8 μL,42 ℃ 2 min,AccuRT Reaction Stopper(5×) 2 μL,充分混匀,5×All-In-One RT Master Mix 4 μL,RNase Free H2O至20 μL,轻轻混匀,25 ℃ 10 min,42 ℃ 30 min,最后85 ℃ 5 min灭活,-20 ℃保存。
1.2.3 引物设计 参考NCBI上黄瓜CML8(XM_011650457.1)序列,设计黄瓜特异性引物对CML8-F/CML8-R,用于扩增CML8基因全长序列(表1)。根据已公布的黄瓜ACS1G基因(DQ839406.1)、ACS2(NM_001305700.2)及ACS11(KT715743.1)基因分别设计ACS1G-F/ACS1G-R、ACS2-F/ACS2-R和ACS11-F/ACS11-R特异引物对,用于克隆ACS1G、ACS2及ACS11基因。

表1 试验用的引物
1.2.4 黄瓜CML8、ACS1G、ACS2、ACS11基因克隆 使用天根RNA提取试剂盒提取总RNA,5×All-In-One RT MasterMix反转录cDNA第一链,使用TransStart FastPfu Fly DNA Polymerase进行PCR克隆,上下游引物(10 μmol/L) 各1 μL,5×TransStart FastPfu Fly Buffer 10 μL,2.5 mmol/L dNTPs 4 μL,DNA Polymerase 0.5 μL,模板1 μL,RNase Free H2O至25 μL。PCR扩增参数为95 ℃ 2 min,95 ℃ 30 s,55 ℃ 1 min,72 ℃ 30 s, 72 ℃ 5 min;35个循环。1%琼脂糖电泳检测,回收CML8、ACS1G、ACS2、ACS11基因的目的条带。将目的条带连接到克隆载体,转化大肠杆菌感受态细胞。分别挑取单菌落,经PCR、测序后,把测序正确的命名为pB-CML8、pB-ACS1G、pB-ACS2、pB-ACS11。
1.2.5 黄瓜CML8基因编码蛋白序列分析 通过在线SignalP分析(http://genome.cbs.dtu.dk/services/SignalP-2.0/)信号肽;TargetP亚细胞定位(http://genome.cbs. dtu.dk/services/TargetP/);基因编码蛋白结构域在线预测分析(http://smart.embl-heidelberg.de/);跨膜域分析(http://genome.cbs.dtu.dk/services/ TMHMM/);利用ProtScale(https://web.expasy.org/)在线预测基因编码蛋白的亲水性;通过SOPMA (https://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线分析编黄瓜CML8码蛋白的结构;利用MEGA7.0对CML8编码蛋白构建进化树。
1.2.6 黄瓜CML8基因在不同花型中的表达分析 分别提取黄瓜雄花、雌花及两性花总RNA,反转录第一链cDNA,以qCML8-f/ qCML8-r为CML8定量表达引物,β-Actin为内参基因(表1),在Bio-RAD CFX96荧光定量PCR仪上进行。反应体系包含2×qPCR MasterMix 10 μL,引物各0.6 μL,cDNA模板1 μL,RNase Free H2O至20 μL。扩增程序为95 ℃ 10 min;95 ℃ 30 s,56 ℃ 15 s,72 ℃ 30 s,39个循环。采用2-ΔΔCT方法进行相对定量表达分析。
1.2.7 黄瓜CML8、ACS1G、ACS2酵母重组表达载体的构建 使用引物对CML8-BN/CML8-BB,以pB-CML8为模板,扩增得到CML8,将含有CML8的载体和pGBKT7经NdeI/BamH I双酶切后,连接转化,在LB/Kan培养基筛选阳性克隆。检测正确的载体命名为pGBKT7-CML8。分别以ACS1G-AN/ACS1G-AB、ACS2-AN/ACS2-AB、ACS11-AN/ ACS11-AE引物对为引物,以pB-ACS1G、pB-ACS2、pB-ACS11为模板得到ACS1G、ACS2、ACS11序列;pGADT7载体经NdeI/BamH I、NdeI/EcoR I双酶切后,进行连接转化,于LB/Amp固体培养基中筛选阳性克隆,命名为pGADT7-ACS1G、pGADT7-ACS2、pGADT7-ACS11。
1.2.8 酵母的融合及互作检测 将构建正确的酵母表达载体根据Clontech的操作手册进行酵母Y187、Y2HGold感受态制备及重组表达载体转化。参考Gold Yeast Two-Hybrid System操作手册,在不同的缺陷培养基平板上观察不同菌落大小,是否具有自激活现象。
挑取大小相近的Y2H(pGBKT7-CML8)分别与Y187(pGADT7-ACS1G和pGADT7-ACS2)菌落混合于500 μL 2×YPDA中,30 ℃培养20 h,观察酵母融合情况。然后再涂布在二缺(DDO)固体培养基平板上,30 ℃培养3~5 d,挑取融合菌单菌落分别涂于DDO+AbA、QDO、QDO+X-α-Gal+AbA固体培养基平板上,30 ℃培养3~5 d观察是否长出菌落或菌落是否呈蓝色。
2 结果与分析
2.1 AgNO3诱导黄瓜性型变化
通过300 mg/L AgNO3诱导后,雌性系黄瓜的性型发生改变,从雌花产生雄花及两性花,两性花的雌蕊顶端变粗膨大(图1-A、1-B和1-C)。通过诱导产生的两性花花粉具有育性,自花授粉后能够结籽,但果实短、小,结籽率降低,所结籽部位位于果实底部顶端(图1-D、1-E)。

A:雌花;B:两性花;C:雄花;D:未授粉果实;E:两性花自交果实。
2.2 黄瓜CML8、ACS1G、ACS2、ACS11的克隆
从黄瓜茎尖中提取基因组DNA,从黄瓜雌花、雄花及两性花中提取总RNA,cDNA扩增得到500 bp左右的CML8基因(图2),经过测序表明,该基因包含完整ORF 441 bp;黄瓜基因组扩增得到CML8gDNA序列,全长为441 bp(图2);回收、克隆并对目标片段测序表明,CML8基因含4个外显子、3个内含子。从黄瓜雄花及雌花中克隆得到ACS1G、ACS2、ACS11基因,得到的测序结果与数据库获得的序列完全一致。ACS1G基因大小为1446 bp,ACS1GgDNA序列全长1678 bp,含有2个内含子,3个外显子;ACS2基因大小为1338 bp,ACS2gDNA序列全长2104 bp,含有2个内含子,3个外显子;ACS11基因大小为1323 bp,ACS11gDNA序列全长1859 bp,含有3个内含子,4个外显子(图3)。

M: Trans2K PlusⅡDNA Marker; 1:CML8基因gDNA扩增;2: CML8基因cDNA扩增 。

M: Trans2K Plus Ⅱ DNA Marker; 1: ACS1G克隆; 2:ACS2克隆; 3:ACS11克隆。
2.3 黄瓜CML8序列分析
2.3.1 黄瓜CML8编码蛋白序列分析 序列分析表明,黄瓜CML8编码146 aa,MW为16.84 kD;pI为3.81;不含信号肽;不含跨膜域,为胞外蛋白;该序列中含有4个具有钙离子结合能力的EF-hand结构域,分别位于9~37、45~73、82~110及118~146位氨基酸处(图4),亚细胞定位在细胞膜和细胞质,不含信号肽。利用软件DNAMAN 6.0.3进行多序源性分别高达97.95%、92.47%、90.41%及90.41%。

底纹部分为4个EF-hand模体;倒三角所指的E表示保守谷氨酸。
列比对,在氨基酸水平上,黄瓜CML8与已公布的黄瓜(Cucumissativus[XP_011648759.1]),相似度为100%;与甜瓜(Cucumismelo[XP_008455900.1])、节瓜(Benincasahispida[XP_038890963.1])、南瓜(Cucurbitamoschata[XP_022946612.1])、西葫芦(Cucurbitapepo[XP_023547072.1])氨基酸序列同
2.3.2 黄瓜CML8编码蛋白结构分析 ProtScale预测结果表明,CML8蛋白为亲水性蛋白,在位于第142位氨基酸处为最大值1.722,位于第76位氨基酸处为最小值-2.444。SOPMA分析编码蛋白的二级结构表明,黄瓜CML8蛋白包含α 螺旋63.01%、β转角8.22%、无规则卷曲22.60%以及延伸链6.16%。NetPhos 3.1分析发现,黄瓜CML8蛋白可能的磷酸化位点是4个Ser、4个Thr、2个TyrSWISS-MODEL对黄瓜CML8编码蛋白的三级结构预测表明,CML8含有4个似小球状的钙离子(图5)。

图5 黄瓜CML8蛋白三级结构预测
2.3.3 黄瓜CML8编码蛋白进化树分析 对CML8编码蛋白构建进化树发现,黄瓜CML8与已报道黄瓜(XP_011648759.1)、甜瓜(XP_008455900.1)处于同一进化枝上,亲缘关系最近;与节瓜亲缘关系较近(图6)。

图6 黄瓜CML8蛋白系统进化树
2.4 CML8在黄瓜不同花型中的表达分析
对黄瓜CML8基因在不同花型中的表达分析表明(图7),黄瓜CML8基因在不同花型中的表达量差异显著,雌花中的表达量是两性花中的2.4倍,差异显著;而雄花中该基因的表达量是两性花的8.5倍,是雌花中表达量的3.5倍,均达极显著差异。说明通过AgNO3诱导雌性系黄瓜产生的雄花中CML8高度表达,可能CML8参与黄瓜性型分化过程。

小写字母表示差异显著(P<0.05), 大写字母表示差异极显著(P<0.01)。
2.5 黄瓜CML8及ACS1G、ACS2、ACS11酵母表达载体的构建
将pGBKT7-CML8、pGADT7-ACS1G、pGADT7-ACS2重组质粒均用NdeI/BamH I双酶切,pGADT7-ACS11用NdeI/EcoR I双酶切,均得到与目的基因大小一致的目的条带(图8)。测序表明,pGBKT7-CML8、pGADT7-ACS1G、pGADT7-ACS2、pGADT7-ACS11酵母表达载体均构建正确。
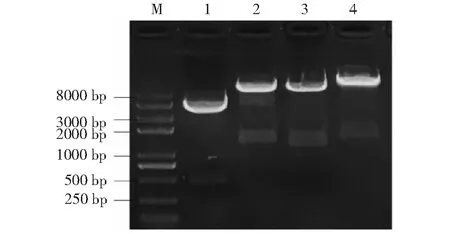
M:Trans2k Plus II DNA marker;1:pGBKT7-CML8双酶切;2:pGADT7-ACS1G双酶切;3:pGADT7-ACS2双酶切;4:pGADT7-ACS11双酶切。
2.6 毒性检测与自激活鉴定
将构建正确的酵母表达载体分别转化Y2HGold和Y187酵母感受态细胞。在相同培养条件下的培养基平板上,单克隆菌落大小相近,说明构建的重组质粒对酵母Y2HGold、Y187菌株均无毒性。Y2HGold(pGBKT7-CML8)在SD/-Trp和SD/-Trp/x-α-gal固体培养基上均能长出白色菌落,而在SD/-Trp/x-α-gal/AbA和DDO固体培养基上均无菌落生长。Y187(pGADT7-ACS1G)、Y187(pGADT7-ACS2)、Y187(pGADT7-ACS11)酵母菌株在SD/-Leu和SD/-Leu/x-α-gal固体培养基上均能长出白色菌落,而在SD/-Leu/x-α-gal/AbA和DDO固体培养基上均不能生长。阳性对照在SD/-Leu/x-α-gal/AbA和SD/-Trp/x-α-gal/AbA固体培养基上的菌落均呈蓝色,阴性对照在DDO+X-α-gal+AbA的固体培养基均无菌落生长。表明所构建的4个酵母表达载体在所对应的酵母菌株中均无自身转录激活活性(图9)。

1:pGBKT7;2:pGBKT7-CML8;3:pGADT7;4:pGADT7-ACS1G;5:pGADT7-ACS2;6:pGADT7-ACS11。
2.7 黄瓜CML8与ACS1G、ACS2、ACS11蛋白相互作用鉴定
将Y2HGold(pGBKT7-CML8)、Y2HGold(pGBKT7)分别与Y187(pGADT7-ACS1G)、Y187(pGADT7-ACS2)、Y187(pGADT7-ACS11)和Y187(pGADT7)融合为二倍体酵母。结果表明,[Y2HGold (pGBKT7-CML8) × Y187 (pGADT7-ACS1G)]、[Y2HGold (pGBKT7-CML8) × Y187 (pGADT7-ACS2)]组合在QDO和QDO+X-α-gal+AbA培养基上能生长并呈蓝色,而[Y2HGold(pGBKT7-CML8)×Y187(pGADT7-ACS11)]组合无菌落生长(图10)。由此可知,黄瓜CML8能够与F(ACS1G)和M(ACS2)发生相互作用,而不能与A(ACS11)互作。
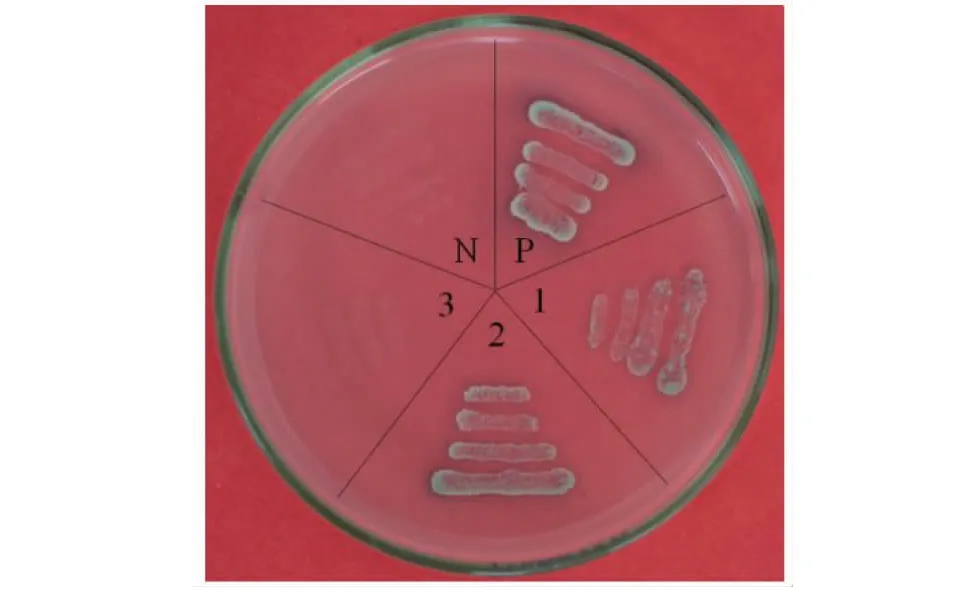
1: Y2HGold(pGBKT7) ×Y187(pGADT7-ACS1G); 2: Y2HGold(pGBKT7-CML8)×Y187(pGADT7-ACS2);3: Y2HGold(pGBKT7-CML8)×Y187(pGADT7-ACS11);P: Y2HGold(pGBKT7-T53)×Y187(pGADT-T); N: Y2HGold(pGBKT7-Lam) ×Y187(pGADT-T)。
3 讨 论
黄瓜是研究植物性型分化的模式植物,其性型分化受遗传背景、环境因子、激素水平等多种因素控制。植物类钙调蛋白CMLs是重要的钙离子结合蛋白,在植物的多种生长发育过程和逆境胁迫等方面发挥着重要作用。本研究克隆得到黄瓜CML8基因,其编码蛋白含有4个EF-Hand结构域,符合类钙调蛋白CMLs的结构特征,属于类钙调蛋白CMLs家族成员;编码146个氨基酸,pI为3.81;不含信号肽;不含跨膜域,表明CML8不具有膜蛋白相关功能;亚细胞定位于细胞膜和细胞质;为亲水性蛋白。其序列与NCBI上已公布的黄瓜序列完全一致;通过同源序列构建进化树发现黄瓜与西瓜氨基酸序列同源性极高,达到96%,而与拟南芥的亲缘关系较远,说明CML8在黄瓜中可能具有与西瓜相似的功能。
赤霉素和AgNO3是葫芦科作物的常用诱雄剂,而乙烯可诱导产生雌花。控制黄瓜性型的主效基因F(CsACS1G)、M(CsACS2)、A(CsACS11)基因在赤霉素、乙烯、生长素、油菜素内酯和脱落酸等途径中的调控作用已经有报道[1]。内源生长素(IAA/AUX)的促雌性化作用是通过ACS基因的表达来调控乙烯的生物合成,油菜素内酯能够诱导乙烯产生,提高黄瓜的雌花率且提早开花[11,25];黄瓜GA3途径中的GAMYB1在花发育中具有重要作用,能调控黄瓜性型表达,诱导黄瓜的雌花转变为雄花[26];黄瓜乙烯响应因子ERF110(Ethyleneresponsefactor110)与性型分化有密切关系,其具有典型的AP2/ERF基因家族转录因子功能,可直接参与乙烯信号传导[27-28]。本研究通过300 mg/L AgNO3处理后诱导雌性系黄瓜产生雄花及两性花,与艾辛等[29]和Yamasaki等[30]证明AgNO3能诱导雌性黄瓜产生雄花和两性花,且两性花是完全可育的结论是一致的。梁述平等[17]认为CaM依赖型蛋白激酶同源物在开花调控中起着重要作用。彭抒昂等[31]表明,梨乙烯诱导成花的启动过程需要有CaM参与,且短枝芽中RNA表达量与CaM的峰值一致,成花期均呈上升趋势;Gu等[32]通过抑制消减杂交(SSH)在黄瓜中筛选到Ca2+依赖型的核酸酶基因(Ca2+Dependentnuclease,CsCaN),CsCaN蛋白表现出钙依赖性核酸酶活性,该基因在根、叶和花器官中均有表达,乙烯诱导该基因的表达,推测CsCaN基因可能参与到雌花中雄蕊原基的特异性DNA损伤过程。胞内Ca2+对乙烯生物合成的影响可能与钙调蛋白有关,维持高水平的钙调素含量和ACC合酶活性是乙烯生物合成所必需的,钙调素以间接方式调节乙烯生成中ACC合酶向乙烯转化这一关键步骤。本研究中,黄瓜CML8基因在不同花型中的表达量差异显著,雌花中的表达量与两性花中的差异显著,而雄花中该基因的表达量与两性花及雌花中均达到极显著差异,说明CML8可能参与AgNO3诱导黄瓜性型分化过程。类钙调蛋白CML8在酵母中可与黄瓜性型分化雄性基因F(ACS1G)和雌性基因M(ACS2)编码蛋白均能发生互作,表明CML8与黄瓜性型分化关键基因编码蛋白存在互作关系,初步说明CML8可能参与到黄瓜性型分化过程。由此推测钙信号系统可能参与黄瓜性型分化过程,但对于钙信号系统其它家族成员是否参与,及以何种方式参与该过程仍需进一步研究。
4 结 论
克隆得到黄瓜CML8基因及性型分化主效基因ACS1G、ACS2、ACS11;CML8能与ACS1G和ACS2发生互作,而不能与ACS11发生互作;CML8的表达量在不同花型中差异显著,且在雄花中差异极显著。表明CML8可能参与黄瓜性型分化过程。
