SAHA对裸鼠人乳腺癌细胞MCF-7移植瘤的影响
2023-07-05于日成焦凯仑
于日成,焦凯仑,何 涛
(1.内蒙古科技大学包头医学院研究生院,内蒙古包头 014040;2.内蒙古科技大学包头医学院第一附属医院乳腺外科)
当今乳腺癌已经超过肺癌成为全球女性最常见的癌症和第五大癌症死亡的原因[1-2]。乳腺癌约占女性所有癌症病例的24.5 %,占癌症死亡的15.5 %,在全球大多数国家乳腺癌的发病率和死亡率均居首位[1]。近年来虽然乳腺癌的治疗逐渐完善,但是乳腺癌的死亡率仍高居不下,极大程度上地威胁女性的健康。主要是因为其易转移性,乳腺癌细胞最常转移及浸润的部位是:淋巴结,骨,肺,肝,脑。尤其是脑转移的日益增多,且我们对其的认知不足,因此成为临床上一个难点。辛二酰苯胺异羟肟酸(suberoylanilide hydroxamic acid,SAHA)是组蛋白去乙酰化酶抑制剂(Histone deacetylase inhibitors,HDACi)中的一种,并在临床上广泛使用。可以通过改变包括肿瘤细胞的增殖和基因表达的调节等在内的多个相关过程中的组蛋白和非组蛋白的乙酰化水平[3]。之前的研究发现SAHA可通过翻译后修饰导致肿瘤细胞生长抑制、分化、凋亡和自噬相关的细胞死亡[4]。基质金属蛋白酶是机体重要降解酶,它具备降解细胞外基质作用而且能够调控生长因子表达,其中与肿瘤密切相关的基质金属蛋白酶被称为肿瘤相关性基质金属蛋白酶(cancer associated matrix metalloproteinases,CAMMPs),参与肿瘤发生发展的过程[5]。基质金属蛋白酶-2(matrixmetalloproteinase2, MMP-2)的高表达与乳腺癌的分化有关。多项试验对MMP-2与乳腺癌转移的研究发现,乳腺癌的侵袭和转移与其高表达有关,并对乳腺癌患者的预后有指导作用[6]。基质金属蛋白酶-9(matrixmetalloproteinase9, MMP-9)可使细胞外基质发生分解。增加肿瘤细胞的迁移能力,而由Kazal基序诱导的富含半胱氨酸的蛋白(RECK)是MMP-9的拮抗剂。RECK、MMP-2和MMP-9三者均可调节肿瘤生长和转移,参与肿瘤发生发展过程[7]。据此,本实验主要从动物水平研究SAHA在移植人乳腺癌细胞MCF-7的裸鼠体内的作用机制,探讨SAHA是否可以通过调节RECK基因、MMP-2、MMP-9三者在体内活性的变化,从而达到抑制乳腺癌细胞生长和转移的能力。
1 材料与方法
1.1实验裸鼠和细胞株 25只雌性Balb/c裸鼠,购自浙江维通利华实验动物技术有限公司,合格证编号:20170011010097,许可证号:SCXK(浙)2019-0001,6周龄。饲养环境为上海懿贝瑞生物公司动物实验中心(SPF级)。乳腺癌MCF-7细胞株购于上海匹拓生物科技有限公司。
1.2主要仪器和试剂 细胞二氧化碳培养箱购自于中国SANYO公司;辛二酰苯胺异羟肟酸(SAHA),CAS号:149647-78-9,购自上海阿拉丁生物化工技术有限责任公司;MMP-9 Polyclonal Antibody、MMP-2 Polyclonal Antibody和RECK Antibody均购自于美国signalway antibody公司;RPMI 1640培养基、DMEN购自于中国corning公司;胎牛血清(FBS)购自美国Ausbian公司;胰酶购自上海化学试剂公司;TEMED、SDS、Tris购自中国上海生工。
1.3实验方法
1.3.1细胞培养 细胞在液氮冻存后取出,快速放入37 ℃水浴锅中,轻慢晃动,待细胞完全解冻。解冻后加入10 %FBS+1 %双抗(Penicillin-Streptomycin)的培养基中,放入设定为37 ℃、5 % CO2的恒湿、恒温培养箱中进行培养。24 h后显微镜观察细胞贴壁情况,更换培养基继续培养,待细胞生长状态达到90 %~100 %时进行传代培养。当细胞数量达到所需时,用0.25 %的胰酶进行消化使细胞脱落,制成单细胞悬液。将其中一半转移到新的培养瓶中,每瓶继续加入培养液至4 mL。继续将各个培养瓶放在同等条件的培养箱中培养传代,以备后用。
1.3.2裸鼠成瘤及分组给药 将6周龄Balb/c裸鼠适应性喂养一周后,进行MCF-7细胞接种。提取对数生长周期的细胞,经过消化、清洗后制作成悬液,经过台盼蓝染色计数后,活细胞超过95 %。在计数板上进行计数,存活的细胞浓度最终达到1×106个/20 μL。细胞培育完成后在SPF环境下进行裸鼠接种建立模型,首先在裸鼠的右侧胸壁进行消毒处理后,于右腋下注射MCF-7 细胞。接种后喂养一周,观察肿瘤大小,共接种25只。挑选10只肿瘤体积在100 mm3左右且肿瘤体积相差不大的裸鼠进行后续实验。将10只裸鼠分为对照组和实验组。对照组:腹腔注射生理盐水0.4 mL/kg,实验组:腹腔注射SAHA(用DMSO溶解)0.42 mg/kg;连续给药14 d后,观察瘤体变化;裸鼠眼眶处采集静脉血制备血清备用;采取断颈法处死裸鼠,取肿瘤组织、肝脏、脾脏、胰腺备用。
1.3.3ELISA法检测裸鼠血清IL-6含量 预设标准孔和样本孔,在标准平孔中加入50 μL浓度不同的标准品。分别设空白孔,待测样品孔,取40 μL的样品稀释液加入到待测样品孔中,再加入10 μL的样品。使用封板膜经过封板处理后放在37 ℃恒温条件下温育30 min后。30 min后弃去液体加入用蒸馏水30倍稀释后的洗涤液,静置30 min后弃去,反复进行5次上述步骤。每孔加入50 μl酶标试剂,进行加酶处理后,再次温育洗涤。洗涤后每孔先加入显色剂A 50 μL,再加入显色剂B 50 μL,在37 ℃避光状态下,通过震荡摇匀,显色15 min。每孔加入50 μL的终止液,结束反应。加入终止液15 min内,将空白孔调为零,450 nm波长依序对各个孔的吸光度(OD值)进行测量。最后进行数据记录,统计学分析并绘制图表。
1.3.4抑瘤率及脏器指数测定 实验结束后处死裸鼠,对肿瘤组织进行分离,称重,用对照组平均瘤重减去实验组平均瘤重获得瘤体重量差值,用此差值与对照组平均瘤重相比得到抑制瘤率。将解剖分离出来的肝脏、脾脏、胸腺用生理盐水进行冲洗干净后,称取重量并计算脏器指数。
1.3.5肿瘤组织HE染色 肿瘤组织经过福尔马林溶液浸泡固定,进行脱水、包埋和切片处理后,将组织玻片置于65 ℃烤箱中烘烤30 min。烘烤完成后于二甲苯缸进行脱蜡,于酒精缸中洗去二甲苯。然后进行苏木素-伊红染色处理,中性树胶封片。最后,在显微镜下观察肿瘤组织的形态,并对其进行拍照、记录。
1.3.6免疫组化法(IHC)检测肿瘤组织MMP-2、MMP-9和RECK的表达 将经过福尔马林溶液浸泡固定,并脱水、包埋和切片处理后的组织玻片取出放入烤箱中65 ℃烤4 h,脱蜡前将组织玻片放入烤箱中65 ℃烤0.5~1 h,再于二甲苯缸脱蜡、酒精缸中洗去二甲苯,最后流水冲洗5 min。然后进行抗原修复。取出经过抗原修复的组织玻片,经过冷却降温处理至室温后,放入1×PBS缓冲液中,充分浸泡3~5 min。浸泡完后取出样本玻片并用免疫组织化学检测笔根据组织大小画出隔水圈。再使用1×PBST(1×PBS+0.1 % Tween20)缓冲液清洗5 min,重复3次,封闭后进行染色处理,使用中性树胶进行封片。分别检测实验组和对照组中MMP-2、MMP-9和RECK的表达并拍照记录。
1.3.7Western Blot法(WB)检测肿瘤组织中MMP-2、MMP-9和RECK的表达 从液氮中取出冻存的肿瘤组织,PBS洗涤1次,置于4 ℃冰上加入细胞裂解液和PMSF(配置比例100∶1)。用液态枪头吹打,直到细胞完全裂解为止。将已裂解的细胞样品放入离心管中,将离心管放置在冰上,待其继续裂开10~15 min后,离心机参数设置为4 ℃、12 000 rpm,离心10 min。取上清到新管中,添加缓冲液,置于恒温器中100 ℃、20 min。再重复一次离心操作后置于-20 ℃冰箱中保存备用。6孔板进行加样,每孔加入180 μL,蛋白电泳采用SDS-PAGE法。免疫印记(湿转)在4 ℃、恒流300 mA条件下电转90 min,将蛋白电泳至PVDF膜上。使用封闭液(含5 %脱脂牛奶的TBST溶液)封闭PVDF膜后,室温下摇床1 h。TBST洗膜三次后,用Millipore公司immobilon Western Chemiluminescent HRP Substrote试剂盒进行显色,化学发光成像仪进行化学发光。

2 结果
2.1细胞培养及裸鼠成瘤情况 乳腺癌细胞(MCF-7)形态正常,培养传代成功。25只裸鼠均于5~6 d长出肉眼可见的瘤体,全部成瘤成功,成瘤率为100 %,肿瘤的体积在一周后都达到了100 mm3。连续给药14 d后,实验组裸鼠瘤体大小略小于对照组。
2.2ELISA法测定IL-6 与对照组(control group)相比,实验组(SAHA)IL-6的含量均显著性降低(P<0.05)。见图1。
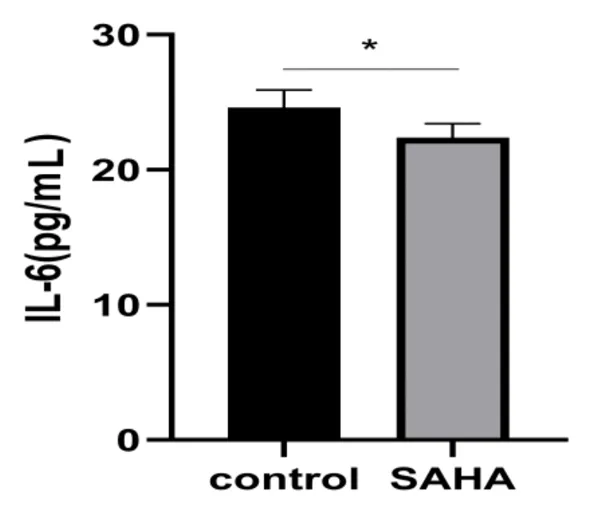
图1 ELISA测定IL-6的含量水平注:与对照组(control)比较,*P<0.05
2.3抑瘤率及脏器指数测定 实验组与对照组比较,肿瘤重量差异有统计学意义(f=15.47,P<0.05)。与对照组相比,实验组脾、肝脏器指数均显著降低(P<0.01)。见表1、图2。

表1 裸鼠MCF-7细胞肿瘤重量(g)及抑瘤率
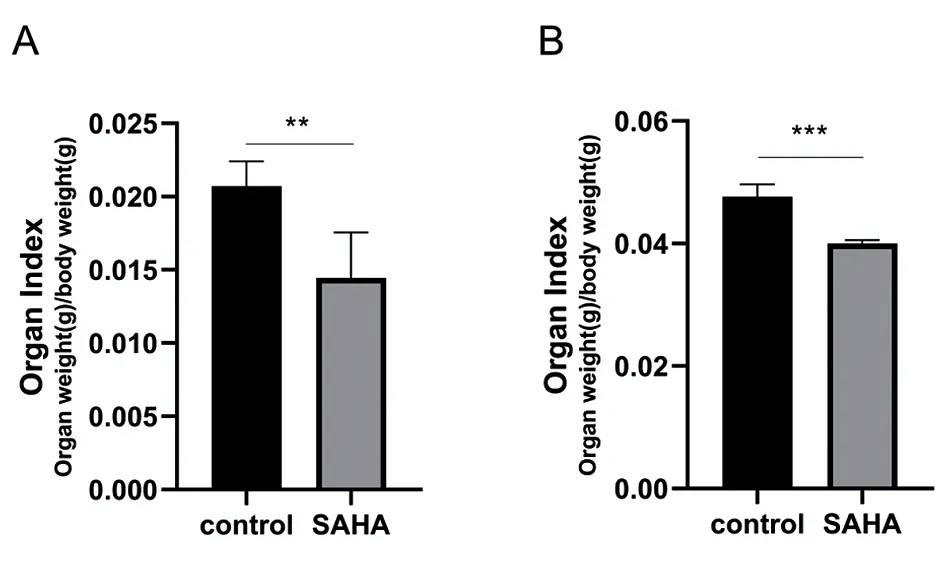
图2 脏器指数测定注:A.脾脏,B.肝脏;与对照组(control)比较,**P<0.01,***P<0.01
2.4肿瘤组织HE染色 与对照组相比,实验组中可见细胞有不同程度的皱缩,胞质致密,核染色质边集,细胞核固缩,变性,裂解,主要以中重度坏死为主。见图3。

图3 肿瘤组织HE染色
2.5IHC检测肿瘤组织RECK、MMP-2和MMP-9 对照组中MMP-9、MMP-2阳性表达较高,实验组加SAHA处理后表达下降;在对照组中RECK阳性的表达率较低。实验组加SAHA处理后阳性表达较高(P<0.05)。见图4、图5。
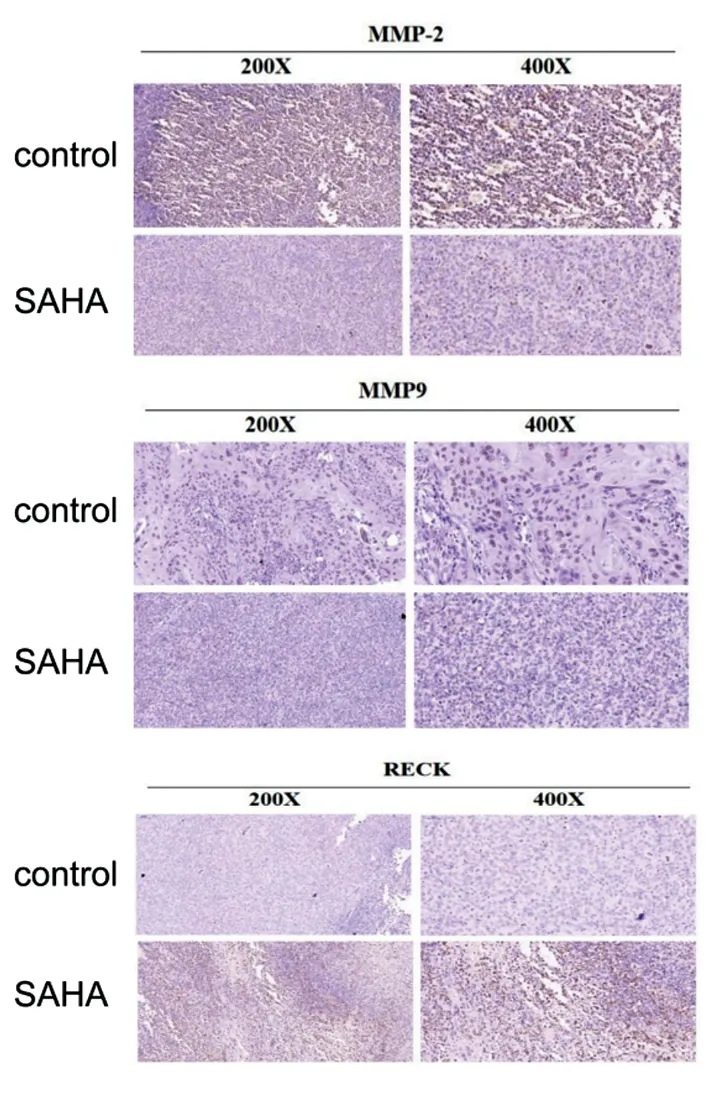
图4 IHC检测各组肿瘤组织中MMP-2、MMP-9、RECK的表达

图5 IHC检测各组肿瘤组织中MMP-2、MMP-9、RECK的表达分析注:与对照组(control)比较,*P<0.05
2.6WB检测肿瘤组织中MMP-2、MMP-9和RECK 与对照组比较,实验组中RECK的表达水平上调(P<0.01),MMP-2和MMP-9的表达水平都有所降低(P<0.05)。见图6、图7。

图7 WB检测各组肿瘤组织中MMP-2、MMP-9、RECK的表达分析注:与对照组(control)比较,*P<0.05,**P<0.01
3 讨论
通过本课题实验研究验证了SAHA可以在乳腺癌动物模型内通过提高RECK阳性表达,降低MMP-2和MMP-9的阳性表达,从而达到抑制乳腺癌细胞MCF-7的增殖与侵袭的能力。SAHA是新型的组蛋白去乙酰化酶抑制剂,是近年来研究的热点,其主要是通过与MMPs的催化部位形成稳定且不可逆的结合,进而使MMPs不能发挥正常的作用,影响其水解ECM的能力,从而对癌症转移起到抑制作用[9]。本实验证明了SAHA可在动物体内通过翻译后修饰导致乳腺癌细胞生长受到抑制。
MMPs在体内正常情况下对ECM有调控作用,但是在病理状态下这种调控会失衡,导致MMPs的活性增加,从而使组织更可能发生癌变。近十年来,MMPs是癌症方面研究的热点,人工合成的能抑制MMPs活性的药物有望成为对抗恶性肿瘤的新手段[10]。MMP-2和MMP-9是其家族中的关键酶,并且参与降解细胞外基质,在其家族中占据着重要的地位。其中Ⅳ型胶原酶就是由MMP-2激活后转变的,从而发挥破坏细胞外基质屏障,促进细胞增殖的作用[11]。有研究报道显示,MMP-2高表达会增强乳腺癌细胞的增殖和转移能力就是利用其能降解基质的原理,并且可以为血管内皮细胞增生,血管生成提供有利的条件[12]。肿瘤细胞以酶原的形式分泌MMP-9,水解后形成胶原酶并降解基底膜,之后肿瘤细胞可以通过此缺口向周围浸润,导致肿瘤发生转移[13]。MMP-9同样也有促进肿瘤细胞的扩散和转移的能力,以及促进新生血管的形成能力。有研究指出,MMP-9经过毁坏细胞基底结构的能力膜,脱离原发肿瘤,侵入局部组织,从而促进乳腺癌细胞的扩散和转移,也与淋巴结的转移和组织学分级有很大的关系[14]。MMP-9具有维持细胞外基质降解、重塑动态均衡的作用。肿瘤浸润转移的关键在于癌细胞与脉管内皮及皮下基膜异质黏附。MMP-9表达升高可加速皮下基膜和细胞外基质降解, 促进肿瘤向淋巴结和血液循环转移[9]。有实验研究表示,在乳腺癌患者预后中检测血清中MMP-2和MMP-9的表达量对评估患者情况具有重要的临床意义[15]。
RECK作为一种抑癌基因当其被HDACI去乙酰化时,从核小体核心伸出组蛋白N端。α氨基酸发生乙酰化,使其所带的正电荷降低,核小体中碱性氨基酸和DNA的静电作用减弱,使相邻核小体间的聚合度降低,染色质处于转录活性状态,从而促使抑癌基因的转录[16,17]。因此其既可以抑制Pro-MMP-9和Pro-MMP-2的释放,也可以直接抑制MMP-9、 MMP-2的活性。
本实验通过肿瘤组织HE病理染色的实验证明了SAHA可以改变并破坏肿瘤细胞的形态,降低乳腺癌细胞的增殖和扩散。Westernblot和免疫组化的实验也同时证明了SAHA可以提高RECK的表达,并且降低了MMP-2和MMP-9的表达水平。目前乳腺癌的治疗手段主要是以外科手术为主,化疗、内分泌治疗和放疗为辅的综合性治疗。但是由于其耐药性,且对于晚期乳腺癌患者的治疗及预后效果欠佳,并不能有效地缓解患者的病情及痛苦,寻找新的治疗手段、开发新的治疗药物仍是重中之重。因此本课题在先前细胞实验的基础上,进行了动物实验,而且动物实验的结果符合预期设想。
综上所述,本次研究的结果证实了SAHA在裸鼠体内也具有良好的效果,它能通过提高RECK的表达,有效地降低了MMP-2和MMP-9的表达。实现了在动物体内抑制乳腺癌细胞的增殖和转移的目的,且安全性较高。这一研究结果对改善乳腺癌预后、治疗乳腺癌意义重大,为今后进行临床试验及临床上应用提供了理论支持。
