姜黄素对高糖诱导人肾小管上皮细胞线粒体自噬的影响*
2023-07-05李永妍赖连英杨时旭李玉洁
常 江,王 颖,李永妍,赖连英,杨时旭,李玉洁
(1.海南医学院第一附属医院肝胆外科,海南海口 570102;2.海南医学院第一附属医院全科医学科;3.海南医学院)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病最常见的微血管并发症,在其发展过程中如不予干预,可进展至终末期肾脏病。DN发病机制比较复杂,早期临床防治难度大。自噬功能障碍与DN发病有密切关系,线粒体自噬可以特异性选择并清除受损或老化的线粒体,减少细胞内ROS,从而维持机体自身稳态。姜黄素是诸多中药的天然药物成分,为酸性多酚类物质,有极其广泛的药理作用,如抗凝、抗肿瘤、降血脂、抗氧化、抗炎等。目前已发现姜黄素对肾脏病变具有一定的治疗作用,且不良反应小、使用安全,已成为研究的热点。但是,姜黄素对DN的保护作用及机制并不明确。本研究观察姜黄素对高糖环境下人肾小管上皮HK-2细胞线粒体自噬以及氧化应激的影响,为进一步研究DN的有效中药治疗提供重要的理论来源和依据。
1 对象和方法
1.1材料与试剂 HK-2细胞购自美国ATCC (Manassas,USA细胞库);低糖 DMEM 培养基(美国Gibco公司);BCA 蛋白浓度测定试剂盒(北京Solarbio公司);兔抗人Pink1多克隆抗体、兔抗人Parkin多克隆抗体、兔抗人β-actin 多克隆抗体、鼠抗人Beclin-1多克隆抗体、兔抗人LC3Ⅱ多克隆抗体(美国Abcam公司);姜黄素(美国MCE公司);D-葡萄糖(美国Sigma公司);线粒体膜电位(JC-1)检测试剂盒(北京索莱宝生物技术有限公司);ROS试剂盒(南京建成生物工程研究所);CCK-8检测试剂盒(日本同仁公司)。
1.2姜黄素对HK-2细胞安全有效浓度的筛选 采用细胞计数试剂盒(Cell countin kit-8,CCK-8)检测HK-2细胞活力,探讨姜黄素的最佳药物浓度。对照组细胞予DMEM培养基,该培养基葡萄糖(glucose)浓度为5.5 mmol/L;高糖培养基的配制首先用DMEM培养基溶解D-葡萄糖,过滤后配成母液,然后按一定比例加入DMEM培养基中,使其葡萄糖终浓度为30 mmol/L。用0.25 %胰蛋白酶进行细胞消化后,在96孔板中以104~105个细胞/孔密度接种细胞,随机分为7组:对照组(5.5 mmol/L glucose),10 μmol/L姜黄素高糖组(30 mmol/L glucose+10 μmol/L Cur),20 μmol/L姜黄素高糖组(30 mmol/L glucose+20μmol/L Cur),40 μmol/L姜黄素高糖组(30 mmol/L glucose+40μmol/L Cur),60 μmol/L姜黄素高糖组(30 mmol/L glucose+60 μmol/L Cur),80 μmol/L姜黄素高糖组(30 mmol/L glucose+80 μmol/L Cur),100 μmol/L姜黄素高糖组(30 mmol/L glucose+100 μmol/L Cur),处理细胞48 h。根据说明书要求,将细胞进一步在新鲜培养基中培养48 h,然后将10μL CCK-8溶液分别加入到每孔培养基中。将培养板放置在37 ℃、5 %CO2环境中培养1 h。酶标仪检测450 nm处的吸光度值,选择姜黄素最佳浓度用于后续实验。
1.3HK-2细胞培养及实验分组 HK-2细胞接种于DMEM培养基中培养,培养箱条件5 % CO2、37 ℃,隔日换液,待细胞生长至80 %时进行传代。将实验HK-2细胞随机分为4组:HK-2细胞接种于5.5 mmol/L葡萄糖的DMEM培养液中培养,记为对照组(5.5 mmol/L glucose);对照组加入10 μmol/L姜黄素共培养,记为姜黄素组(5.5 mmol/L glucose +10 μmol/L Cur);HK-2细胞接种于30 mmol/L葡萄糖的培养基中培养,记为高糖组(30 mmol/L glucose);高糖组加入10 μmol/L姜黄素共培养,记为姜黄素高糖组(30 mmol/L glucose+10 μmol/L Cur)。干预48 h后进行各项实验。
1.4蛋白质印迹法检测LC3B、beclin1、Pink1、Parkin蛋白表达 使用RIPA裂解缓冲液溶解HK-2细胞,离心(13 000 r/min、15 min、4 ℃),蛋白质浓度测定按照二辛可酸(Bicinchoninic acid ,BCA)蛋白定量检测试剂盒说明书操作。十二烷基磺酸钠-聚丙烯酰胺凝胶(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)电泳分离蛋白,将分离的蛋白凝胶转移到聚偏二氟乙烯膜(Polyvinylidene flouride,PVDF),膜被封闭在5 %脱脂奶粉中,37 ℃温箱孵化1 h,4 ℃封闭一抗过夜。本研究使用的主要抗体为:anti-LC3B(1∶1 000,Abcam);anti-beclin1(1∶1 000,Abcam);anti-pink1(1∶10 000,Abcam);anti-parkin(1∶10 000,Abcam);anti-β-actin(1∶1 000,Abcam)。TBST洗涤3次后,用二抗(1∶1 000)室温封闭2 h,利用Image J软件分析各条带灰度值。
1.5线粒体膜电位的检测 按线粒体膜电位检测试剂盒(JC-1)说明书进行操作,对于6孔板的1个孔,吸除培养液,用PBS洗涤细胞1次,加入1 mL细胞培养液,37 ℃细胞培养箱中用JC-1染色工作液1 mL标记 HK-2细胞20 min,之后吸除上清,用JC-1染色缓冲液(1×)洗涤2次,加入2 mL细胞培养液,培养液中含有血清和酚红,应用激光共聚焦显微镜观察其荧光图像。激发光设置为525 nm,发射光设置为590 nm。线粒体膜电位较高时,产生红色荧光,线粒体膜电位较低时,产生绿色荧光。通过JC-1从荧光颜色的转变检测线粒体膜电位的变化。
1.6细胞内ROS的检测 根据产品说明书,用活性氧测定试剂盒对活性氧生成进行评价。不同分组HK-2细胞在含有2,7-二氯荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)且最终浓度5 μmol/L的不同培养基中培养48 h。在37 ℃、5 %的二氧化碳培养箱孵育30 min,1 %多聚甲醛固定,在4 ℃冰箱里放置10 min。细胞内非特异性酯酶去乙酰化后,DCFH-DA被ROS氧化生成荧光化合物2,7 -二氯荧光素(2,7-Dichlorodihydrofluorescein ,DCF)。采用流式细胞术检测DCF荧光强度,采用FlowJo软件进行分析。

2 结果
2.1CCK-8实验结果 通过CCK-8实验筛选姜黄素最佳药物浓度。与对照组相比,姜黄素高糖组细胞活性减低(P<0.01);高糖环境下不同浓度姜黄素组间比较,10 μmol/L姜黄素组细胞活性最高(P<0.01),筛选姜黄素最佳药物浓度为10 μmol/L。见图1。

图1 CCK-8实验选择姜黄素最佳药物浓度注: *为P<0.01,***为P<0.001
2.2各组 HK-2 细胞western blot检测结果 与对照组比较,姜黄素组各项指标无明显改变(P>0.05);与姜黄素组比较,高糖组LC3B、beclin1、Pink1、Parkin蛋白表达降低(P<0.01);与高糖组比较,姜黄素高糖组LC3B、beclin1、Pink1、Parkin蛋白表达升高(P<0.01)。见图2。
2.3各组 HK-2 细胞线粒体膜电位检测结果 与对照组比较,姜黄素组荧光强度无明显改变(P>0.05);与姜黄素组比较,高糖组细胞相对荧光强度比值降低(P<0.01);与高糖组比较,姜黄素高糖组细胞相对荧光强度比值升高(P<0.01)。见图3。
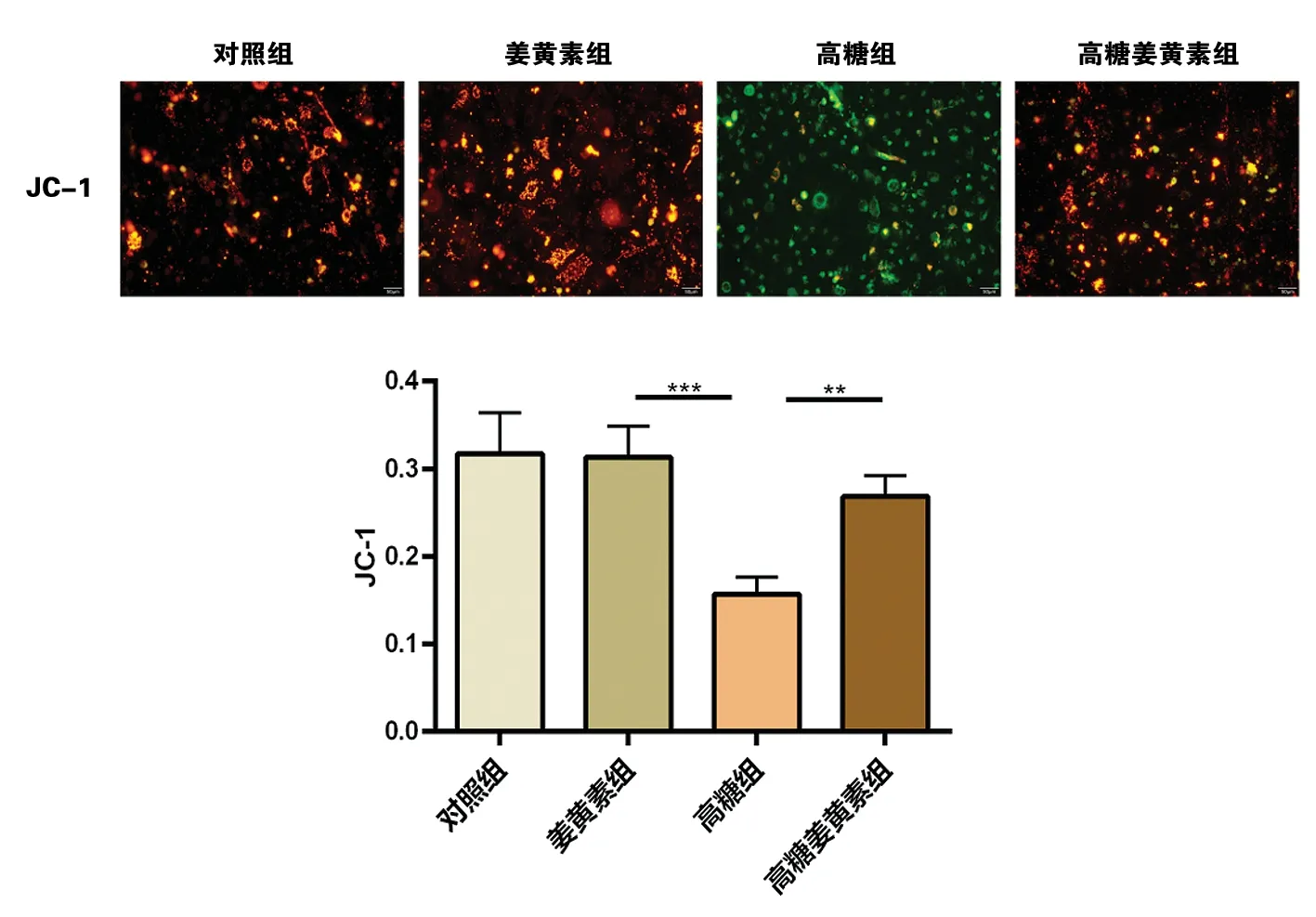
图3 JC-1荧光探针检测各组HK-2细胞线粒体膜电位水平注: **为P<0.01, ***为P<0.001
2.4各组 HK-2 细胞 ROS 检测结果 与对照组比较,姜黄素组ROS水平无明显改变(P>0.05);与姜黄素组比较,高糖组ROS水平升高(P<0.01);与高糖组比较,姜黄素高糖组ROS水平降低(P<0.01)。见图4。

图4 各组HK-2细胞ROS水平检测注: ***为P<0.001
3 讨论
DN是糖尿病的微血管并发症之一,是导致终末期肾脏病的主要原因,在全球范围内其致残率及病死率均高[1]。而DN的发病机制比较复杂,目前研究仍未完全阐明,致使其临床防治难度较大[2]。因此,探索天然药物成分缓解和改善糖尿病肾病已成为目前研究的重点,对提高DN患者的生活质量,延长其生存时间及减少患者的支出具有非常重要的作用。
DN的早期肾脏病变可见肾小球超滤过和肥大,肾小管损伤也是DN的早期变化和特征,与其进展关系密切,阻断肾小管上皮细胞受损可能更接近于DN治疗的源头[3]。DN状态下肾小管损伤的主要病理改变为肾小管萎缩、肾小管上皮细胞凋亡、周围炎症细胞浸润及转分化等。其主要分子机制为高糖及糖代谢产物、蛋白尿、氧化应激等诱导细胞内信号通路异常激活,ROS产生增多,释放出许多细胞因子,引起肾小管损伤[4]。线粒体是ROS产生的主要细胞器,高糖所致的线粒体ROS过多是肾小管损伤的核心[5]。自噬功能障碍与DN发病密切相关,自噬有助于把损伤和老化的细胞结构进行生理性移除,同时促进细胞存活,维持组织的内稳态[6]。线粒体自噬属于巨自噬,其机制是通过自噬及时清除受损或不需要的线粒体,并且与溶酶体融合,进而降解损伤线粒体,维持机体ROS平衡[7]。自噬效应蛋白Beclin-1和微管相关轻链蛋白LC3均是重要的自噬标记蛋白,且LC3B的含量与自噬的程度成正比。因此本研究通过western blot检测Beclin-1和LC3B在正常及高糖环境下的蛋白表达,观察姜黄素对其影响。线粒体自噬主要与Pink1/Parkin通路、BNIP3和NIX受体介导有关[8]。有研究证明,Pink1/Parkin通路激活,可改善DN足细胞线粒体自噬,减轻足细胞损伤[9, 10]。DN状态下,Pink1/Parkin通路在肾小管上皮细胞的表达变化仍未明确,因此,本研究进一步检测Pink1、Parkin蛋白表达,以观察高糖诱导的肾小管上皮细胞线粒体自噬相关通路,探讨姜黄素的可能作用机制。
姜黄素是天然存在的一种生物活性多酚,具有抗氧化、清除氧自由基、抗炎、抗肿瘤等多方面药理作用[11],因其具有强大的抗炎能力,被应用于各种炎症性疾病的治疗,如糖尿病、阿尔兹海默病等[12]。有研究发现,姜黄素可改善DN大鼠肾脏细胞和尿液单核细胞趋化蛋白1(Monocyte chemotactic,MCP-1)的表达,抵抗局部炎症扩散和发展,改善大鼠肾功能[13]。短期口服姜黄素可通过上调核受体转录因子2 (Nuclear factor erythroid 2-related factor 2,Nrf-2)系统和抗炎作用进而降低糖尿病患者的蛋白尿[14]。姜黄素可增强LC3B和线粒体标志物VDAC1的共定位,改善脑缺血-再灌注诱导的线粒体自噬[15]。但是,姜黄素是否可影响高糖诱导的HK-2细胞线粒体自噬,以及可能机制未明确,仍有待研究。
在本研究中,我们以HK-2细胞为研究对象,应用高糖刺激,加用姜黄素干预。CCK-8实验用来选择姜黄素最佳药物浓度,10 μmol/L姜黄素可显著提高高糖环境下HK-2细胞活性,故后续实验选择10 μmol/L姜黄素作为干预剂量。结果发现,高糖环境可抑制HK-2细胞线粒体自噬,细胞内ROS产生增加。姜黄素对正常糖浓度的HK-2细胞无明显影响,但可改善高糖环境下HK-2细胞线粒体自噬,缓解氧化应激,具体表现为高糖环境下HK-2细胞加用姜黄素后,Pink1、Parkin、LC3Ⅱ、beclin1蛋白表达显著升高,JC-1检测细胞相对荧光强度比值升高,ROS水平减低。姜黄素对糖尿病肾病的保护机制可能为增加HK-2细胞线粒体自噬活性,激活Pink1/Parkin通路,同时对抗氧化应激。
