黄芪甲苷通过DNA甲基化调节VEGFA参与急性低氧脑损伤的保护作用*
2023-07-05杨海霞靳庆玲林家静鲍牧兰巴德仁贵
杨海霞,靳庆玲,林家静,谢 伟,鲍牧兰,巴德仁贵
[1. 包头医学院医学技术与麻醉学院(内蒙古自治区低氧转化医学重点实验室),内蒙古包头 014040;2.包头医学院基础医学与法医学院]
低氧(Hypoxia)是高原、航天航空、潜水等常面临的生命威胁的致病原因。脑是人体极为复杂的生命器官,大脑耗氧量约占机体总耗氧量的20 %,极容易受到缺氧的影响[1]。急性低氧通常引起脑水肿的发生,使脑组织能量供应不足,脑部能量代谢发生障碍。即使在缺氧缺血之后幸存的未成熟的神经元仍有受损的神经突生长和突触形成[2]。更有甚者引起神经元损伤,乃至凋亡。引起各种神经退行性疾病以及一系列的神经系统症状。
黄芪甲苷(Astragaloside,AS-Ⅳ)是中药黄芪根中的主要活性化合物,具有免疫调节、抗炎、抗凋亡、神经保护、血管重构等多种药理作用[3]。有研究发现AS-Ⅳ可以上调小鼠脑中的血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)的表达水平来促进血管新生[4],但AS-Ⅳ的调控机制还不明确,有待进一步研究。
DNA甲基化是哺乳动物体内广泛存在的一种表观遗传方式。正常水平的DNA甲基化可以维持机体内环境稳态,而当DNA甲基化水平增高或降低时则会导致神经元细胞损伤[5]。不仅如此,DNA甲基化在神经再生和重塑过程中也发挥重要作用[6]。有研究发现,在低氧条件下,脑组织内的DNA甲基化水平会发生异常升高或降低[7],导致神经损伤发生。常见的调控DNA甲基化水平的酶是DNA甲基化转移酶1(DNA methyltransferase 1,DNMT1)、DNA甲基化转移酶3A(DNA methyltransferase 3A,DNMT3A)、DNA甲基化转移酶3B(DNA methyltransferase 3B,DNMT3B)。而相关研究表明黄芪甲苷具有神经保护的作用,那么这种保护作用是否是通过改善相关保护因子启动子区域的甲基化水平实现的,有待研究证实。
VEGFA是一种血管内皮生长因子,可以促进血管生成和调节血管生成中的细胞增殖、迁移存活和血管通透性[8,9]。各种研究证实VEGFA对中枢和周围神经系统有直接的保护作用[10]。缺氧可以通过缺氧诱导因子(hypoxia inducible factor-1,HIF)调节VEGFA的表达。但是黄芪甲苷是否可以通过调控DNA甲基化调控VEGFA的表达来发挥神经保护作用?这一调控机制尚不清楚。因此,本文通过研究黄芪甲苷对急性低氧后细胞的DNMTs表达水平的调节来探究这一机制,为后续进一步研究黄芪甲苷的神经保护机制提供更多依据。
1 材料与方法
1.1主要仪器 低温离心机(5424R,Eppendorf),恒温摇床(MaxQ 5000恒温冷摇床,Thermo公司),酶标仪(Multiskan FC酶标仪,Thermo公司),金属浴(K30,杭州奥盛仪器有限公司),电泳仪(BIO-RAD公司),转膜仪(Trans-Blo,BIO-RAD公司),实时荧光定量PCR仪(7900HT,Applied Biosystems公司),荧光倒置显微镜(TE2000-U,Nikon公司),二氧化碳培养箱(FORMA STERI-CYCLEi160,Thermo公司)。
1.2药品与试剂 黄芪甲苷,购自上海麦克林生化科技有限公司,规格:100 mg,纯度≥98.5 %,货号:A800922-100 mg ;小鼠的海马神经元细胞(HT22细胞,北京协和细胞中心);BCA浓度定量试剂盒(美国Thermo公司);抗氧化剂(美国Invitrogen公司);PVDF膜(中国Roche公司);10×TBS、吐温20(中国利维宁公司);Trizol裂解液(美国Life technologies公司);反转录试剂盒、SYBR Green mix、引物(上海生工生物有限公司);DNMT1、DNMT3A、DNMT3B、β-actin一抗(1∶1000稀释,CST)、96孔板、二抗、DMEM、FBS(美国Gibco公司)。
1.3药品的处理 称取20 mg AS-Ⅳ溶于200 μL的DMSO中,用适量DMEM定容,混匀,配制成10 mmol/L的母液,-20 ℃保存。后续使用时按梯度稀释1 000倍得到工作液。
1.4细胞培养、分组与给药 将HT22细胞置于10%的胎牛血清及1 %青霉素/链霉素混合溶液的DMEM培养基中,在37 ℃、5 %CO2的培养箱中培养。收集对数生长期细胞,分为对照组(Control)、低氧组(Hypoxia,低氧13 h复氧6 h)、黄芪甲苷组(H+AS-Ⅳ,低氧13 h后于复氧的同时给予100 μmol/L AS-Ⅳ处理)。
1.5荧光倒置显微镜观察不同分组细胞形态变化 将100 μL的细胞悬液接种于直径50 mm的培养皿中,37 ℃、5 % CO2预培养24 h。待细胞完全贴壁后,将低氧组和黄芪甲苷组细胞置于低氧盘里低氧13 h,低氧组复氧6 h后置于荧光倒置显微镜下观察细胞形态,黄芪甲苷组于复氧的同时给予100 μmol/L的黄芪甲苷处理,24 h后置于荧光倒置显微镜下观察细胞形态变化。并利用胰酶消化处理收集细胞置于-20 ℃保存以供后续实验。
1.6Real-time PCR 向细胞沉淀中加入Trizol,按照说明书步骤利用Trizol法提取总RNA,使用利维宁公司反转录试剂盒将 RNA反转录为cDNA,-20 ℃ 保存。引物由上海生工生物有限公司合成DNMT1、DNMT3A、DNMT3B、VEGFA和β-actin基因,引物的设计见表 1。

表1 Real-time 基因引物序列
1.7Western blot 检测相关蛋白的表达水平 RIPA裂解液裂解细胞并向其中加入蛋白酶抑制剂,4 ℃/12 000 r/min离心15 min,收集上清液即为蛋白原液。BCA法检测蛋白浓度,并向蛋白原液中加入相应比例的抗氧化剂和Lodding Buffer,金属浴100 ℃/5 min。蛋白上样量为10 μg,进行SDS-PAGE电泳,后转移至PVDF膜上,5 %脱脂牛奶室温孵育1.5 h,0.1 %的 TBST 85 r/min15 min洗3次。4 ℃过夜孵育DNMT1、DNMT3A、DNMT3B、β-actin一抗(1∶1 000稀释)。回收一抗,0.1 %的 TBST 85 r/min15 min洗3次,分别用驴抗兔、山羊抗鼠二抗室温孵育1.5 h,0.1 %的 TBST 85 r/min15 min洗3次。用ECL发光液浸泡,化学成像仪检测、分析。
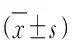
2 结果
2.1HT22细胞在不同状态下形态变化 荧光倒置显微镜下观察到Control组HT22细胞数量多且胞体大而亮,贴壁紧密,细胞膜边界清晰,触角细长,细胞与细胞之间以触角连接。与Control组相比, Hypoxia组细胞胞体变小,整体晦暗无光,细胞数目减少,且贴壁性不好,细胞膜边界模糊,细胞触角变短,细胞与细胞之间聚团出现。与Hypoxia组相比, H+AS-Ⅳ组细胞有所改善,胞体稍大,细胞触角变长,细胞数目中等,贴壁性良好,死亡细胞数目减少。见图1。

图1 HT22细胞不同状态下形态变化注:A:Control组;B:Hypoxia组;C:H+AS-Ⅳ组
2.2不同处理组HT22细胞中的DNMTs在mRNA表达水平上的变化 与Control组相比,Hypoxia组HT22细胞中的DNMT1、DNMT3A mRNA表达下降(P<0.05),DNMT3B mRNA表达上升(P<0.05)。与Hypoxia组相比,H+AS-Ⅳ组DNMT1、DNMT3A mRNA表达无变化(P>0.05),DNMT3B mRNA表达下降(P<0.05)。见图2。

图2 不同处理组HT22细胞中DNMTs在mRNA表达水平上的变化注:A:DNMT1,B:DNMT3A,C:DNMT3B;* P<0.05,** P<0.01
2.3不同处理组HT22细胞中的DNMTs在蛋白表达水平上的变化 与Control组相比,Hypoxia组HT22细胞中的DNMT1、DNMT3A蛋白表达量下降(P<0.05),DNMT3B蛋白表达上升(P<0.05)。与Hypoxia组相比,H+AS-Ⅳ组DNMT1、DNMT3A蛋白表达无变化(P>0.05),DNMT3B蛋白表达下降(P<0.05)。见图3。

图3 不同处理组HT22细胞中DNMTs在蛋白表达水平上的变化注:A:DNMT1,B:DNMT3A,C:DNMT3B;** P<0.01
2.4不同处理组HT22细胞中的VEGFA在mRNA表达水平上的变化 与Control组相比,Hypoxia组HT22细胞中的VEGFA mRNA表达下降(P<0.05)。与Hypoxia组相比,H+AS-Ⅳ组VEGFA mRNA表达上升(P<0.05)。见图4。

图4 不同处理组HT22细胞中VEGFA在mRNA表达水平上的变化注:** P<0.01
3 讨论
氧气的存在对于大脑的正常工作十分重要,因为它是能量产生必备因素,脑组织对能量的需求是极大的[11]。当缺氧时,不仅会引起脑组织水肿,活性氧增多,长期缺氧也会导致有缺陷的血管生成,而这种血管会限制血流量,使向大脑输送的营养物质和氧气减少,导致神经系统残疾[12]。当机体缺氧时,机体激活HIF转录家族,其中HIF-1在调节血管内皮生长因子中起着重要作用。HIF和其他缺氧调节因子包括表皮生长因子 (Epidermal growth factor,EGF),血小板衍生生长因子 (Platelet derived growth factor,PDGF) 协调VEGF的表达,进而调节VEGF驱动的信号[13]。在本文结果中,低氧13 h,复氧6 h之后,HT22细胞中的VEGFA表达水平下降,可能是因为缺氧时间已经超过了神经元细胞的代偿能力。在神经元失代偿的情况下,已经对神经元细胞造成了不可逆的损伤。大量文献证明缺氧会引起许多基因不同程度的甲基化。Lain等人[14]通过RNA-Seq发现,在缺氧后四天细胞状态有所恢复,并且大部分基因启动子区域的DNA甲基化减少,相关基因表达上调。与之相对应的是,在急性缺氧后细胞的神经元树突长度显著低于对照组,许多基因启动子区域的甲基化水平升高,并且随着缺氧时间的增加而增加[15]。Xu等人[16]研究发现,对PCl2细胞给予氧糖剥夺刺激时,引起神经元细胞中的miR-422a积累,而引起这一结果是因为Lnc-D63785 m6A甲基化。同样有研究证实,抑制m6A甲基化可以保护神经元免受缺血再灌注损伤[16]
黄芪甲苷作为一种中药成分,被人们广泛应用治疗各种疾病。大量文献证明它可以促进神经突触再生,增加血脑屏障通透性[17]。它不仅具有神经保护作用,而且在心血管、肾、肺、抗肿瘤等方面都发挥重要作用[18,19]。Li等人[20]通过研究证实黄芪甲苷不仅可以消除缺血脑中NK细胞介导的对缺氧葡萄糖剥夺神经元的溶细胞杀伤,还通过STAT3抑制脑缺血后NK细胞的浸润和激活,发挥对急性缺血性脑损伤的保护作用。VEGF不仅能促进血管再生,还可以在体内体外广泛地促进神经发生,神经元迁移和存活。Khaibullina等人[21]研究发现VEGF可以增加神经突数目、长度和大小。VEGF可以独立于神经胶质直接影响神经元。而且许多体内实验也证实了VEGF在调节神经祖细胞增殖、存活、迁移、轴突/树突状结构和突触功能中的直接和重要作用。本研究发现,黄芪甲苷处理后VEGFA表达量上升,这表明,黄芪甲苷可能是通过上调VEGFA的表达来保护小鼠的海马神经元细胞。DNA甲基化是一种经过充分研究的表观遗传变化,DNA高甲基化导致转录抑制,而低甲基化导致转录激活[22]。Li等人[23]研究发现低氧3 h和6 h STAT3和VEGF启动子区域的甲基化水平明显低于常氧组,与之相应的是STAT3和VEGF的表达水平高于常氧组。尽管结果与本研究有所出入,但是都表明低氧确实会引起VEGF启动子区域的甲基化水平发生改变。不过低氧时间的长短不同也可能导致基因的表达水平发生变化。
本研究发现,低氧时DNMT3B表达升高,而黄芪甲苷处理后DNMT3B表达下降,与之对应的是VEGFA在低氧后表达下降,黄芪甲苷处理后表达上升。结果提示,黄芪甲苷的作用机制有可能是通过下调VEGFA启动子区域的甲基化水平来实现的。但这一保护机制仍然十分复杂,需要今后进一步探究验证。
