苗药血人参化学成分和药理作用研究进展及Q-marker的预测分析
2023-07-05廖泽宇傅建付慧晓何鑫徐剑吴静澜张永萍
廖泽宇 傅建 付慧晓 何鑫 徐剑 吴静澜 张永萍


【摘要】血人参(Indigofera stachyoides Lindl.)作为我国苗族传统用药,主要分布于贵州、云南、广西等地区。血人参的主要化学成分包括黄酮类、糖苷类、甾醇类、萜类、酚酸类以及挥发油类等,其药理作用有保肝、抑菌、降血糖、降血脂、抗肿瘤、抗氧化及抗炎等。文章对血人参的化学成分和药理作用的研究进行归纳与总结,并结合Q-marker概念,从植物亲缘学、化学成分特有性、传统功效和药性、现代临床新用途、化学成分可测性等几个方面对其进行Q-marker预测分析。根据Q-marker的概念,可将木脂素糖苷类成分血人参苷、Schizandriside、Lyoniside和血人参鞣质A作为血人参的Q-marker,将黄酮类作为其备选物质。
【关键词】血人参;化学成分;药理作用;质量标志物
【中图分类号】R285.5【文献标志码】 A【文章编号】1007-8517(2023)12-0037-11
Research Progress on Chemical Constituents and Pharmacological Effects of
Indigofera stachyoides Lindl.and Predictive Analysis of Q-markerLIAO Zeyu FU Jian FU Huixiao HE Xin XU Jian WU Jinglan ZHAGN Yongping
1.School of Pharmacy, Guizhou University of Traditional Chinese Medicine/National Miao Medicine Engineering
Technology Research Center/Guizhou Traditional Chinese Medicine Processing and Preparation
Engineering Technology Research Center,Guiyang 550025,China;
2.The First Peoples Hospital of Guiyang City, Guiyang 550002,ChinaAbstract:Indigofera stachyoides Lindl.is a traditional medicine of the Miao nationality in China, it is mainly distributed in Guizhou, Yunnan, Guangxi and other regions.It contains a variety of chemical components, includingsterols, terpenoids, phenolic acids, volatile oilsand other components,with liver protection, anti-tumor, hypoglycemic properties, blood lipid lowering, antibacterial, anti-oxidation, anti-inflammatory and other broad pharmacological activities.Herein, we summarized the research on the chemical components and pharmacological effects of Indigofera stachyoides Lindl.and combined the Q-marker concept, from plant phylogeny, specificity of chemical components, traditional efficacy and medicinal properties, modern clinical new uses, and measurability of chemical components Q-marker predictive analysis is carried out in several aspects.According to the concept of Q-marker, 9-O-acetyl-9′-O-β-D-xylopyranoside, Schizandriside, Lyoniside andStachyotannin A can be used as Q-markers of Indigofera stachyoides Lindl., and flavonoids can be used as alternative substances.
Keywords:Indigofera stachyoides Lindl.;Chemical Constituents;Pharmacological Effects;Quality Markers血人參为豆科木兰属植物茸毛木蓝Indigofera stachyoides Lindl.的根,全年均可采挖,去掉粗皮鲜用或晒干用,是贵州苗族的传统用药,2003年版《贵州省中药材民族药材质量标准》收载品种[1],该药甘、微苦、温,归肝、肾、大肠经,功擅利血、利湿、化痰、解表。用于伤风发热、头痛、妇女腹痛、血崩、痈疽、淋浊。《贵阳民间药草》记载其“涩微苦,平,无毒”[2],具有补血活血效用。《中华本草》记载其具有清热解表、活血止痛、化痰利湿的功效,主治肝硬化、肠风下血、体虚久痢、跌打损伤等证[3]。
近年来,血人参野生资源日渐匮乏,市场上血人参的质量良莠不齐,在质量控制方面存在药效物质不清晰、质量评价指标单一、质量控制体系不完善、传统功效与物质基础的关联性不强等问题[4-5]。因此,如何有效控制血人参的质量成为亟需解决的关键问题。基于此,本研究通过对血人参的化学成分和药理作用的研究进展进行综述,根据中药的质量标志物(Q-marker)理论,对血人参中存在的潜在Q-marker进行初步预测,为建立血人参的质量控制体系、保障临床用药安全提供参考依据。
1化学成分
血人参中含有多种化学成分,主要含有黄酮类、糖苷类、萜类、甾醇类、酚酸类和挥发油等。
1.1黄酮类血人参中主要包含黄酮类、黄酮醇类、二氢黄酮类、异黄酮类等。骆瀚超[6]通过单因素考察和正交试验优化从血人参中提取得到纯度为43.29mg/g总黄酮。详见表1,如图1所示。
1.2糖苷类目前木蓝属植物的特征化学成分之一是3-硝基丙酰基葡萄糖类化合物(3-NPG),它是一种白色的有毒物质[18]。迄今为止,已从其他木蓝属植物中分离出13种此类化合物,主要包括3-硝基丙酸和3-硝基丙酰基吡喃葡萄糖的一、二、三、四取代物等,其中包括α-吡喃葡萄糖的取代物和β-吡喃葡萄糖的取代物两大类型[19]。从血人参中分离得到的糖苷类化合物详见表2、图2。
1.3三萜及甾醇类从血人参中分离鉴定出4种三萜类化合物,分别为熊果酸、桦木酸[14]、白桦脂酸[16]、β-香树精、羽扇烯酮[7,14],此外血人参中甾醇类成分主要含有β-谷甾醇、羽扇豆醇[7,14]、Daucosterol[14]、豆甾烷-3-酮、豆甾-4-烯-3-酮[7,14,16,18]、豆甾醇[11,13,20]等。
1.4酚酸类血人参中酚酸类包括2α,3α-epoxy-5,7,3′,4′-tetra-hydroxyflavan-(4β→8)-epicatechin[6],原儿茶酸(Protocatechuic acid)、没食子酸(Gallic acid)、原儿茶醛(Protocatechuic aldehyde)、龙胆酸(Gentisic acid)[8]。张云封等[21]分离鉴定出10个缩合鞣质类成分:Epicatechin-(2β→O→7,4β→8)-epiafzelechin-(4β→8)-catechin、肉桂鞣质D1、肉桂鞣质B1、Epicatechin-(2β→O→7,4β→8)-epiafzelechin-(4α→8)-epicatechin、Gambiriin C、原花青素A1、原花青素A2、Aesculitannin B、原花青素A4、原花青素B5以及1个新化合物血人参鞣质A(如图3所示)。
1.5挥发油田璞玉等[22]采用HS-SPME-GC-MS技术分析茸毛木蓝地上部分(茎、叶)和地下部分(血人参)挥发性成分,结合保留指数法和峰面积归一化法測定其相对百分含量,从茸毛木蓝的地上部分(茎、叶)鉴定出35种成分,从血人参中鉴定出21种成分,二者含有12个相同成分,其脂肪烃类是茸毛木蓝挥发性成分中的重要组成物质。王小果等[23]对动态顶空密闭循环吸附法捕集到的茸毛木蓝花和根的挥发性成分,采用ATD-GC-MS联用技术进行其分析检测以及峰面积归一化法计算其相对含量。从血人参的挥发物中检测出13种化合物,其中醇类含量最高可达32.96%,其次为烯烃类31.78%,推断血人参的主要芳香物质是醛类、萜烯类化合物。
1.6其他除上述成分外,血人参中还含有其他成分,如蒽醌类、内酯及香豆素类。马艳妮等[24]通过对血人参的化学成分进行定性检测,初步确定血人参中可能含有以上成分。
2药理作用
现代药理作用表明,血人参具有保肝、抗肿瘤、抗氧化、抗炎、抑菌、降血糖和降血脂等多种药效。见表3。
2.1保肝作用李园园等[12]通过采用CCl4诱导的肝损伤小鼠模型来进行血人参的保肝作用的研究。与模型组相比,ISREA(200 mg/kg)、ISRBU(1000mg/kg)、ISRBU(500 mg/kg)各给药组均能显著降低急性肝损伤小鼠血清中谷丙转氨酶和谷草转氨酶的水平(P<0.001,P<0.05),其中ISREA(200 mg/kg)效果最好。ISREA和ISRBU各剂量组均能显著升高肝损伤小鼠肝组织中的SOD水平并显著降低MDA的含量(P<0.05),其中ISRBU(500 mg/kg)效果最好(P<0.001)。乙酸乙酯组分和正丁醇组分对CCl4诱导的急性肝损伤小鼠具有很好的保护作用。朱新宇等[20]通过对血人参的不同部位进行保肝活性筛选,将特征显色剂以及各种色谱方法结合来区分乙酸乙酯提取物中的化合物并鉴定出11种化合物,并进行体外研究发现其具有良好的保肝活性。杨宇莎等[25]在已有研究基础上继续深入研究,对CCl4、乙酰氨基酚(APAP)以及Dgal致小鼠急性肝损伤进行分组别的筛选,发现血人参具有保肝作用,未发现具有明显的肝毒性。雷钟等[26]通过对CCl4造成的小鼠肝损伤模型皮下给药的方式,发现血人参的乙酸乙酯部位具有明显的保护作用(P<0.05),证明2α,3α-epoxyflavan-5,7,3′,4-tetraol-(4β→8)-flavan-5、2α,3α-epoxy-5,7,3′,4′-tetrahydroxyflavan-(4β→8)-epicatechin和Schizandriside是血人参保肝活性的有效化学成分,能够保护CCl4诱导的人肝HL-7702细胞损伤(P<0.05),HL-7702细胞存活率亦有明显的提升。
2.2抗肿瘤作用裘璐等[10]从血人参醇提物的乙酸乙酯部位中分离鉴定出化合物Schizandriside、Lyoniside和表儿茶素,其中Schizandriside和Lyoniside是木脂素糖苷类化合物,根据文献[27]有关记载,Lyoniside具有良好的清除DPPH自由基能力,并且具有抗肿瘤的药理作用;黄酮类化合物—表儿茶素,根据文献[28]记载其是绿茶中儿茶素类化合物的单体之一,能够有效地抑制抗癌药物的流出,增强对癌细胞的杀灭作用,而且能减少抗癌药物的毒副作用,作为化疗和放疗的辅助手段之一。段丽等[29]科学合理的建立受试动物4T1肿瘤模型,对相应的动物模型给予石油醚、乙酸乙酯、正丁醇、水萃取组分和乙醇提取物,观察药物作用发现可通过提高T细胞生长因子水平来抑制肿瘤生长,乙酸乙酯组分效果最好。王雷鸣[30]通过动物实验,发现血人参能减弱对环磷酰胺的作用,增加实验小鼠白血球数量,同时充分降低了环磷酰胺对肝脏的毒性作用。傅建等采用血人参不同提取部位针对K562和Hela肿瘤细胞进行增殖筛选,发现血人参各组分对K562细胞显示出较弱的抑制作用;对宫颈癌Hela细胞有显著的抑制作用(未发表数据)。详见表4。
2.3降血糖、降血脂作用Li等[31]以血人参提取物为试验材料,使用2,2-diphenyl-1-picrylhydrazyl(DPPH),2,2-azinobis(3-ethyl-benzothiazoline-6-sulfonic acid)(ABTS)和铁还原抗氧化剂能力(FRAP)测定方法以及96微孔板的体外方法测试血人参中乙酸乙酯、石油醚和正丁醇三种提取物对α-葡萄糖苷酶的抑制作用研究,相较于糖尿病对照组,正丁醇部位可以通过对大鼠口服降低空腹血糖和餐后血糖,并使用CCl4诱导的糖尿病大鼠确定体内血人参的降血糖作用,结果表明血人参的正丁醇部位对糖尿病及其并发症具有显著的治疗作用。吴小峰等[32]将阿卡波糖作为阳性对照组,采用酶活性抑制率来评估血人参的醇提物对α-葡萄糖苷酶的抑制活性。随着浓度逐渐增加,血人参对α-葡萄糖苷酶的抑制作用要高于阿卡波糖,因此血人参可作为潜在的新型降血糖药物来开发。傅建,田璞玉等[14,22]从血人参中提取分离得到棕榈酸甲酯,根据文献[33]报道,棕榈酸具有降血脂、抗血小板凝聚、抗血栓、抗动脉粥样硬化等作用,说明血人参具有潜在的降血糖和降血脂的作用。
2.4抗氧化作用Li等[29]采用包括清除DPPH、ABTS自由基和FRAP还原Fe3+在内的三种方法[34]测定血人参石油醚、乙酸乙酯和正丁醇三种提取物的抗氧化功能,发现正丁醇和乙酸乙酯组均呈现出较好的抗氧化能力,且乙酸乙酯部位的活性最强。吴小峰等[32]采用紫外分光光度法测定茸毛木蓝的地上部分和地下部分乙醇提取物中总黄酮化合物的含量,采用DPPH和羟基自由基清除体系评价其体外抗氧化活性,证明DPPH和羟基自由基清除体系的清除效果与提取液质量浓度间存在量效关系,其清除效果随着提取物中总黄酮含量的增加而增强,血人参的总黄酮化合物可清除自由基,可作为天然抗氧化剂。何金英等[35]研究血人参提取物对半乳糖联合亚硝酸钠致衰老小鼠模型抗氧化能力的影响,证明血人参乙酸乙酯高剂量组能提高血清、脑及各脏器组织中的SOD与GSH-Px活性,降低部分组织中MDA含量,抑制脂质过氧化物的形成而起到延缓衰老的作用。
2.5抑菌作用傅建等[36]以大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、白色念珠菌为受试菌株,先后用硅胶柱层析和聚酰胺柱层析对血人参总黄酮进行分离富集。采用K-B纸片法和平板二倍稀释法测试血人参各组分的抑菌圈大小和最低抑菌浓度(MIC),发现其除枯草芽孢杆菌外,前者分离得到的6种组分对4种菌株均有抑菌活性,而后者富集所得黄酮类化合物纯度可达到(64.2±0.3)%,MIC分别是大肠杆菌(0.625 g/L)、金黄色葡萄球菌(0.3125 g/L)、白色念珠菌(0.25 g/L),由此证明血人参总黄酮部位有明显的体外抑菌活性。血人参的同属植物野木蓝(IndigoferaSuffruticosa)的叶片各种有机和水提取物,通过琼脂固体扩散法,分别针对5种不同种类的人类致病细菌和17种真菌菌株进行了测试,筛选其浸液和浸渍液的抗菌和抗真菌活性。发现其水提物显示出对革兰氏阳性菌金黄色葡萄球菌有较强的抑制作用,该研究表明其水提取物可用于治疗由皮肤癣菌引起的皮肤疾病[37]。
2.6抗炎作用赵鸿宾等[38]针对血人参的乙酸乙酯提取物,通过小鼠浓氨水引咳实验和酚红祛痰实验研究,发现其具有止咳祛痰的作用。但成丽等[39]通过切断斑马鱼的尾巴构建巨噬细胞聚集的炎症模型。利用绿色荧光蛋白(EGFP)标记斑马鱼模型(Zlyz-EGFP),除水层外,血人参的其他极性部位对斑马魚急性炎模型均有显著影响,其向损伤部位的迁移和集聚受到明显抑制,经过进一步的研究,血人参中石油醚层和乙酸乙酯层的抗炎活性最为显著。秦帅等[40]应用Zlyz-EGFP活体高通量筛选抑制斑马鱼巨噬细胞的迁移和聚集,并通过二甲苯致小鼠耳肿胀实验和蛋清致小鼠足跖肿胀急性炎症模型验证其抗炎作用,发现血人参乙醇提取物能显著抑制斑马鱼巨噬细胞向急性损伤部位的迁移和聚集(P<0.05),并显著抑制两种小鼠模型的急性炎症反应(P<0.01),由此证明血人参醇提物可抑制斑马鱼巨噬细胞向急性损伤部位迁移和聚集,具有显著的抗炎作用。王文萱等[41]研究血人参中异甘草素的抗炎作用及其机制,发现其能够通过抑制JNK1/2、ERK1/2和STAT1信号通路抑制巨噬细胞和中性粒细胞的功能,从而发挥抗炎作用。
3血人参Q-marker预测分析
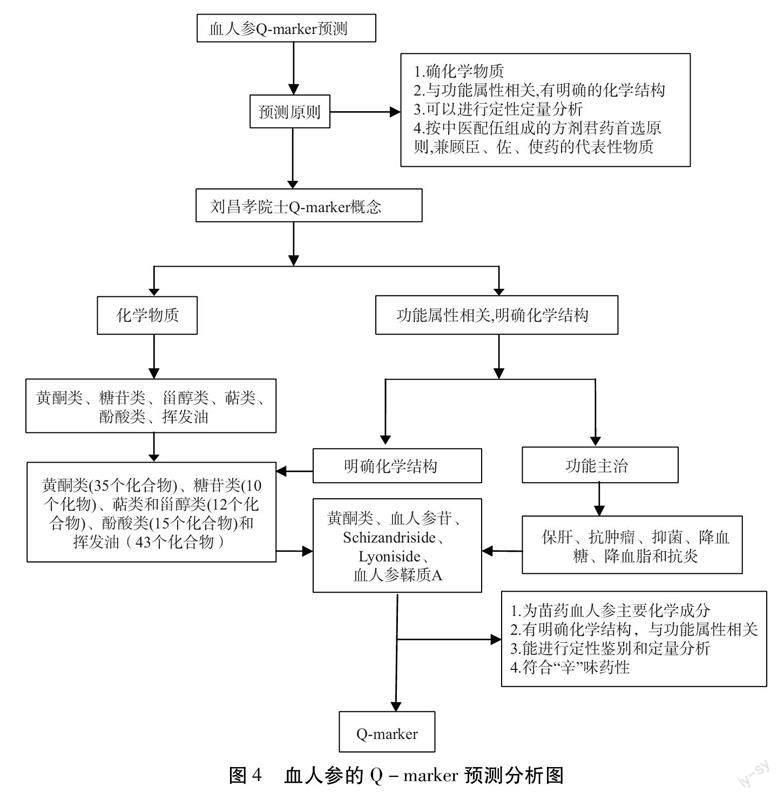
Q-marker是刘昌孝院士以完善中草药体系所提出的中药质量控制新概念,其核心内容主要与中草药的功能特性有关,而中草药的功能特性是中草药及其产品所独有的,或者在加工过程中出现的,与中草药的功能属性相契合的化学物质,中草药的安全性和有效性的标示性物质是标准化其质量研究和中草药标准的基础[42-43]。因此,本文通过文献总结分析,围绕Q-marker的理念,对血人参的质量标志物进行预测分析,为血人参的质量控制方法提供参考和依据。如图4所示。
3.1基于植物亲缘学及化学成分特有性的Q-marker预测分析按照植物亲缘学概念,血人参是《贵州省中药材民族药材质量标准》收载品种,主要分布在贵州的西南方向,其中在独山、荔波、三都和凯里等地发现了有近缘易混种,主要包括黔滇木蓝(Indigofera esquirollii Lévl),黔滇木蓝与茸毛木蓝主要区别为黔滇木蓝的根刮去外皮后呈现白色,木质部横切呈现为淡黄色,茸毛木蓝的根(即血人参)刮去外皮后呈现红棕色,木质部为暗红色或黄白色[44]。血人参中包含多种化学成分,包括酚酸类、黄酮类、糖苷类、甾醇类等化学成分,目前认为黄酮类和木脂素类成分是木蓝属植物的主要药效成分,是木蓝属植物的重要化学标志物。裘璐等[10]采用硅胶、葡聚糖凝胶色谱等方法及重结晶技术分离纯化茸毛木蓝根醇提物的乙酸乙酯萃取液部分,首次从木蓝属植物中分离鉴定出血人参中含有木脂素糖苷类化合物Schizandriside和Lyoniside,其指标成分量明显高于非药用部位。傅建等[14]从血人参中发现了一个新化合物,通过与文献[27]的光谱数据对照,发现其与已知化合物Schizandriside相似,但比文献中的化合物(Schizandriside)多了一个乙酰基,经SciFinder数据库检索后证实为新化合物,命名为血人参苷。张云封等[21]首次从血人参中分离鉴定出1个新缩合鞣质类化合物,命名为血人参鞣质A,故木脂素糖苷类化合物中血人参苷、Schizandriside、Lyoniside和酚酸类化合物血人参鞣质A可作为血人参药材Q-marker的参考。
3.2基于传统功效Q-marker预测分析血人参又名铁刷子(《贵州民间方药集》)[45]、山红花、红苦刺(《云南中草药》)[46]。血人参味辛,微苦,性温,入肺、脾经,民间多用于治疗创伤、伤风发热、小儿痰哮、肝硬化等。根据中药传统功效与现代药理作用的关系,现代研究[47-48]表明,血人参中木脂素类成分血人参苷、Schizandriside和Lyoniside具有拮抗血小板、抑菌、抗肿瘤和保肝等作用,黄酮类成分具有抗肿瘤、抗炎和抗氧化等作用,鞣质类成分具有抗肿瘤、抑菌、降血糖以及调血脂等作用[49],其与血人参的传统功效基本相一致,是血人参传统功效的主要物质基础依据,木脂素糖苷类化合物中血人参苷、Schizandriside、Lyoniside,酚酸类化合物中血人参鞣质A和黄酮类化学物质可作为血人参Q-marker的选择参考。
3.3基于传统药性Q-marker预测分析中药的性味归经是中医药的基本属性,《素问·藏气法时论》言辛味药,为“辛散”,汪昂言“辛者能散能润能横行”,血人参味辛,微苦,性温,入肺、脾经。按照中药药性理论,“辛”味药功效具有发散解表、行气止痛、舒经活血的作用,从“辛”味药与归经的关系中可以看出,其主要归入肺,脾经[50],其化学成分包括酚酸类、黄酮类和木脂素类等。根据以上分析,黄酮类、血人参苷、Schizandriside、Lyoniside和血人参鞣质A应该是其“辛”味的主要物质基础,可以将其作为血人参Q-marker的选择参考。
3.4基于现代临床新用途Q-marker预测分析以血人参为主成分的芪胶升白胶囊[51],可用于治疗肿瘤放化疗后引起的肝肾损伤和白细胞减少症,有辅助抗肿瘤的功效,减少化疗的毒副作用,保护正常的体细胞,改善患者生存质量。代春美等[52]以S180荷瘤小鼠为动物模型,随机分为5组,用芪胶升白胶囊与环磷酰胺联合用药后,15 d后发现小鼠肿瘤体积减小,抑瘤率和脏器指数升高,说明两药联合使用可以增强环磷酰胺抑制肿瘤增长,从而起到增效减毒的作用。龚春梅等[53]对经病理或细胞学诊断证实的Ⅲ-Ⅳ期乳腺癌患者分为单纯化疗组(95例)和联合组(98例)进行研究,在化学疗法的基础上,同时口服芪胶升白胶囊。与单纯化疗组相比,联合化疗组可以显著改善晚期乳腺癌患者的骨髓功能。丁荣媚等[54]选取肺癌放疗患者,据统计分析,芪胶升白胶囊可以增加放疗后肺癌患者的白细胞,改善放疗效果,保护骨髓,改善生活质量。薛妍等[55]观察60例新诊断的乳腺癌患者化疗后的骨髓抑制和生活质量,发现芪胶升白胶囊可以减少白细胞。武新虎等[56]对90例同步放化疗晚期鼻咽癌患者进行观察研究,发现芪胶升白胶囊可有效保护骨髓功能、防止白细胞下降、提高外周白细胞计数。赵同德等[57]招募260例化疗患者。根据脱落率不超过20%,纳入患肺癌和乳腺癌的312例患者。采用中央随机法,按2∶1的比例随机分为治疗组和对照组。结果发现,化疗前基线白细胞(WBC)为3.5×109/L~4.0×109/L的患者,治疗组在(10±1)天的白细胞水平要明显高于对照组,证明其可预防化疗相关的白细胞减少症。黄钒等[58]采用136例Ⅱ/Ⅲ期可切除中低位直肠癌患者,给予常规长程放疗+卡培他滨同步化疗,实验组加用芪胶升白胶囊治疗,比较两组治疗期间血常规、骨髓抑制发生情况,发现治疗期间实验组骨髓抑制总的发生率(42.64%)明显低于对照组(73.52%),且Ⅲ+Ⅳ期的发生率(5.88%)也低于对照组(17.65%),证明芪胶升白胶囊能够减轻中低位直肠癌患者术前同步放化疗后骨髓抑制。许欢等[59]通过研究血人参及其制剂对“气弱血弱体弱”冷病模型小鼠的作用,发现芪胶升白胶囊高剂量组脾指数高于模型组,小鼠血清ATP、cAMP、cGMP含量降低(P<0.05),證明其有一定改善作用。目前芪胶升白胶囊化学成分组以及各成分药理活性尚未被完全阐明,质量控制水平较低。王倩等[60]明确在芪胶升白胶囊中黄酮类成分分离效果好,其主要来自于血人参。研究表明,木脂素类、鞣质类和黄酮类化合物均具有抗肿瘤、保肝等作用,因此可考虑将木脂素类、酚酸类和黄酮类成分作为血人参Q-marker的选择参考。
3.5基于化学成分可测性的Q-marker预测分析目前,血人参化学成分的测定主要通过采用各种色谱法来分析测定,因此血人参的Q-marker必须能在常用色谱法上进行定性定量,以便于今后的科学研究和建立健全科学的质量评价体系。根据以上分析,血人参中的木脂素、鞣质类和黄酮类化学成分可以作为血人参Q-marker的重要选择,马艳妮等[61]从各种来源收集血人参药材样品,使用2020版《中国药典》[62]四部通则中0502薄层色谱法以及2201浸出物测定法中的醇溶性浸出物测定法来鉴定槲皮素,证实可以通过识别薄层色谱来检测血人参药物中的槲皮素,发现血人参中的水分含量不超过10.4%;总灰分不超过5.5%;酸不溶性灰分不超过4.1%;醇溶性提取物的量超过14.5%。黄酮的总含量通常是通过采用较低特异性的270 nm下UV分光光度法确定,但其专属性较差[63]。骆瀚超等[64]发现血人参在410~420 nm处显示有最大吸收,因此,使用三氯化铝络合物显色法可以更加专属性地对黄酮类化合物进行定性和定量分析,最终选定413 nm作为测定波长。朱新宇等[65]建立以表儿茶素、2α,3α-epoxy-5,7,3′4′-tetrahydroxyflavan-(4β→8)-epicatechin为对照品(浓度:1 mg/mL,点样量2 μL),在GF254薄层板上,以氯仿-甲醇-甲酸(30∶10∶1)为展开剂,展开后晒干,喷5%硫酸乙醇,于105℃加热至斑点显示的TLC鉴别方法。骆翰超[6]建立以儿茶素、Schizandriside、2α,3α-epoxy-5,7,3′4′-tetrahydroxyflavan-(4β→8)-epicatechin为对照(浓度:1 mg/mL,点样量4μL)的TLC鉴别方法。李军等[66]通过UPLC/Q-TOF-MS技术从血人参中鉴定出14种类黄酮成分,通过类黄酮靶标代谢组学技术分析鉴定出62种类黄酮成分,明确原花青素B2、儿茶素、表儿茶素、表儿茶素没食子酸酯等4种成分是血人参中的主要类黄酮物质。黄酮类成分作为广泛存在于自然界且具有多种生物活性的一类重要化学成分,木蓝属植物中均有存在,且含量庞大,不适合选作血人参单一成分Q-marker,可考虑将其作为Q-marker的备选物质。因此,需同时选择血人参中的特定物质和活性物质,且易于通过现在的色谱分析方法来进行成分的测定,将其作为血人参的Q-marker。2019版的《贵州省中药材民族药材质量标准》中对于血人参质量标准的特有化学成分无明确记载。经过笔者综合整理以及论证分析,可以考虑将血人参中的木脂素糖苷类成分血人参苷、Schizandriside、Lyoniside和酚酸类成分中的血人参鞣质A作为血人参的Q-marker,黄酮类作为血人参Q-marker的备选物质。
4结语
本文根据中药Q-marker的概念,围绕化学成分、药理活性、传统功效与性味以及新临床用途等相关文献,对血人参质量标志物的筛选和确定进行了系统性的分析和论证。尽管目前学者对血人参的研究取得了一定的研究成果,但血人参相关制剂开发仍存在诸多瓶颈,如药效物质研究不够明确,导致血人参的后续开发利用受到限制。血人参作为我国苗族传统用药,在苗族地区药用历史悠久,药效显著,具有广泛的药理活性,因此具有“廉、奇、简、效、鲜”等特点。随着现代研究的不断深化,中药Q-marker的研究途径和可复制的模式方法越来越全面和完善,但受多种客观因素影响,至今对苗医药的基础研究仍存在不足,也极大地影响着苗医药的发展。因此,亟需效仿中药Q-marker的方法来确立苗药的质量控制方法,正确运用中医药理论体系来指导血人参的质量控制研究和合理开发,这是目前苗医药乃至整个民族医药最迫切需要解决的关键所在[67-68]。因此建立血人参科学、全面的质量控制体系,旨在为血人参Q-marker的选择提供思路与方法。参考文献
[1]貴州省药品监督管理局.贵州省中药材民族药材质量标准(2003年版)[M].贵阳:贵州科技出版社,2003:108.
[2]贵阳市卫生局.《贵阳民间药草》[M].贵阳:贵州人民出版社,1959:107.
[3]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999.
[4]陈田全,文纲,魏升华.贵州苗药血人参野生资源调查研究[J].安徽农业科学,2014,42(11):3235-3237.
[5]刘梦鸽,徐宏,徐文芬,等.苗药血人参的HPLC指纹图谱研究[J].贵阳中医学院学报,2018,40(5):47-53.
[6]骆瀚超.苗药血人参品质评价及质量标准深入研究[D].贵阳:贵州医科大学,2016.
[7]傅建,梁光义,张建新,等.茸毛木蓝化学成分研究[J].现代药物与临床,2013,28(3):265-268.
[8]杨雅欣,廖尚高,王正,等.血人参水溶性化学成分的UHPLC-DAD-Q-TOF-MS分析[J].中国实验方剂学杂志,2014,20(23):63-67.
[9]QIU L,LIANG Y,TANG G H,et al.Two new flavonols,including one flavan dimer,from the roots of Indigofera stachyodes[J].Phytochem Lett,2013,6(3):368-371.
[10]裘璐,梁妍,唐贵华,等.茸毛木蓝根的化学成分研究[J].中成药,2013,35(2):320-323.
[11]ZHOU W,LEI Z,LAI D,et al.Natural glycosides from Indigofera stachyoides radix[J].Rec Nat Prod,2019,14(1):83-88.
[12]李园园.茸毛木蓝和南湖菱降血糖及保肝作用研究[D].开封:河南大学,2012.
[13]雷钟.血人参化学成分及其保肝活性研究[D].贵阳:贵州医科大学,2019.
[14]傅建.苗药血人参及艾纳香化学成分的研究[D].贵阳:贵阳中医学院,2013.
[15]张云封,昝妮利,朱枝祥,等.苗药血人参中黄酮类化学成分研究[J].中草药,2021,52(12):3485-3492.
[16]王欢,周谣,张灿,等.血人参石油醚部位化学成分研究[J].广西植物,2022,1-13.
[17]LOU H Y,YI P,LIU H F,et al.Novel flavonolignans from the roots of Indigofera stachyodes[J].Fitoterapia,2022(160):105217.
[18]李春正.花木蓝根化学成分及3-硝基丙酰基葡萄糖类化合物研究[D].天津:天津大学,2006.
[19]高媛.豆科植物苏木蓝根化学成分研究[D].天津:天津大学,2007.
[20]朱新宇.血人参乙酸乙酯部位化学成分及其保肝活性初步研究[D].贵阳:贵州医科大学,2016.
[21]张云封,朱枝祥,王文萱,等.苗族药血人参中缩合鞣质类化学成分研究[J].中国中药杂志,2021,46(16):4131-4138.
[22]田璞玉,顾雪竹,王金梅,等.HS-SPME-GC-MS分析茸毛木蓝地上部分和根挥发性成分[J].中国实验方剂学杂志,2011,17(6):86-88.
[23]王小果,张汝国,张弘,等.茸毛木蓝挥发性成分的全自动热脱附-气相色谱-质谱分析[J].云南大学学报(自然科学版),2013,35(S2):336-338,343.
[24]马艳妮.血人参的生药学研究[D].贵阳:贵阳中医学院,2012.
[25]杨宇莎,时京珍,雷钟,等.血人参乙酸乙酯部位对APAP诱导小鼠急性肝损伤的保护作用[J].时珍国医国药,2018,29(4):786-789.
[26]雷钟,朱新宇,杨宇莎,等.血人参乙酸乙酯部位保肝活性化学成分分离鉴定[J].中国实验方剂学杂志,2018,24(7):56-63.
[27]SADHU S K,KHATUN A,PHATTANAWASIA P,et al.Lignan glycosides and flavonoids from Saraca asoca with antioxidant activity[J].J Nat Med,2007,61(4):480-482.
[28]刘超,陈若芸.儿茶素及其类似物的化学和生物活性研究进展[J].中国中药杂志,2004,29(10):1017-1021.
[29]段丽,张永萍,缪艳燕,等.苗药血人参不同提取部位体内外对乳腺癌4T1细胞的影响[J].中草药,2018,49(12):2902-2907.
[30]王雷鸣,梁冰,李淑芳,等.复方血人参对环磷酰胺减毒作用的初步研究[C].2011医学科学前沿论坛第十二届全国肿瘤药理与化疗学术会议论文集,2011:134.
[31]LI Y Y,LI C Q,XU Q T,et al.Antioxidant,α-glucosidase inhibitory activities in vitro and alloxan-induced diabetic ratsprotective effect of Indigofera stachyodes Lindl.Root[J].J Med Plant Res,2011,5(14):3321-3328.
[32]吴小峰,王小果,张汝国.茸毛木蓝不同部位体外抗氧化及α-葡萄糖苷酶抑制活性对比研究[J].黔南民族医专学报,2017,30(3):161-164.
[33]FUKUDA N,ETOH T,WADA K,et al.Differential effects of geometrical isomers of octadecadienoic acids on ketogenesis and lipid secretion in the livers from rats fed a cholesterol-enriched diet[J].Ann Nutr Metab,1995,39(3):185-192.
[34]高月红,郑建普,朱春赟,等.抗氧化能力检测方法评估及微型化[J].中国药学杂志,2008,43(24):1863-1867.
[35]何金英,成雪,杨露,等.血人参提取物及其制剂对半乳糖联合亚硝酸钠致衰老小鼠模型抗氧化能力的影响[J].贵州科学,2022,40(3):37-42.
[36]傅建,付慧晓,张永萍,等.苗药血人参总黄酮的分离及体外抑菌研究[J].贵州科学,2020,38(6):4-8.
[37]LEITE S P,VIEIRA J R C,MEDEIROS P L,et al.Antimicrobial activity of Indigofera suffruticos[J].Evid Based Complement Alternat Med,2006,3(2):261-265.
[38]赵鸿宾,刘晓梦,吉杨丹,等.雪人参提取物不同部位止咳祛痰作用研究[J].黔南民族医专学报,2018,31(2):79-81.
[39]但成丽,张艳焱,张永萍,等.基于转基因斑马鱼炎症模型的血人参提取物抗炎活性筛选研究[J].时珍国医国药,2016,27(11):2617-2620.
[40]秦帅,张永萍,陈希,等.应用斑马鱼高通量筛选平台筛选抗炎民族药研究[J].中华中医药杂志,2020,35(8):4146-4148.
[41]王文萱,张云封,罗扬淦,等.血人参中分离的异甘草素对巨噬细胞的影响及其抗炎作用机制研究[J].环球中医药,2022,15(6):976-983.
[42]刘昌孝.基于中药质量标志物的中药质量追溯系统建设[J].中草药,2017,48(18):3669-3676.
[43]刘昌孝,陈士林,肖小河,等.中药质量标志物(Q-Marker):中药产品质量控制的新概念[J].中草药,2016,47(9):1443-1457.
[44]汪毅.中国天然药物彩色图集[M].贵阳:贵州出版社,2010:344.
[45]杨济秋,杨济中.贵州民间方药集[M].贵阳:贵州人民出版社,1978:465-466.
[46]云南省卫生局革命编委会.云南中草药[M].昆明:云南人民出版社,1971:147-148.
[47]任钧国,王冬芝,雷蕾,等.中药传统功效与现代药理作用之间关系的分析[J].中国中药杂志,2017,42(10):1979-1983.
[48]罗运凤,高洁,柴艺汇,等.五味子药理作用及临床应用研究进展[J].贵阳中医学院学报,2019,41(5):93-96.
[49]杜国成.中药鞣质成分的药理作用探析[J].中国医药科学,2011,1(16):27,33.
[50]孙坤坤,王加锋.辛味药药性理论及归经应用[J].山东中医药大学学报,2021,45(4):458-461.
[51]侯晓杰,李玮,张建锋.芪胶升白胶囊药理作用及临床研究进展[J].微量元素与健康研究,2018,35(1):74-76.
[52]代春美,陈香,胡相卡,等.芪胶升白胶囊联合环磷酰胺对S180荷瘤小鼠增效减毒作用研究[J].天然产物研究与开发,2016,28(7):1029-1034,1065.
[53]龚春梅.芪胶升白胶囊联合化疗治疗进展期乳腺癌的临床观察[D].大连:大连医科大学,2014.
[54]丁荣楣,王平,马丽君,等.芪胶升白胶囊对肺癌放疗患者白细胞减少的疗效及生存质量的影响[J].现代肿瘤医学,2016,24(3):400-403.
[55]薛妍,刘文超.芪胶升白胶囊对乳腺癌化疗骨髓抑制和生活质量的影响[J].中国医药指南,2013,11(6):278-279.
[56]武新虎,蒋璐,邓芸,等.芪胶升白胶囊对预防鼻咽癌患者同步放化疗后骨髓抑制疗效观察[J].实用肿瘤杂志,2013,28(2):203-206.
[57]赵同德,田劭丹,侯丽,等.苗药芪胶升白胶囊防治化疗相关白细胞减少的临床研究[J].世界中西医结合杂志,2020,15(8):1547-1552.
[58]黄钒,邹喜,林捷.芪胶升白胶囊对可切除中低位直肠癌术前同步放化疗后骨髓抑制的影响[J].海峡药学,2020,32(12):209-210.
[59]许欢,张永萍,段丽.苗药血人参及其制剂对“气弱血弱体弱”冷病模型小鼠的作用研究[J].湖北民族大学学报(医学版),2021,38(2):6-10.
[60]王倩,许霞,张珂,等.利用UPLC-IT-TOF-MS定性分析芪胶升白胶囊化学成分组[J].中国中药杂志,2022,47(18):4938-4949.
[61]马艳妮,劉莉,魏俊莲,等.血人参的薄层色谱鉴别及水分、灰分、浸出物测定[J].中国民族民间医药,2011,20(23):70-71.
[62]国家药典委员会.中华人民共和国药典2020年版[S].北京:中国医药科技出版社,2020:59,232.
[63]杨莎,蒋桂华,陈佳妮,等.紫外-可见分光光度法测定野巴子中的总黄酮[J].华西药学杂志,2012,27(2):202-203.
[64]骆瀚超,郝小燕,周威,等.正交试验法优化血人参中总黄酮的提取工艺[J].华西药学杂志,2015,30(3):358-360.
[65]朱新宇,骆瀚超,何茂秋,等.苗药血人参的质量标准研究[J].中国药房,2016,27(27):3829-3831.
[66]李军,王崇敏,张永萍,等.苗药血人参的类黄酮化学成分分析[J].分子植物育种,2023,21(9):3079-3087.
[67]安兰兰,刘育辰,刘刚,等.苗药黑骨藤研究进展及其质量标志物的预测分析[J].中华中医药学刊,2021,39(1):136-141.
[68]赵帅,郝二伟,杜正彩,等.瑶药五指毛桃的化学成分、药理作用研究进展及质量标志物预测分析[J].世界科学技术-中医药现代化,2020,22(5):1506-1516.
(收稿日期:2022-09-08编辑:陶希睿)
