间充质干细胞工程化的DNA纳米结构构建及其在小鼠肺组织靶向递送中的应用
2023-07-05李卓婷尚颖旭汪海燕丁宝全赵春华
李卓婷,尚颖旭,汪海燕,蒋 乔,丁宝全,李 静*,赵春华*
1.中国医学科学院基础医学研究所 北京协和医学院基础学院 组织工程中心,北京 100005;2.国家纳米科学中心 中国科学院纳米科学卓越创新中心 中国科学院纳米系统与多级次制造重点实验室,北京 100190
DNA折纸纳米结构(DNA origami nanostructures,DONs)是由核酸链通过碱基互补配对形成的稳定自组装结构。通常由长DNA骨架链(M13噬菌体基因组DNA),与数百条短链DNA(订书钉链和捕获链)精确互补配对,组装为预先设计的几何结构[1]。DONs能够高效装载小分子化学治疗(化疗)药物、多肽、蛋白质等多种药物,实现药物的靶向递送和可控释放,具有十分广阔的前景[2]。
间充质干细胞(mesenchymal stem cells, MSCs)具有免疫调节和损伤修复的作用,能够调控生理病理过程、治疗多种疾病[3]。以急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)为例,MSCs能够通过抗感染、抗凋亡和促血管生成,避免肺部和远端器官损伤[4]。MSCs静脉输注后会优先快速分布到肺组织,随后向损伤组织迁移或被清除[5]。这种肺部富集特性[6],使得MSCs能够作为“细胞载体”携带其他功能组分靶向至肺组织。
本研究利用代谢糖工程[7],将单链DNA共价连接于MSCs细胞膜表面。进而将DONs定位于MSCs细胞膜上,获得膜上修饰DONs的MSCs(DONs@MSCs)(图1)。静脉注射后的DONs@MSCs能够靶向递送到肺组织,为DONs后续用于肺部疾病治疗提供策略。

图1 DONs修饰间充质干细胞(MSCs)示意图
1 材料与方法
1.1 材料
1.1.1 细胞与动物:人脂肪间充质干细胞(adipose-derived mesenchymal stem cells, AMSCs)从吸脂术患者废弃的脂肪组织中分离获得。本研究经北京协和医学院基础医学研究所伦理委员会批准,供者均签订知情同意书;8周雄性SPF级C57BL/6小鼠[斯贝福(北京)生物技术有限公司]。
1.1.2 试剂与耗材:DMEM/F12,胎牛血清(Gibco公司);青霉素及链霉素(华北制药公司);单链DNA(表1)(上海生工生物工程公司);M13噬菌体单链基因组DNA按文献报道的方法提取[8];100 ku超滤柱(Millipore公司);N-叠氮乙酰基甘露糖胺-四酰基化(Ac4ManNAz, 简称叠氮糖)(Sigma-Aldrich公司)。

表1 核酸序列
1.2 方法
1.2.1 AMSCs的分离及培养:用含两倍双抗PBS清洗脂肪,离心去除血水获得纯脂肪,加入0.2 %胶原酶于37 ℃摇床振荡消化20 min,100 μm滤网过滤离心获得细胞,用干细胞培养基培养。
1.2.2 DONs的设计:采用caDNAno软件进行设计,参考文献[9]的方案,本研究采用三维管状DONs进行探究(图1)。二苯并环辛炔(dibenzocyclooctyne, DBCO)修饰的Click-ssDNA用于与叠氮共价反应,修饰6-羧基荧光素(6-carboxyfluorescein, 6-FAM)荧光基团用于示踪,并采用硫骨架修饰避免单链降解。Click-ssDNA捕获(click-ssDNA captures)链用于捕获click-ssDNA。Tracing ssDNA-1/2分别在细胞实验和离体脏器成像中用于示踪DONs。Tracing-captures用于捕获tracing ssDNA-1/2(表1)。
1.2.3 DONs的组装:将骨架链(M13基因组)与短链DNA(订书钉链和捕获链)在1×TAE/Mg2+缓冲液(40 mmol/L Tris-Base; 20 mmol/L AcOH; 2 mmol/L EDTA; 12.5 mmol/L Mg(OAc)2; pH 8.0)中混合。DNA链摩尔比为骨架链∶订书钉链∶捕获链=1∶5∶5。95 ℃~4 ℃梯度退火,得到DONs。
1.2.4 DONs的纯化:采用截止分子量为100 ka的超滤柱,每100 μL产物加入400 μL 1×TAE/Mg2+溶液,5 600 r/min,离心5 min。重复3次得到纯化后的DONs(bare-DONs,为未杂交基团的结构)。测量纯化产物在260 nm处的吸光度用于计算浓度,消光系数为8.96×107L/mol/cm。
1.2.5 DONs的杂交:将bare-DONs与tracing ssDNA-1(或tracing ssDNA-2, 表1)混合在1×TAE/Mg2+缓冲溶液中,其中tracing ssDNA-1与bare-DONs捕获链的摩尔比为3∶1,37 ℃下孵育30 min。用100 ku的超滤柱除去未上载的tracing ssDNA-1, 得到最终DONs结构。
1.2.6 原子力显微镜(atomic force microscopy, AFM)表征DONs:取20 μL 0.5 nmol/L的DONs滴加在云母片表面,沉积5 min后使用Scansyst in fluid模式观察。
1.2.7 琼脂糖凝胶电泳(agarose gel electrophoresis, AGE)表征DONs:将0.15 g琼脂糖粉末溶于30 mL 1×TBE/Mg2+(89 mmol/L Tris-Base; 89 mmol/L boric acid; 2 mmol/L EDTA; 1 mmol/L MgCl2; pH 8.0)缓冲液,加入1 μL溴化乙锭预染色,倒入模具后冷凝成型,配置成0.5 %琼脂糖凝胶。在1×TBE/Mg2+缓冲液中电泳,电泳条件为85 V,1 h。对杂交了2种功能基团(click-ssDNA和tracing ssDNA-1)的DONs进行验证,在紫外及荧光通道下观察。
1.2.8 MSCs膜表面click-ssDNA的修饰:利用糖代谢工程,在MSCs细胞膜上表达叠氮糖。利用DBCO与叠氮发生点击化学反应(click chemistry)的原理,将click-ssDNA共价连接于MSCs表面[7](图1)。将MSCs分为3组,分别为MSCs组、ssDNA+MSCs组、(ssDNA与MSCs混合组)和膜上修改ssDNA的MSCs(ssDNA@MSCs)组。MSCs组为未作处理的MSCs,ssDNA+MSCs组为未作处理的MSCs与click-ssDNA直接孵育,ssDNA@MSCs组为经叠氮糖处理的MSCs与click-ssDNA孵育。
具体操作为,将细胞以1×105个/孔/mL加入12孔板,再加/不加入终浓度为50 μmol/L的叠氮糖。将MSCs与/不与叠氮糖孵育2 d。再与200 μL 50 μmol/L click-ssDNA(表1)孵育2 h,进行无铜催化生物正交反应[10](图1)。PBS洗涤细胞2次,用0.25%胰蛋白酶(200 μL)酶解1 min,用培养基(800 μL)终止消化,离心弃上清,重悬后得到ssDNA@MSCs。
1.2.9 MSCs膜表面DONs的修饰:将ssDNA@MSCs与DONs进行孵育,使得click-ssDNA能够与DONs上对应的捕获链进行杂交,得到DONs@MSCs(图1)。将MSCs分为3组,分别为MSCs组、DONs+MSCs组和DONs@MSCs组。采用tracing ssDNA-1示踪DONs,MSCs组为未作处理的MSCs,DONs+MSCs组将未作处理的MSCs与DONs直接孵育, DONs@MSCs组将ssDNA@MSCs与DONs共同孵育。
具体操作为,修饰前将1×105个ssDNA@MSCs样品用PBS洗涤2次,再将细胞在室温下重悬于tracing ssDNA-1(或tracing ssDNA-2)标记的DONs(10 nmol/L, 100 μL)溶液中30 min,离心弃上清,PBS重悬后得到DONs@MSCs。
1.2.10 离体脏器的成像:将小鼠随机分成2组,每组3只。使用tracing ssDNA-2标记DONs并进行尾静脉注射,DONs组为单独注射DONs(10 nmol/L, 100 μL); DONs@MSCs组为注射等剂量的DONs@MSCs(10 nmol/L, 100 μL)。注射3 h后处死小鼠,取脏器进行离体脏器成像。
1.3 统计学分析

2 结果
2.1 DONs的表征
组装得到管状DONs,该结构高度为4 nm,与设计相符(图2A)。凝胶电泳显示,DONs条带位置滞后于M13条带,且红绿荧光通道下均显示出对应荧光与DONs电泳条带的共定位(图2B)。
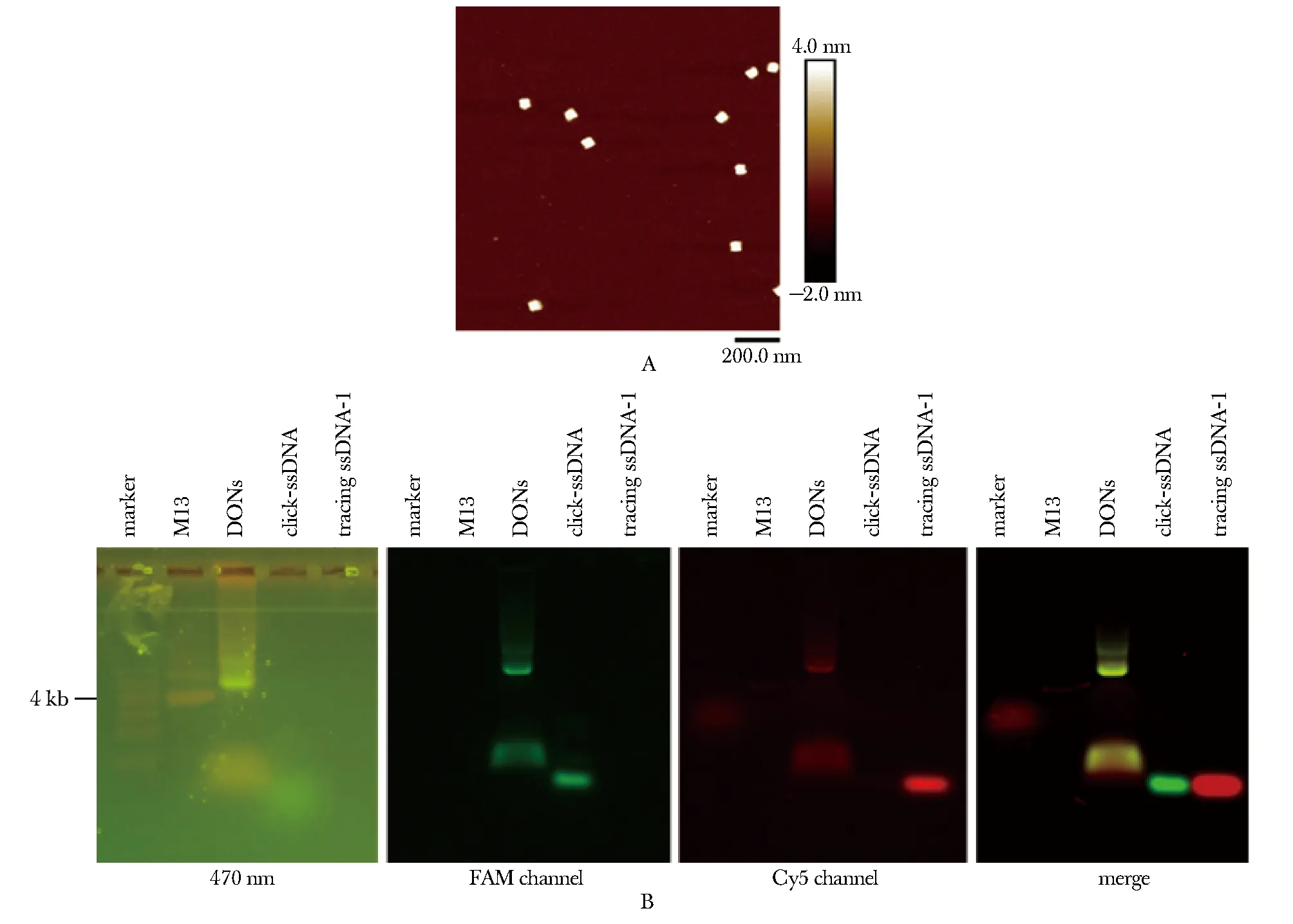
FAM refers to carboxyfluorescein; A.AFM characterization of DONs; B.AGE characterization of DONs.
2.2 MSCs膜表面click-ssDNA的修饰
结果显示,与ssDNA+MSCs组相比,ssDNA@MSCs组的MSCs细胞膜上FAM荧光信号显著增强(图3A)。膜上修改ssDNA的MSCs(ssDNA@MSCs)组细胞膜表面的平均荧光强度荧光显著增强(P<0.001)(图3B, C)。
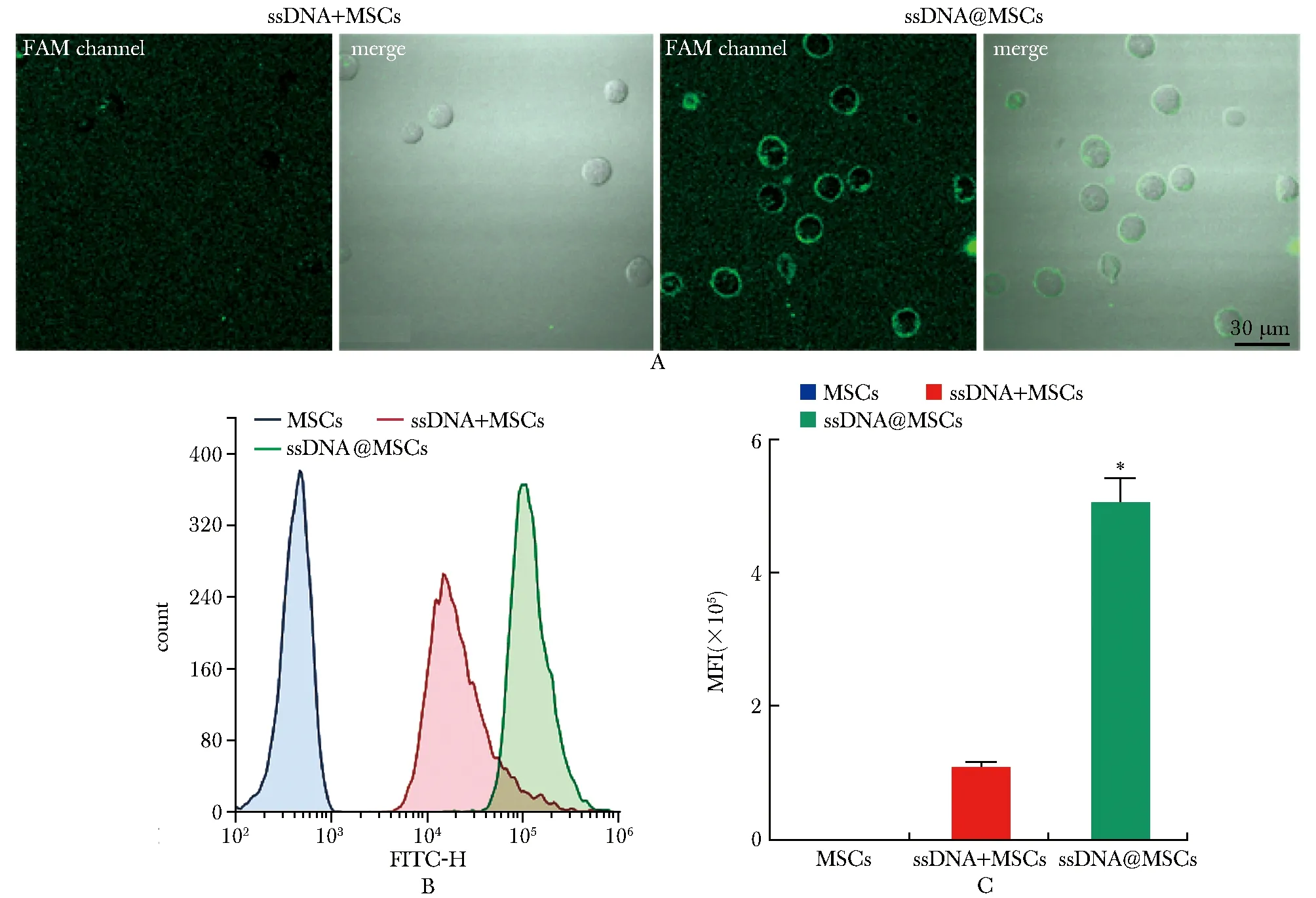
MFI refers to mean fluorescence intensity; A.confocal observation of cell surface fluorescence intensity; B.flow cytometry used to measure the FITC-H MFI on the cell surface; C.MFI of FITC-H on cell surface; *P<0.001 compared with ssDNA+MSCs group.
2.3 MSCs膜表面DONs的修饰
孵育DONs后DONs@MSCs组的细胞膜表面Cy5荧光信号显著聚集,并且与FAM荧光共定位(图4A)。与DONs+MSC组相比,DONs@MSCs组表面Cy5平均荧光强度显著增强(P<0.001)(图4B, C)。
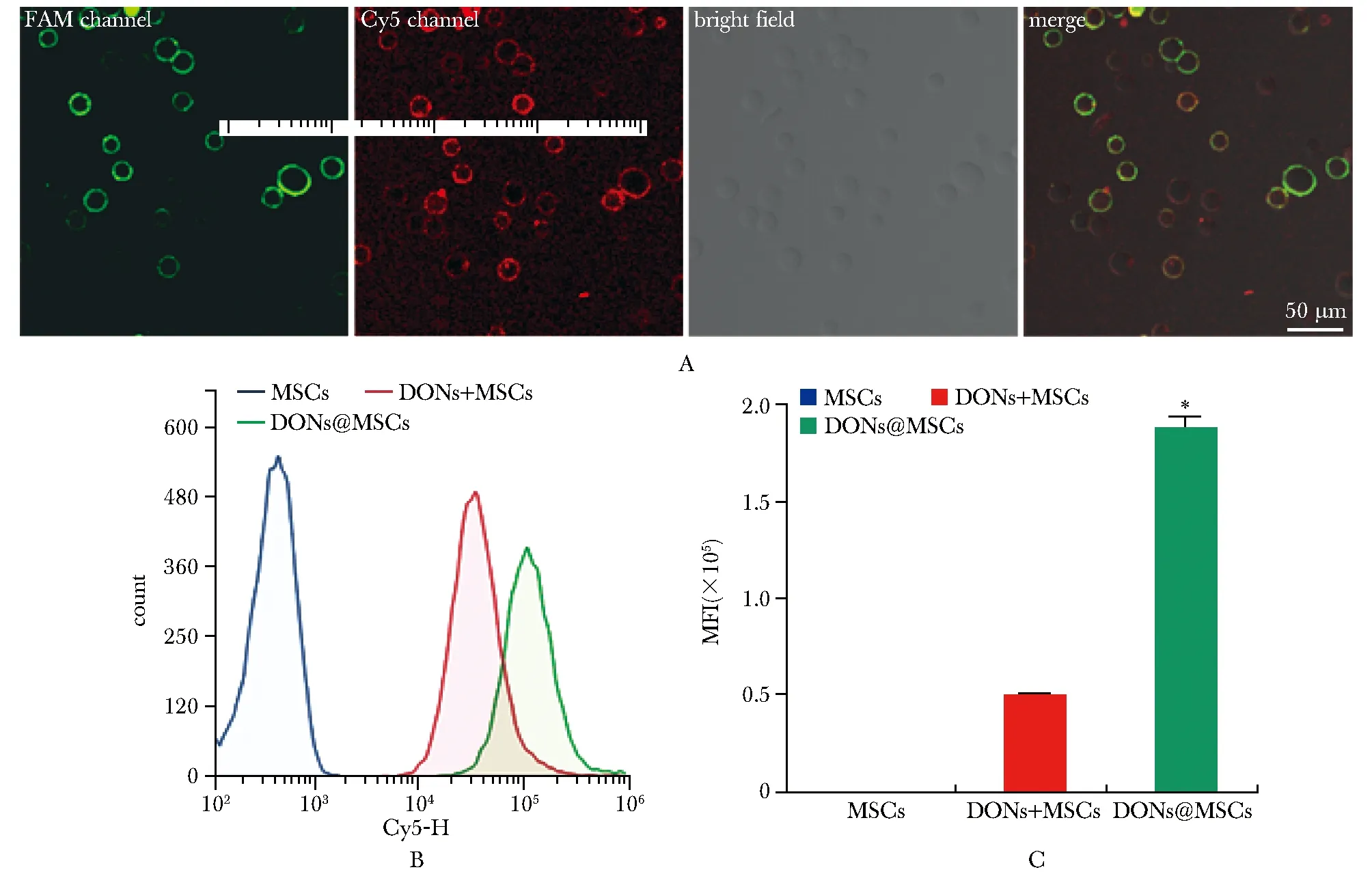
A.confocal observation of cell surface fluorescence intensity; B flow cytometry used to measure the Cy5-H MFI on the cell surface; C.*P<0.001 compared with DONs+MSCs group.
2.4 离体脏器成像观察DONs体内分布情况
尾静脉注射给药3 h后,能够看出两组的DONs均有明显的肝肾分布,但DONs@MSCs组在小鼠肺组织的荧光强度明显高于DONs组(P< 0.05)(图5A, B)。
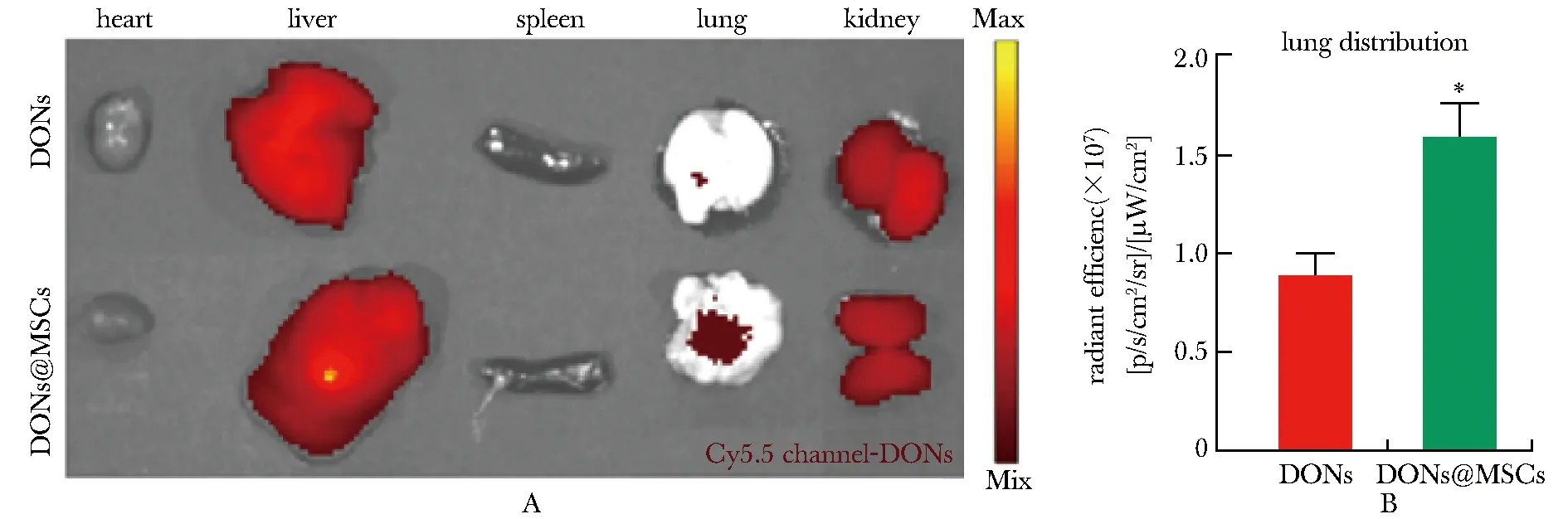
*P<0.05 compared with DONs group.
3 讨论
MSCs作为备受关注的种子细胞,已被用于炎性疾病、退行性疾病及损伤性疾病等研究,其安全性已经得到广泛的验证。DONs是一种可精确设计、智能释放的核酸材料自组装的递送载体,在肿瘤诊断、治疗和疫苗等领域展现出巨大的潜力。因此,MSCs和DONs联合用于疾病的治疗具有非常令人期待的研究价值。
三维管状DONs能够将生物大分子药物(如siRNA,多肽,抗原等)装载在空心管腔内,从而减少药物降解,降低药物使用剂量,同时提升药效和安全性[9]。本研究经制备得到形貌均一、结构完整且单分散性良好的三维管状DONs。体外模拟DONs在细胞膜表面的杂交条件,两种荧光链均成功上载于DONs。
通过细胞膜表面修饰功能组分调控细胞行为,一直是生命科学领域的研究热点。目前常通过基因工程进行细胞表面修饰,但该方法操作复杂,且易受到细胞内复杂环境的干扰[7]。因此本工作设计了一种基于糖代谢工程的生物正交反应,将click-ssDNA共价标记在MSCs膜表面,得到ssDNA@MSCs。进而使得DONs捕获在ssDNA@MSCs细胞膜表面上。该方法操作简单,便于大量制备,且生物安全性高。
DONs能够作为活性氧清除剂用于抗氧化应激,从而改善炎性反应环境。已有研究表明,DONs通常优先富集于肾脏能够用作治疗急性肾损伤[11]。实验结果表明,DONs@MSCs能够用于DONs向小鼠肺组织的靶向递送,进而推测能够潜在用于治疗急性肺损伤等肺部疾病。
综上所述,MSCs向肺部归巢的特性肺对肺损伤性疾病的治疗具有天然的优势,利用这一特性,将其与DONs相结合,能够实现DONs对小鼠肺部的靶向。进一步装载相关治疗性药物,可以将药物高效的输送到肺部组织。这一递送策略为多种肺部疾病的药物递送和靶向治疗提供了新的思路。
