甘氨酸-硝酸盐燃烧合成制备铜/铁基纳米催化剂及表征*
2023-07-04郑旭惠何艺施赵文荻李佳蔓黄慧茹江烨琳任学梁
郑旭惠,何艺施,赵文荻,李佳蔓,黄慧茹,江烨琳,朱 健,任学梁
(肇庆学院 环境与化学工程学院,广东省环境健康与资源利用重点实验室,广东 肇庆 526061)
近来年,过渡金属氧化物在半导体的应用上一直扮演着重要的角色。由于贵金属催化剂和稀土催化剂的价格昂贵,故非贵金属催化剂逐渐有取代贵金属作为催化剂研究主流的态势。例如,氧化铜、氧化铁、氧化镁、氧化镍等,虽催化效果较贵重金属触媒差,但因价格便宜,在各种有毒有害废水处理中得以大量推广应用,具有明显的实用价值。其中,氧化铜/铁系催化剂具有易于制备、成本低廉、良好的催化活性等优点。在电性方面,氧化铜是一种具有较窄能带的P型半导体,比起氧化镁及氧化镍等其他物质,在高压的情况下,晶体结构不易被压缩变形,也不会改变粒径的大小,有较高的稳定态。氧化铁是非常重要的材料,分为三种不同的形态,即赤铁矿(α-Fe2O3)、磁赤铁矿(γ-Fe2O3)和磁铁矿(Fe3O4)[1]。其中,赤铁矿(α-Fe2O3)是一种在环境条件下热力学稳定的氧化铁,具有刚玉结构、很高的耐腐蚀性和无毒性,是最环保的N型半导体材料(带隙为2.1 eV)。
本研究以硝酸铜三水合物为主要原料,甘氨酸为络合剂和燃烧剂,运用甘氨酸-硝酸盐燃烧法合成铜/铁基非贵金属催化剂,同时讨论了甘氨酸/氮质量比对合成反应的影响,也对制备的材料进行结构及性能表征,未来可应用于去除高浓度有机废水,具有显著的实用性与研究价值。
1 实验部分
1.1 主要试剂和仪器
硝酸铜(Cu(NO3)2·3H2O,分析纯,Merck公司),硝酸铁(Fe(NO3)3·9H2O,分析纯,Merck公司),甘胺酸 (H2NCH2COOH,分析纯,Merck公司),氨水 (NH4OH,30%,Merck公司),蒸馏水(鼎湖工业蒸馏水)。pH酸度计(北京赛多利斯科学仪器),电磁加热搅拌器(CO-PC420D,德记仪器公司),高温炉(JFF2000,协仝企业有限公司)。
1.2 催化剂的制备
将硝酸铜/硝酸铁与甘氨酸溶解在去离子水中,另将不同比例量的甘氨酸(燃料)添加到金属硝酸盐(氧化剂)溶液中以获得三种不同的甘氨酸-硝酸盐的比率(质量比,以下简称为G/N,G/N=0.3、0.5和0.7),如图1所示。然后将甘氨酸-硝酸盐溶液混合,并在热板搅拌器上在105℃下加热过夜,形成透明、均匀和粘稠的凝胶状溶液。再然后将每种凝胶倒入放在烤箱中的陶瓷碗中,凝胶被加热到200℃,直到它们发生自燃并产生催化剂灰烬。至此,获得了以细粉末形式显示的氧化铜/铁基催化剂纳米颗粒。
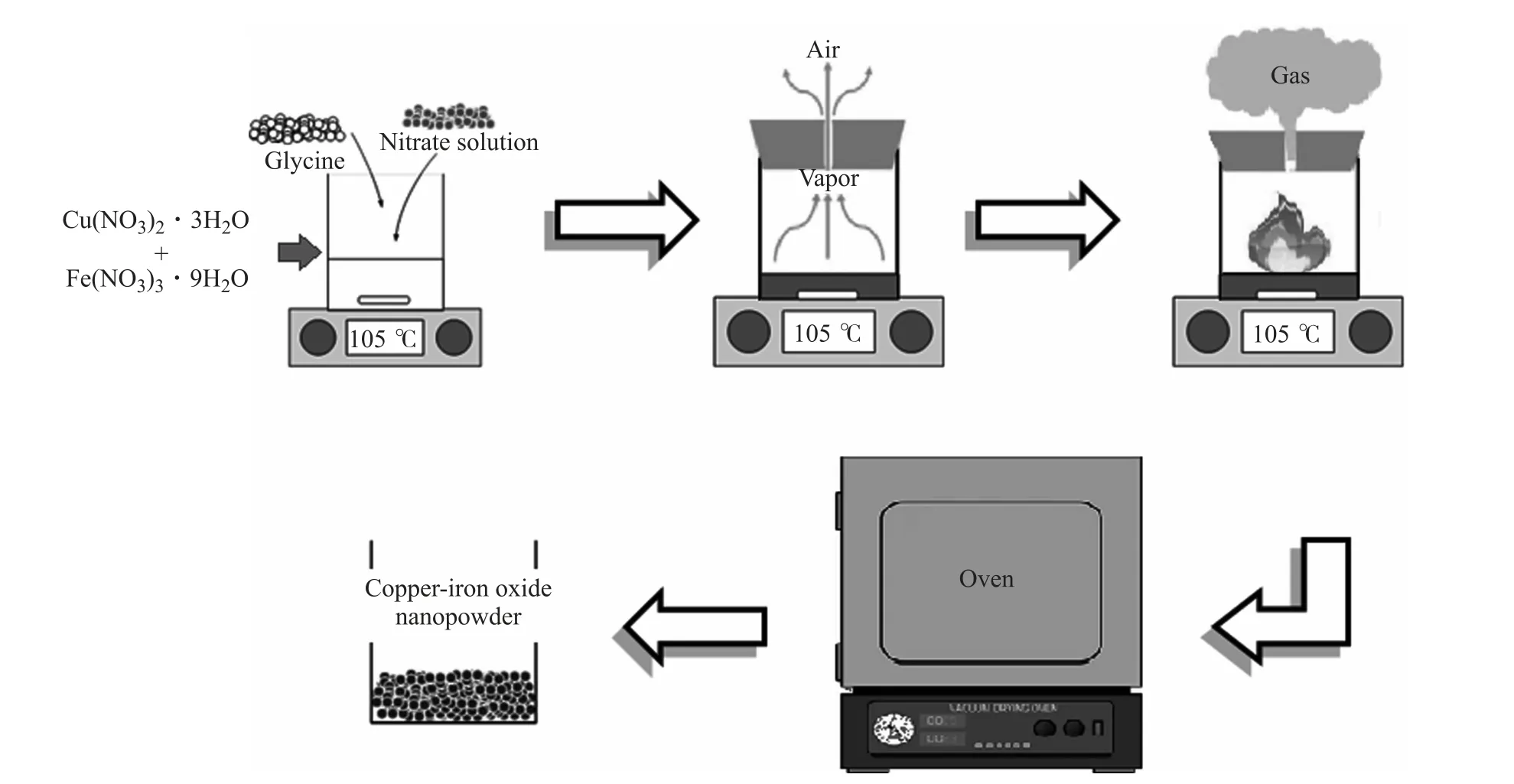
图1 利用甘胺酸-硝酸盐法制备铜/铁复合物流程示意图
2 结果与讨论
2.1 不同pH值胶体前驱物的热重分析
本研究利用热重分析仪(TGA)来掌握燃烧反应及合成温度的调整。图2(a)显示,在未添加氨水调整pH条件下,燃烧反应的开始与结束的温度并不会随着G/N而改变;但添加氨水调整pH之后,不同G/N下燃烧反应结束的温度会随着氨水的添加而升高。燃点所需温度上升的因素来自氨水与硝酸反应形成的硝酸铵。硝酸铵所需燃点较高,且硝酸铵的形成也改变了原有燃烧反应甘胺酸及硝酸盐的比例,使反应过程中燃烧所需的温度提升。调整不同pH也可能导致甘胺酸的型态改变,在pH=2时,主要以NH+3CH2COOH存在;当pH=6时,主要以NH+3CH2COO-存在;当pH=10时,主要以NH2CH2COO-存在。三种不同结构下的甘胺酸与铜离子所产生螯合的形式也会改变,更稳定的螯合结构可能导致需更高的温度才能使燃烧反应自发进行[2]。

图2 不同G/N比值与pH条件下合成的氧化铜的XRD
燃烧反应起始和结束温度的改变,可以利用燃烧反应结束温度做为高温炉控温的依据。胶体前驱物在未调整pH及pH=2时的差异并没有很大,主要是因为氨水添加量不多;当调整pH=6及10时,明显上升20~30℃。在高温炉使用温度设定上,当未调整及pH=2时,使用200℃;当pH=6或10时,使用230℃做为高温炉燃烧所使用的温度。
2.2 不同G/N与pH值下合成的氧化铜的特性
2.2.1 XRD分析
由图2(a)所示,在G/N=0.3的合成条件下,粉末的晶相会随着胶体前驱物的pH上升,由CuO逐渐被还原为Cu2O及Cu,还原效应的发生来自于添加氨水调整pH时,氨水与硝酸盐反应形成硝酸铵[2],迫使燃烧过程中实际G/N上升,燃烧反应后的产物会趋向于还原物质,而氨水在燃烧反应过程中也可作为还原剂;CuO为选择性还原触媒与燃烧反应过程中所产生的氨气或NOx反应还原成Cu2O及Cu[3]。图2(b)为G/N=0.5合成条件下的,随着还原剂甘胺酸的用量增加,在pH =2时,可以看到产物主要为Cu2O及Cu;但当pH=6和10时,大部分都被还原成Cu。图2(c)为G/N=0.7合成条件下的,在pH=2时,可以看到产物主要为Cu;当pH=6及10所呈现出来的XRD图谱相似,来自于燃烧反应过程中,做为氧化剂的硝酸盐被消耗殆尽,而燃烧反应被抑制,导致燃烧反应不完全,若要使反应更完全需要添加更多的氧化剂才能使反应持续在燃烧。
2.2.2 SEM分析
对燃烧反应后的粉末进行SEM表面分析,在G/N=0.3及0.5时,产物多以椭圆形的团聚体存在,团聚体的大小大概在100 nm,且具有多孔的特性;当G/N=0.7,且pH=2时,因为高温造成金属铜表面烧结的现象;而G/N=0.7,且pH=6及10时,出现较为大块片状产物,燃烧反应中作为还原剂的氨水添加过多,导致G/N比的上升,燃料过多会造成燃烧反应的抑制,使得需要提升燃烧反应温度或添加氧化剂才能使反应继续燃烧,因此易产生未反应完的甘胺酸残留。
2.3 铁掺杂氧化铜合成触媒的特性分析
利用铁掺杂比例较高的样品进行ESCA分析,发现未掺杂铁的峰值与掺杂铁的峰值差异性并不大,仅强度发生微小的改变。进一步针对铁掺杂氧化铜合成触媒进行吸收强度的分析,利用光谱吸收峰了解过渡金属改质后对于不同入射波长的吸收情形。吸收系数(a)和入射光子能量(hν)的关系为:a=Bi·(hν-Eg)2/hν。其中,Bi是间接跃迁的吸收常数,hν是光子能量,Eg是带隙能量。图3(a)显示了光谱数据中(ahν)1/2与hν的关系图。其中显示了不同Fe比率的氧化铜颗粒在350~800 nm范围内的紫外-可见光谱。样品n(Fe)/n(Cu)=0%~1%展示了半导体材料的典型紫外-可见光谱,带隙吸收开始于350、360、396、610、640和800 nm,分别对应于3.63[(n(Fe)/n(Cu)=0%)]、3.44[(n(Fe)/n(Cu)=0.1%)]、3.16[(n(Fe)/n(Cu)=0.5%)]、2.02[(n(Fe)/n(Cu)=0.01%)]、1.96[(n(Fe)/n(Cu)]=1%)和1.56 eV[(n(Fe)/n(Cu)=0.01%)]的能带隙。研究表明,与未掺杂Fe的氧化铜相比,掺杂Fe的氧化铜在可见光区域的吸收显著增强,也说明该催化剂在可见光照射下具有光催化活性。
3 结论
铜/铁基催化剂是运用甘氨酸-硝酸盐燃烧法合成的铜/铁基纳米粒子。合成的铜/铁基颗粒的平均尺寸为10~25 nm,而比表面积在较高掺杂时有明显上升的趋势:Fe掺杂比例为10-2时,比表面积达到8.6m2/g。透过能隙的计算可知,不同Fe掺杂的氧化铜颗粒在350至800 nm范围内的紫外-可见光谱。与未掺杂Fe的氧化铜相比,掺杂Fe的氧化铜在可见光区域的吸收显着增强,这有助于其成为一款应用于环境污染治理领域较为理想的环保功能材料。
