乙醇-硫酸铵双水相体系萃取虾壳中虾青素研究
2023-07-04冯金华何梓渊刘红英李丽娜
冯金华 何梓渊 刘红英 李丽娜


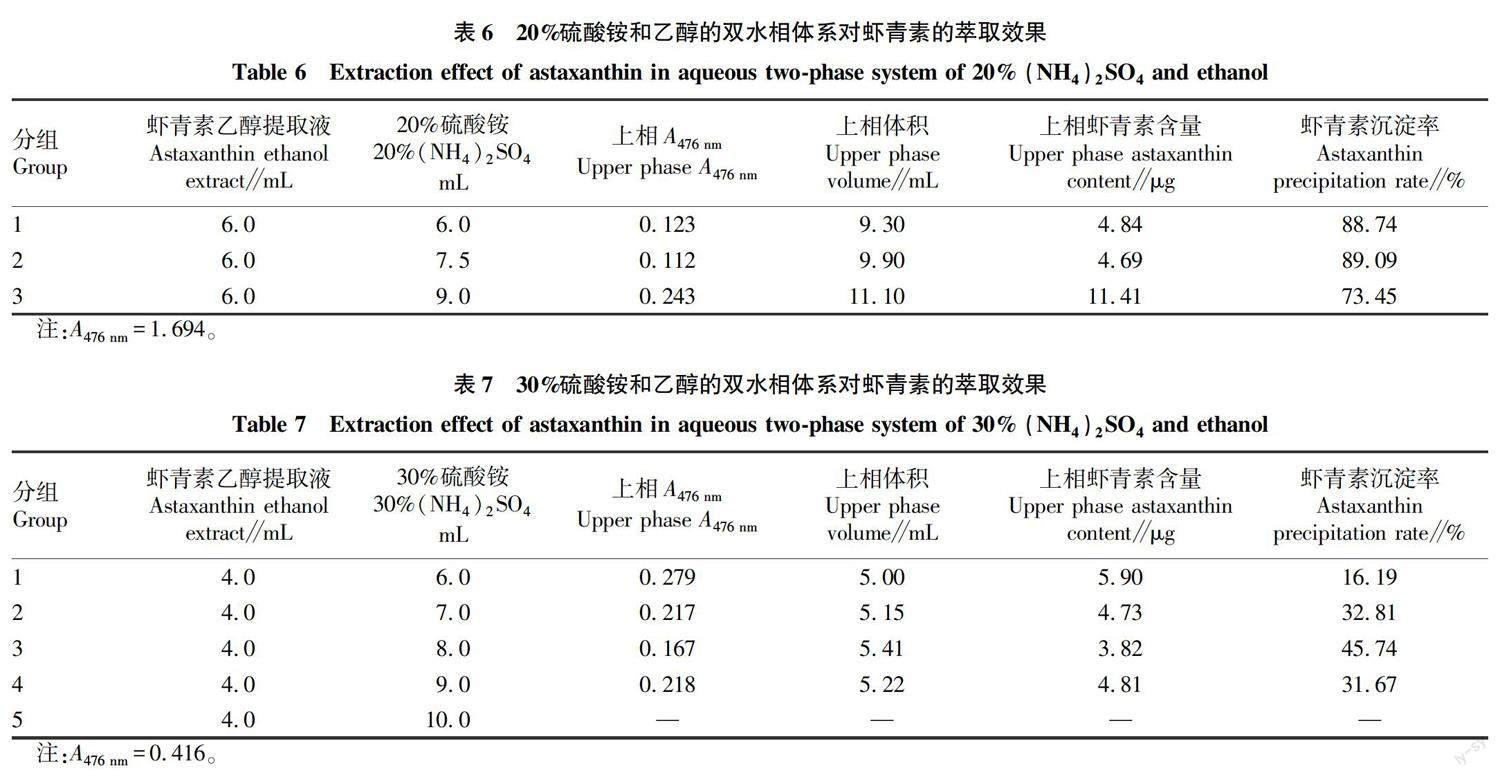

摘要 采用乙醇-硫酸铵双水相制备虾壳中的虾青素,探索虾壳中虾青素提取的条件。结果表明:采用乙醇溶液,料液比1 ∶15,每次提取3 h,提取2次,提取效果较好。采用乙醇-硫酸铵双水相萃取虾青素,虾青素主要集中在上下两相之间,最佳条件:20%硫酸铵∶虾青素乙醇提取液(v/v)=2.5 ∶2.0,沉淀率为89.09%。经薄层色谱法和高效液相色谱法检测,双水相萃取可使虾青素提取液中的各类型虾青素都沉淀。
关键词 虾青素;双水相体系;分离
中图分类号 TS 254.9 文献标识码 A 文章编号 0517-6611(2023)05-0176-05
doi: 10.3969/j.issn.0517-6611.2023.05.040
开放科学(资源服务)标识码(OSID):
Extraction of Astaxanthin from Shrimp Shells by Ethanol /(NH4)2SO4 Aqueous Two-phase System
FENG Jin-hua, HE Zi-yuan, LIU Hong-ying et al
(Hebei Agriculture University, Qinhuangdao, Hebei 066003)
Abstract Astaxanthin in shrimp shell was prepared by ethanol/(NH4)2SO4 aqueous two-phase method. The extraction conditions of astaxanthin from shrimp shell were explored. It was determined that ethanol solution was used, the solid-liquid ratio was 1 ∶15, extracted for 3h and twice, and the extraction effect was better. Astaxanthin was extracted by ethanol/(NH4)2SO4 aqueous two-phase extraction. Astaxanthin was mainly concentrated between the upper and lower phases. The optimum condition was that 20% (NH4)2SO4 ∶ astaxanthin ethanol extract(v/v) = 2.5 ∶2.0, and the precipitation rate was 89.09%. By TLC and HPLC examination, all kinds of astaxanthin in astaxanthin extract can be precipitated by aqueous two-phase extraction. This environmentally friendly method has potential application prospects in the large-scale separation of astaxanthin.
Key words Astaxanthin;Aqueous two-phase system;Separation
蝦青素又称变胞藻黄素,英文习惯命名为Astaxanthin,全反式虾青素的中文系统命名为全反式3,3′-二羟基-4,4′-二酮基-β,β′胡萝卜素,相对分子质量为596.86,纯虾青素是暗红紫色粉末,熔点224 ℃,不溶于水,能溶解于大多数有机溶剂[1]。虾青素天然产物多数以酯的形式存在,有些是一元酯,有些是二元酯,存在于自然界中的大部分虾青素及其酯为全反式异构体[2]。
虾青素具有独特的着色功能,进入动物体内后可以不经修饰或生化转化而直接贮存、沉积在组织中[3]。虾青素在保护细胞膜磷酸酯和其他脂类的超氧化方面表现突出。虾青素在淬灭活性氧的活性及清除自由基方面能力比β-胡萝卜素高10倍以上,比VE强百倍以上。同时,虾青素具有抑制脂质过氧化作用,具有显著降低脂质过氧化物累积的作用[4]。虾青素还具有一定的抗癌特性。Tanaka等[5]在用硝基喹啉-1-氧化物诱发大鼠口腔癌的类似试验中,观察到虾青素能显著降低口腔肿瘤的发生率。这些决定了虾青素的应用价值及商业价值。
双水相萃取技术是一种操作简单、易于放大的分离方法,自20世纪60年代提出以来受到广泛关注。该技术的原理是生物物质在双水相体系中的选择性分配。当生物物质进入双水相体系后,在上相和下相间进行选择性分配,表现出一定的分配系数。不同的物质在特定的体系中有着不同的分配系数[6]。近30年来,双水相萃取已涉及酶、核酸、 生长激素、病毒、色素、生物碱等有效成分的分离及提纯。但是有关该技术应用于虾青素的提取和分离尚鲜见相关研究报道。
目前,已有的萃取体系有高聚物-高聚物-去离子水、高聚物-盐-去离子水、离子液体-盐-去离子水、小分子有机溶剂-盐-去离子水等。考虑到虾青素易溶于有机溶剂不溶于水的性质,笔者选择小分子有机溶剂-盐-水体系,采用乙醇-硫酸铵双水相体系对虾青素进行分离研究,旨在为虾青素双水相制备的可行性提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 原材料。冷冻南美白对虾,购于河北省秦皇岛市海港区市场。
1.1.2 主要仪器。721型可见光分光光度计,上海舜宇恒平科技有限公司;Sigma 3-30k实验室高速冷冻离心机,塞维斯科技(北京)有限公司;FA2104N型精密分析电子天平,上海菁海仪器有限公司;FM100型高速万能粉碎机,天津市泰斯特仪器有限公司;HH-8型恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;H185OR型台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;D2F-6050AB型电热真空干燥箱,天津工兴实验室仪器有限公司;LC-20A型岛津高效液相色谱仪,Shimadzu岛津公司。
1.1.3 主要试剂。虾青素标准品(S13036-250 mg >98.0%),上海源叶生物科技有限公司;硅胶板(规格50 mm×100 mm;厚度0.20~0.25 mm),青岛海洋化工有限公司;甲醇(色谱纯)、四氢呋喃(色谱纯),天津康科德科技有限公司;无水乙醇(AR)、硫酸铵(AR),天津市科密欧化学试剂有限公司。
1.2 试验方法
1.2.1 虾壳中虾青素的提取。将新鲜的虾壳用5%稀盐酸浸没,搅拌,静置1 h,至不再有气泡产生,然后用清水洗至中性,60 ℃下烘干,-10 ℃冰箱保存备用。
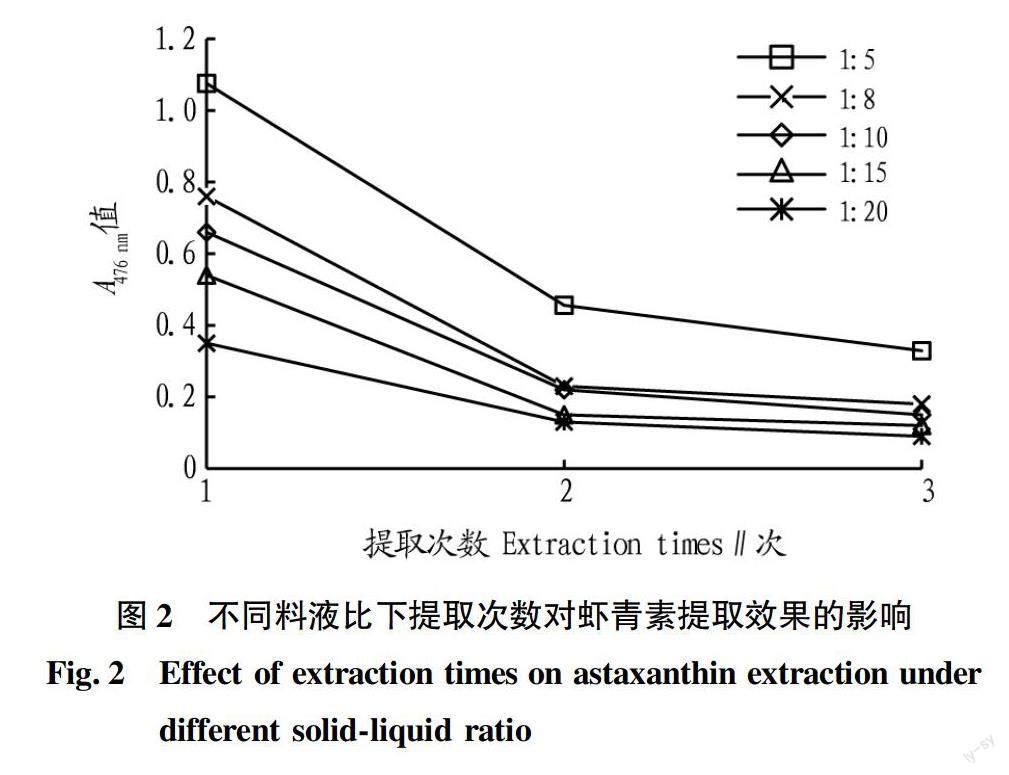
为检测提取时间对虾青素提取效果的影响,取干燥的虾壳,粉碎,设置料液比为1 ∶ 8、1 ∶ 10、1 ∶ 15、1 ∶ 20,在室温下,用乙醇分别浸提虾壳,检测提取1、2、3、4、5、9 h,用每组提取液在476 nm处的吸光度来判断提取液中虾青素的含量。每组设置3个平行。
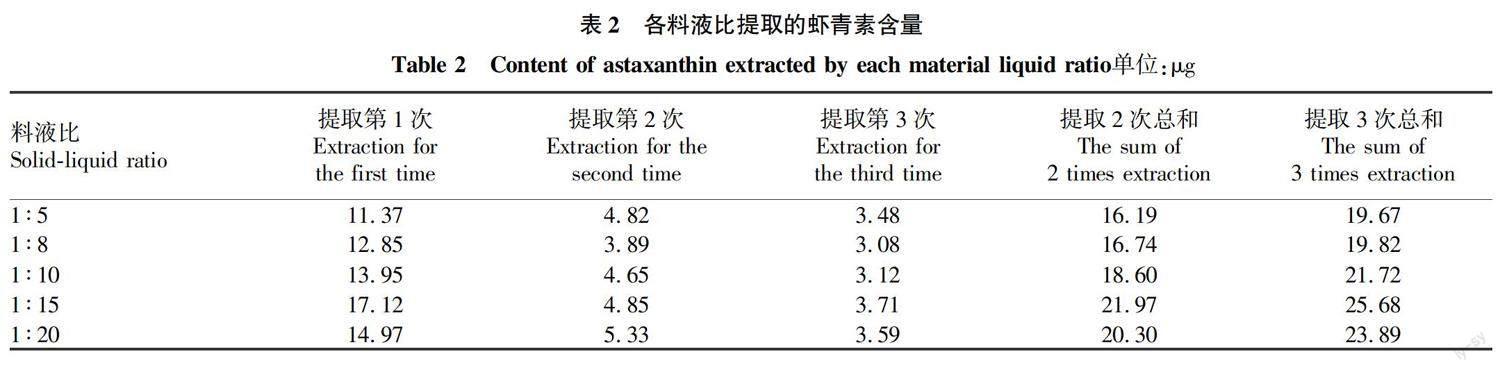
为检测提取次数对虾青素提取的影响,分别检测了料液比分别为1 ∶5、1 ∶8、1 ∶10、1 ∶15、1 ∶20,在分别提取1、2、3次(每次提取3 h)时,虾青素提取液在476 nm的吸光度,并计算虾青素的提取量。每组3个平行。
样品液中虾青素含量的计算根据Beer-Lamben定律[7],计算公式:
m= A×V×106 A1%1 cm×100
式中,m为类胡萝卜素含量,μg;
A为溶液吸光度;
V为溶液体积,mL。
其中,吸光系数A1%1 cm为在1 cm光程长的比色杯中1 g/L浓度溶质的理论吸收值。虾青素标准样品在乙醇中的吸光系数为2 365 L/(g·cm)。
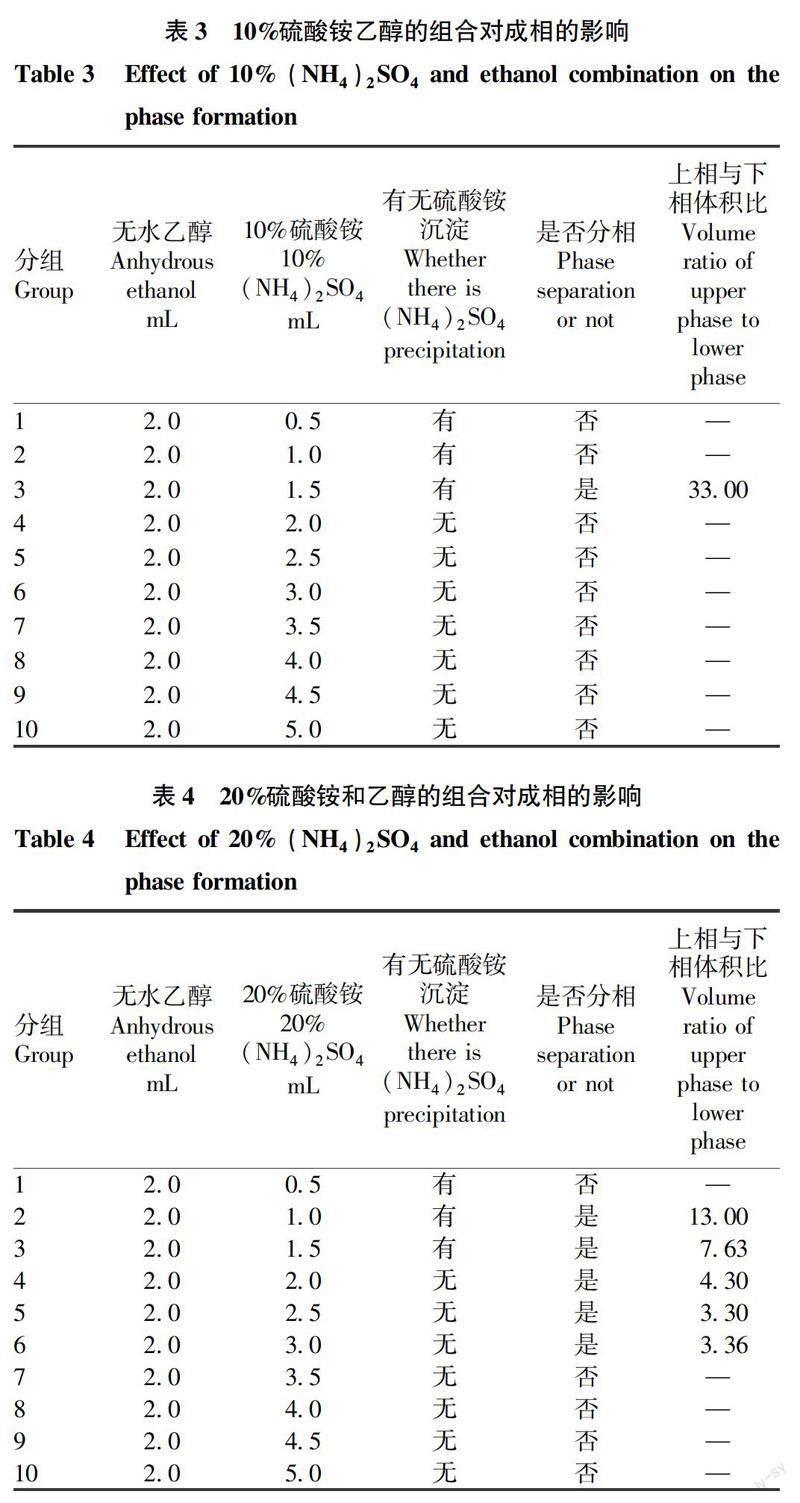
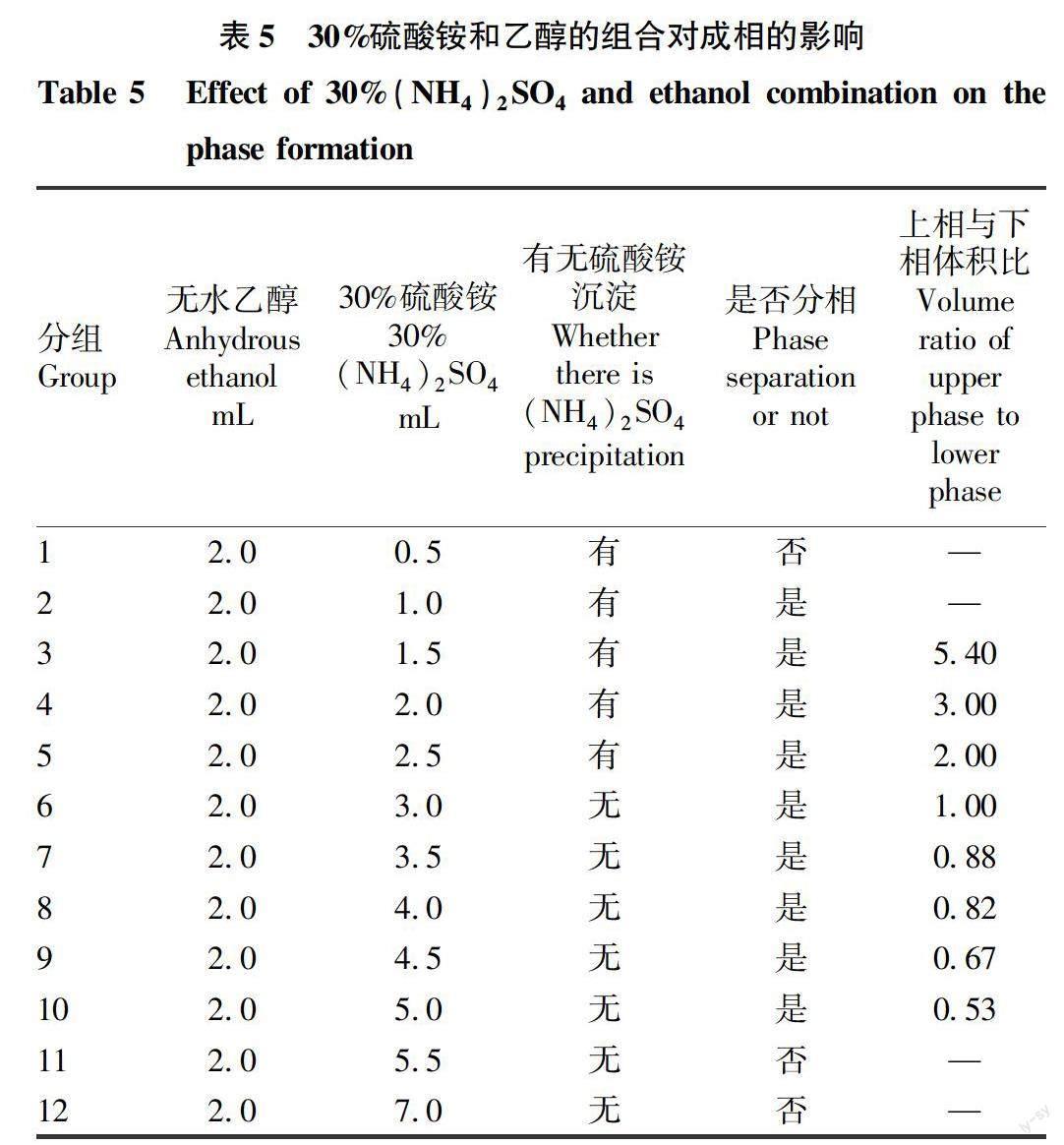
1.2.2 乙醇-硫酸铵双水相体系的配制。配制质量体积分数分别为10%、20%、30%(w/v)的硫酸铵溶液,取2.0 mL无水乙醇溶液,分别与不同体积的硫酸铵溶液混合,在25 ℃下静置30 min,观察并记录成相情况。
1.2.3 乙醇-硫酸铵双水相溶液萃取虾壳中的虾青素。利用“ 1.2.1 ”中的制备方法提取虾壳中虾青素,并适当浓缩。然后向一定体积的虾青素乙醇提取液中(A476 nm=1.694,7.163 μg/mL)加入一定体积的20%、30%的(NH4)2SO4溶液,配制成双水相,检测双水相上相中虾青素在476 nm处的吸光度。
1.2.4 虾青素的薄层色谱测定。50 mm×100 mm的硅胶板,展开剂为25%丙酮和75%正己烷,完成薄层分离后测Rf值。
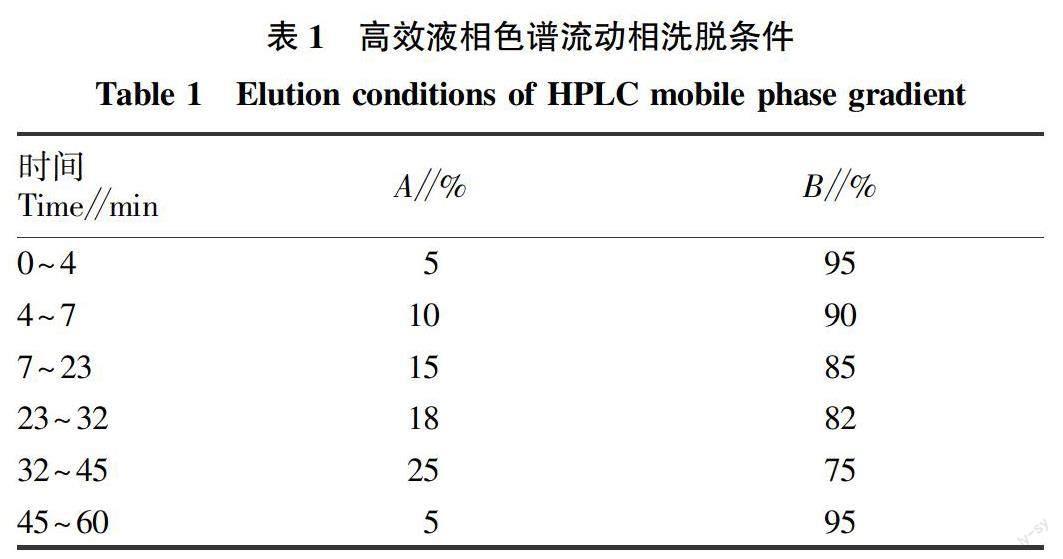
1.2.5 虾青素的高效液相色谱检测。色谱柱为C18:250.0 mm×4.6 mm,采用甲醇(B)和四氢呋喃(A)梯度洗脱的方式(表1),流速0.8 mL/min,检测波长476 nm,进样量10 μL,柱温20 ℃。
2 结果与分析
2.1 乙醇浸提时间对虾青素提取的影响
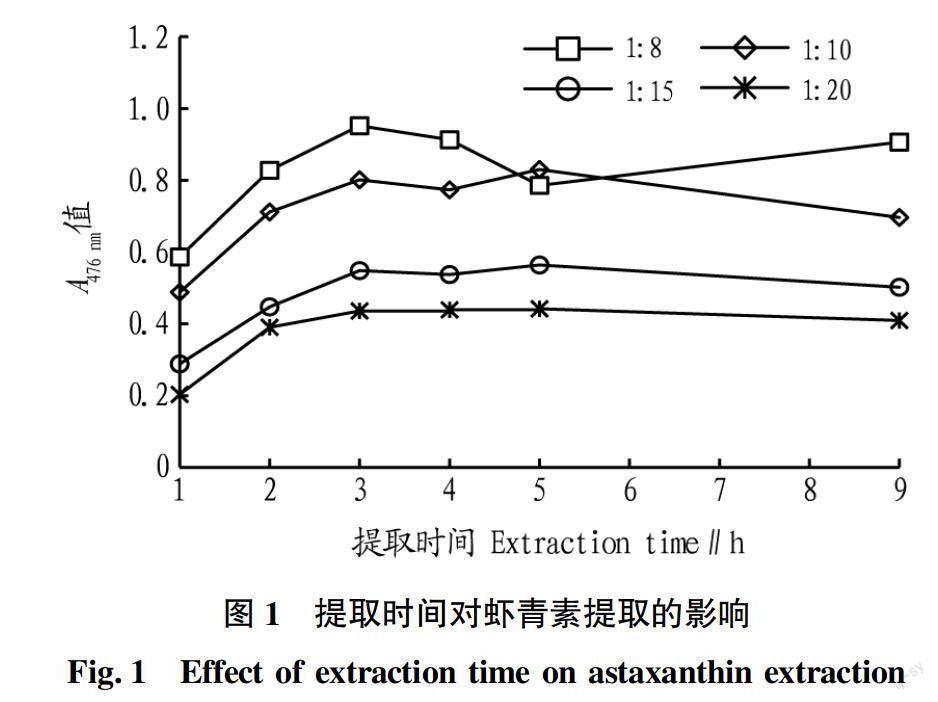
在室温下,通过对4组料液比进行虾壳中虾青素提取的研究发现(图1),4组在提取3 h之前,随着提取时间的延长,提取液中虾青素均逐渐增大;提取时间在3 h左右,虾青素在溶液中浓度达到较高值;3 h以后,随着浸提时间的延长,虾青素的浓度反而变得不稳定,除料液比1 ∶ 8组外,基本未出现持续增加的情况,主要趋势是在3~5 h虾青素浓度变化不大,5~9 h,除料液比1 ∶ 8组基本呈现下降趋势,但下降速度不快。这说明在室温下,提取虾青素的过程中,3 h左右易达到溶解平衡,提取时间继续延长,溶解的虾青素可能发生分解,反而开始下降。因此,在提取虾壳中虾青素时,可以设定提取时间为3 h左右。
2.2 乙醇浸提料液比及提取次数对虾青素提取的影响
称取0.5 g虾皮,选择料液比1 ∶ 5、1 ∶ 8、1 ∶ 10、1 ∶ 15、1 ∶ 20进行提取,每次提取3 h。从图2可以看出,提取1次,所获得提取液虾青素的吸光度均在0.3以上,对虾壳提取第2次时,虾青素的吸光度明显降低;1 ∶ 5料液比组第2次提取后,吸光度仍较高,1 ∶ 8和1 ∶ 10组提取液的吸光度基本在0.2左右;1 ∶ 15和1 ∶ 20提取液的吸光度較低;提取第3次,1 ∶ 5组提取液中虾青素的吸光度仍较高。这说明采用1 ∶ 5料液比提取3次,虾青素有较多的剩余量。
由表2可知,5个料液比下,以1 ∶ 15料液比组提取虾青素量最多。因此在提取虾青素时,采用1 ∶ 15料液比较合适。
2.3 乙醇-硫酸铵双水相溶液的配制
先用10%、20%、30%(w/v) 的硫酸铵溶液和无水乙醇进行混合试验,以配制25 ℃乙醇-硫酸铵双水相体系,试验结果见表3~5。由表3可知,采用10%硫酸铵溶液进行双水相配制不易形成双水相。
由表4可知,采用20%硫酸铵溶液进行双水相配制,无水乙醇 ∶ 20%硫酸铵(v/v)=1 ∶ 1、1 ∶ 1.25、1 ∶ 1.50,可以形成双水相,且不会出现硫酸铵沉淀,且上相比下相体积大得多。
由表5可知,采用30%硫酸铵溶液进行双水相配制,较易形成双水相,在无水乙醇 ∶ 30%硫酸铵(v/v)=1 ∶ 1.50、1 ∶ 1.75、1 ∶ 2、 1 ∶ 2.25、1 ∶ 2.50可 以形成较清晰的双水相,且上下相比例逐渐减小。
综上,选择表4、5中成相体系进行虾青素的萃取试验。
2.4 乙醇-硫酸铵双水相体系萃取虾青素
采用表4、5中的双水相萃取虾青素,发现乙醇-硫酸铵双水相体系可将虾青素溶液分为3相,虾青素主要以沉淀的形式集中于中间相,部分虾青素存在于上相,下相澄清(图3)。
由表6可知,3个20%硫酸铵与无水乙醇形成的双水相对虾青素的沉淀率均较高,最高为乙醇 ∶ 20%硫酸铵(v/v)=2 ∶ 2.50体系,虾青素沉淀率为89.09%。由表7可知,30%硫酸铵与无水乙醇形成的双水相对虾青素的沉淀率相对较低,上相中的残留率较高。
2.5 双水相体系制备虾青素的检测
采用虾青素乙醇提取液 ∶ 20%硫酸铵(v/v)=2 ∶ 2.50体系提取液中的虾青素,并对制备的虾青素进行高效液相色谱分析和薄层色谱分析。
2.5.1 高效液相色谱分析结果。
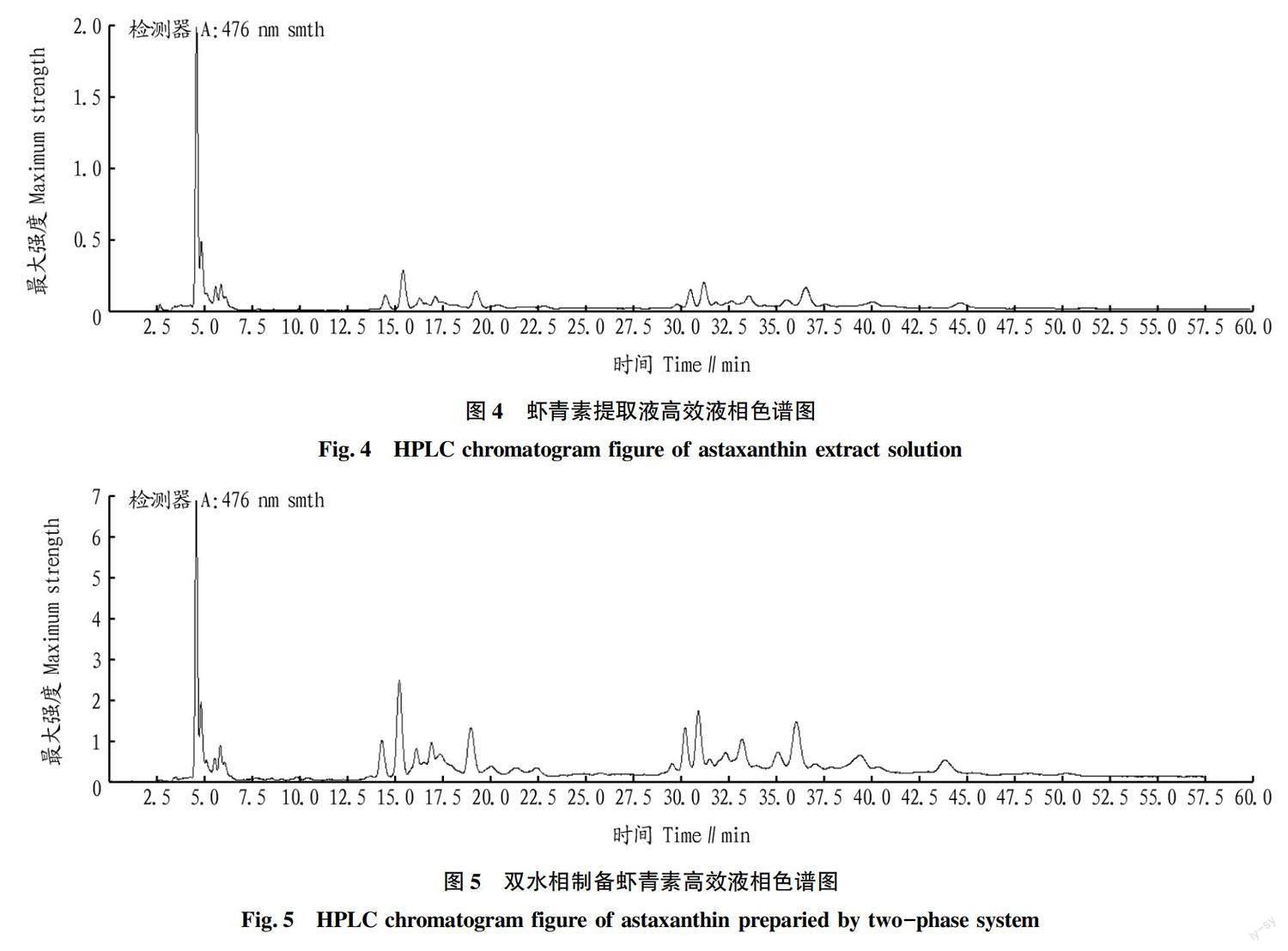
虾壳中虾青素的高效液相色谱图如图4所示。其中出峰时间4.5 min处是游离虾青素,出峰时间14.0~20.0 min处是虾青素一酯,出峰时间29.5~45.0 min处是虾青素二酯。由此可知,虾壳中含有多种虾青素一酯和多种虾青素二酯,并且游离虾青素、虾青素一酯、虾青素二酯的含量均很高。
双水相萃取虾青素的高效液相色谱图(图5)与图4基本相同,说明该双水相体系可以将虾壳中各种类型虾青素萃取出来,可以起到很好地制备虾青素的目的。
2.5.2 薄层色谱分析结果。
从图6可以看出,双水相萃取虾青素与虾壳中虾青素提取液相比,游离虾青素条带没有太大差别。虾青素一酯和虾青素二酯在双水相萃取图中更加清晰,推测可能是由于双水相萃取不仅能够将虾青素沉淀出来,提高了虾青素的浓度,同时还去除了一部分杂质,如去除了部分与虾青素结合的蛋白质,使双水相制备的虾青素纯度更高,虾青素一酯和二酯的显色更加清晰。
3 讨论
虾青素的制备一般采用有机溶剂萃取-旋转蒸发浓缩[8]、超临界流体萃取[9]、碱提酸沉法[10]、 水沉法[11]等,这些方法不利于虾青素的进一步分离,有些需要加热则不利于虾青素稳定,有些需要比较昂贵的仪器,有些可能造成环境污染。
一般双水相主要基于物质在上下两相中的分配不同,来实现不同物质间的分离。但研究发现,在采用双水相体系进行物质分离时,可能会出现中间相。向不经预处理的有机酸发酵液中加入可溶性无机盐或有机盐和萃取剂进行萃取操作,两相之间会形成一个富含菌体和蛋白的固相层[12]。修志龙等[13]研究表明,向越桔果实残渣中加入无机盐溶液和 亲水性低分子有机物,分层后,花青素被萃取到上相,残渣分 配在下相或两相之间。Li等[14]研究表明,采用乙醇/Na2CO3双水相体系从培养的冬虫夏草中分离冬虫夏草菌丝体多糖时,99.1%的细胞碎片集中于上下两相之间。
该研究发现,虾青素在乙醇/硫酸铵双水相体系中,可形成固相层集中于两相之间。通过适当的双水相体系可以使88.0%以上的虾青素沉淀下来,同时可以去除一些可以溶于上相和下相中的杂质成分,如一些蛋白质、糖类、其他色素等,在使虾青素形成沉淀的同时,还能提高虾青素的品质,而且节省了虾青素脱溶剂的步骤。该方法不需要大量的酸碱,乙醇和硫酸铵都可以回收使用,所以对环境危害性较小,而且该工艺还比较容易扩大生产。因此,该研究可以成为一种制备虾青素的新方法。
参考文献
[1] 王业勤,李勤生.天然类胡萝卜素:研究进展、生产、应用[M].北京:中国医药科技出版社,1997:284-287.
[2] JOHNSON E A,AN G H. Astaxanthin from microbial sources[J]. Critical reviews in biotechnology,1991,11(4):297-326.
[3] MEYERS S P,BLIGH D. Characterization of astaxanthin pigments from heat-processed crawfish waste[J]. Journal of agricultural and food chemistry,1981,29(3):505-508.
[4] MIKI W. Biological functions and activities of animal carotenoids[J]. Pure and applied chemistry,1991,63(1):141-146.
[5] TANAKA T,MAKITA H,OHNISHI M,et al.Chemoprevention of rat oral carcinogenesis by naturally occurring xanthophylls,astaxanthin and canthaxanthin[J]. Cancer research,1995,55(18):4059-4064.
[6] 吳敏.双水相萃取技术在药物提取与分离中的应用[J].中成药,2006,28(10):1505-1508.
[7] CALO P,VELAZQUEZ J B,SIEIRO C,et al. Analysis of astaxanthin and other carotenoids from several Phaffia rhodozyma mutants[J]. Journal of agricultural and food chemistry,1995,43(5):1396-1399.
[8] 丛心缘,孙伟红,张辉珍,等.南极磷虾中不同形态虾青素的分离制备、结构鉴定及含量分析[J].食品与发酵工业,2019,45(2):174-178.
[9] 翁婷,金银哲,陶宁萍,等.南极磷虾中虾青素超临界CO2萃取方法研究[J].天然产物研究与开发,2013,25(10):1404-1410.
[10] 丁纯梅,陶庭先,吴之传.龙虾虾壳的综合利用(Ⅰ):虾壳红色素的提取及其性质研究[J].化学世界,1995,36(8):444-445,434.
[11] 王建刚,秦宝富,曹斌云,等. 从雨生红球藻中提取总虾青素的固相萃取方法:CN201210106234.5[P].2014-08-06.
[12] 修志龙,宋志远,魏博超,等.一种盐析萃取发酵液中有机酸的方法:CN201010511992.6[P].2014-11-12.
[13] 修志龙,张华,许鸽,等.一种新型双水相萃取越桔中花青素的方法:CN200910011206.3[P].2009-09-16.
[14] LI Z G,CHEN A L,LI Z C,et al. A novel and environmentally friendly bioprocess for separation and partial purification of polysaccharides from Cordyceps sinensis mycelia by an aqueous two-phase system[J]. RSC advances,2017,7(60):37659-37665.
