5种金边瑞香基因组DNA提取方法比较研究
2023-07-04罗素梅郭崇炎刘小平黄冬华周勇辉范方喜赖金莉张远福
罗素梅 郭崇炎 刘小平 黄冬华 周勇辉 范方喜 赖金莉 张远福

摘要 [目的]研究不同提取方法对金边瑞香基因组DNA提取质量的影响,筛选最佳提取方法。[方法]以金边瑞香叶片为试材,以SDS法、改良CTAB法、SDS-CTAB法、高盐低pH法和尿素法5种方法提取基因组DNA,并从DNA纯度、浓度、酶切电泳结果和ISSR-PCR扩增产物电泳等方面进行比较分析。[结果]高盐低pH法和尿素法提取的金边瑞香基因组DNA富含蛋白质和多糖等杂质,DNA纯度低;SDS法提取的基因组DNA含有一些酚类物质和盐等杂质,DNA纯度较低;改良CTAB法提取的基因组DNA纯度较高,但浓度和产率低。SDS-CTAB法提取的基因组DNA纯度、浓度和产率最高,酶切和ISSR-PCR产物电泳检测效果最好。[结论]SDS-CTAB法提取的金边瑞香基因组DNA质量与产量最佳,可以满足后续分子生物学研究的需求。
关键词 金边瑞香;基因组DNA;提取方法
中图分类号 S 685.99 文献标识码 A 文章编号 0517-6611(2023)05-0074-04
doi: 10.3969/j.issn.0517-6611.2023.05.019
开放科学(资源服务)标识码(OSID):
Comparative Study on Five Genomic DNA Extraction Methods of Daphne odora
LUO Su-mei1,2,GUO Chong-yan1,LIU Xiao-ping1,2 et al
(1.Vegetable and Flower Research Institute of Ganzhou,Ganzhou,Jiangxi 341404;2.Ganzhou Key Laboratory for Development and Utilization of Vegetable and Flower Germplasm Resources,Ganzhou,Jiangxi 341404)
Abstract [Objective]In order to study the effect of different methods on the quality of genomic DNA extraction from Daphne odore,the most suitable extraction method was selected.[Method]Using leaves of Daphne odore as materials,the genomic DNA was extracted by SDS method,modified CTAB method,SDS-CTAB method,high salt low pH method and urea method,which compared and analyzed on the DNA purity,concentration,enzyme digestion electrophoresis results and ISSR-PCR amplification product electrophoresis.[Result]The results showed that the genomic DNA extracted by high salt,low pH method and urea method was rich in impurities such as protein and polysaccharide,that the purity of DNA was low.The genomic DNA extracted by SDS method contains some impurities such as phenols and salts,which the purity of DNA was low.The genomic DNA extracted by modified CTAB method has high purity,but low concentration and yield.The purity,concentration and yield of genomic DNA extracted by SDS-CTAB method were the highest,further more,the effect of enzyme digestion and ISSR-PCR product electrophoresis detection also was the best.[Conclusion]The genomic DNA extracted by SDS-CTAB method has the best quality and yield of Daphne odore,which can meet the needs of subsequent molecular biology research.
Key words Daphne odore;Genomic DNA;Extraction methods
金邊瑞香(Daphne odore var.marginnata)是瑞香科瑞香属瑞香的一个变种,为多年生常绿灌木花卉,是我国传统名花之一,其叶片边缘金黄,花色淡紫,花香浓烈独特,深受广大人民喜爱[1-2]。金边瑞香富含黄酮类、香豆素类和黏多糖等生理活性物质,具有抑菌、镇痛、抗氧化和调节免疫等功效,是一味珍贵的中药材[3-4]。金边瑞香是我国特有的种质资源,为江西省赣州市的地方特色花卉,在赣南大部分区县均有栽培,畅销国内外市场且已形成产业化规模[1,5-6]。
目前,国内外对金边瑞香的研究主要集中于栽培管理、组培繁育、生物化学性质和医药应用等方面[7-10],而关于其分子生物学方面的研究较少[11]。随着现代生物技术的高速发展,植物分子遗传分析等技术也必将运用到金边瑞香的种质资源保护、功能基因挖掘和品种改良等方面,而获得高质量的基因组DNA 是开展金边瑞香分子生物学研究的基本前提。对于一种植物采用不同的基因组DNA提取方法,其纯度和产量可能会产生很大差异[12],而所提取的植物基因组DNA质量是影响后续PCR、酶切等分子试验的重要限制因素之一[13],因此针对不同种类植物建立相应的DNA分离纯化方法以获取高质量的基因组DNA显得至关重要。笔者采用SDS法、改良CTAB法、SDS-CTAB法、高盐低pH法和尿素法5种方法对金边瑞香基因组DNA提取效果进行比较研究,以摸索出适宜该植物的DNA提取纯化方法,为金边瑞香后续相关分子生物学研究提供有益参考和指导。
1 材料与方法
1.1 试验材料 金边瑞香植株取样于江西省赣州市大余县,种植于赣州市蔬菜花卉研究所试验大棚。
1.2 试验仪器与试剂 移液器(赛默飞世尔)、恒温水浴锅(力辰科技)、离心机(赛默飞世尔)、超微量紫外分光光度计(上海嘉鹏)、凝胶成像仪(德国耶拿)、PCR仪(赛默飞世尔)、水平电泳仪(伯乐)。
试验所用试剂中限制性内切酶、DNA Marker和Taq酶均为北京全式金生物技术股份有限公司产品,其余均为国产分析纯试剂。
1.3 DNA提取方法
1.3.1 改良CTAB法。参考余志雄等[14]的方法,并加以改进。取金边瑞香叶片0.1 g,加入0.05 g PVP-40,用液氮研磨成细粉后转入2 mL无菌EP管中。立即加入1 mL 65 ℃预热的提取缓冲液(100 mmol/L Tris-HCl、20 mmol/L EDTA ·Na2、1.4 mol/L NaCl、2% CTAB、5 mmol/L二乙基二硫代氨基甲酸)并加入40 μL β-巯基乙醇,漩涡混匀30 s,65 ℃水浴30 min。加入400 μL 5 mol/L 乙酸钾溶液(pH 4.8),混匀,冰水浴10 min。12 000 r/min离心10 min,吸取上清液。向上清液中加入等体积氯仿 ∶异戊醇(体积比24 ∶1),漩涡混匀。12 000 r/min离心10 min,吸取上清液。向上清液中加入等体积-20 ℃预冷异丙醇,轻柔颠倒混匀5次后-20 ℃静置10 min。12 000 r/min离心10 min,弃上清液,保留DNA沉淀。用75%乙醇重复洗涤、沉淀DNA 2次。吹干DNA沉淀,加入100 μL TE溶液溶解,置于-20 ℃保存备用。
1.3.2 SDS法。参考杨春霞等[15]的方法,并加以改进。取0.1 g 金边瑞香叶片加入液氮研磨成粉末后装入2 mL离心管中,加入1 mL提取缓冲液(2% SDS、100 mmol/L Tris-HCl、50 mmol/L EDTA·Na2、1.5 mol/L NaCl、6% PVP-40)和40 μL β-巯基乙醇,混匀,65 ℃水浴30 min。 再加入400 μL 4 mol/L乙酸钾溶液(pH 4.8),混匀,冰水浴10 min。12 000 r/min离心10 min,取上清液。向上清液中加入等体积氯仿 ∶异戊醇(体积比24 ∶1),混匀。12 000 r/min离心10 min,取上清液。向上清液中加入等体积-20 ℃预冷异丙醇,轻柔混匀,-20 ℃静置10 min。12 000 r/min离心10 min,弃上清液,保留DNA沉淀。加入700 μL 75%乙醇,混匀漂洗DNA沉淀。12 000 r/min离心5 min,弃上清液,保留DNA沉淀。用75%乙醇重复洗涤、沉淀DNA 2次。吹干DNA沉淀,加入100 μL TE溶液溶解,-20 ℃保存备用。
1.3.3 SDS-CTAB法。参考孙鑫等[16]的方法, 并加以改进。取金边瑞香叶片0.1 g加入液氮研磨成粉末后立即加入0.05 g PVP-40粉末,装入2 mL离心管中,立即加入1 mL提取缓冲液(100 mmol/L Tris-HCl、50 mmol/L EDTA·Na2、1mol/L NaCl、2% SDS,pH 8.0)和60 μL β-巰基乙醇,混匀,65 ℃水浴30 min。加入1/3体积5 mol/L 乙酸钾溶液(pH 4.8),混匀,冰水浴10 min。12 000 r/min离心10 min,取上清液,加入1/4体积CTAB buffer(100 mmol/L Tris-HCl、50 mmol/L EDTA·Na2、1 mol/L NaCl、10% CTAB,pH 8.0),混匀,65 ℃水浴15 min。加入等体积氯仿 ∶异戊醇(体积比24 ∶1),混匀。12 000 r/min离心10 min,取上清液。加入等体积-20 ℃预冷异丙醇,混匀,-20 ℃静置10 min。12 000 r/min离心10 min,弃上清液,保留DNA沉淀。用75%乙醇重复洗涤,沉淀DNA 2次。吹干DNA沉淀,加入100 μL TE溶液溶解,放-20 ℃保存备用。
1.3.4 高盐低pH法。参考邵亚林等[17]的方法,并加以改进。取0.1 g金边瑞香叶片,用液氮研磨成细粉后加入2 mL离心管中。立即加入1 mL 65 ℃预热的提取缓冲液 (100 mmol/L乙酸钠溶液、50 mmol/L EDTA·Na2、500 mmol/L NaCl、2% PVP-40,pH 5.5)和40 μL β-巯基乙醇,漩涡混匀30 s,65 ℃水浴30 min。12 000 r/min离心10 min,取上清液。向上清液中加入400 μL 2.5 mol/L 乙酸钾溶液(pH 4.8),混匀,冰水浴10 min。12 000 r/min离心10 min,取上清液。向上清液中加入等体积氯仿 ∶异戊醇(体积比24 ∶1),混匀。12 000 r/min离心10 min,取上清液。向上清液中加入等体积的-20 ℃预冷异丙醇,轻柔颠倒混匀5次后-20 ℃静置10 min。12 000 r/min离心10 min,弃上清液,保留DNA沉淀。加入700 μL 75%乙醇,混匀漂洗DNA沉淀。12 000 r/min离心5 min,弃上清液,保留DNA沉淀。用75%乙醇重复洗涤、沉淀DNA 2次。吹干DNA沉淀,加入100 μL TE溶液溶解,-20 ℃保存备用。
1.3.5 尿素法。参考白雪嵩等[18]的方法,加以改進。取金边瑞香叶片0.1 g加入液氮研磨成粉末,装入2 mL离心管中,立即加入1 mL提取缓冲液(8 mol/L 尿素、500 mmol/L NaCl、50 mmol/L Tris-HCl、20 mmol/L EDTA·Na2、2% PVP-40,pH 8.0)和40 μL β-巯基乙醇,混匀,65 ℃水浴30 min。加入400 μL 5mol/L 乙酸钾溶液(pH 4.8),混匀,冰水浴10 min。异戊醇(体积比24 ∶1),混匀。12 000 r/min离心10 min,取上清液。加入等体积-20 ℃预冷异丙醇,轻柔混匀多次,-20 ℃静置10 min。12 000 r/min离心10 min,弃上清液,保留DNA沉淀。加入700 μL 75%乙醇,混匀漂洗DNA沉淀;12 000 r/min离心5 min,弃上清液,保留DNA沉淀。用75%乙醇重复洗涤、沉淀DNA 2次。吹干DNA沉淀,加入100 μL TE溶液溶解,-20 ℃保存备用。
1.4 DNA质量检测
1.4.1 DNA浓度测定。
超微量紫外分光光度计检测5种方法所提取基因组DNA的OD260/280值、OD260/230值和DNA浓度。采用Statistix 8.0软件分析各处理间显著性(标记字母法,LSD0.05)。
1.4.2 琼脂糖凝胶电泳。
分别吸取不同方法提取的DNA样品6 μL与6×Loading Buffer 4 μL混匀,在1%琼脂糖凝胶上点样,在1×TAE缓冲液中120 V恒压电泳16 min后,在凝胶成像系统上观察、拍照。
1.4.3 酶切验证。对5种不同方法提取的DNA分别采用Sma I、Xba I双酶切,酶切反应体系为:10×T Buffer(+BSA) 2 μL、Sma I 1 μL、Xba I 1 μL、ddH2O 6 μL、DNA 10 μL。反应物轻柔混匀,37 ℃水浴反应3 h。1%琼脂糖凝胶点样,电泳检测,凝胶成像仪拍照记录。
1.4.4 ISSR-PCR检测。
采用ISSR UBC-842引物(引物序列:GAGAGAGAGAGAGAGAYG)对5种方法提取DNA进行PCR扩增,反应体系按照TransFast Taq DNA Polymerase(AP101)说明书配制。PCR反应程序为:94 ℃预变性3 min;94 ℃变性5 s;56 ℃复性15 s;72 ℃延伸15 s;循环34次,72 ℃延伸6 min;16 ℃保存。在1%琼脂糖凝胶上点样、电泳检测,凝胶成像仪上拍照记录。
2 结果与分析
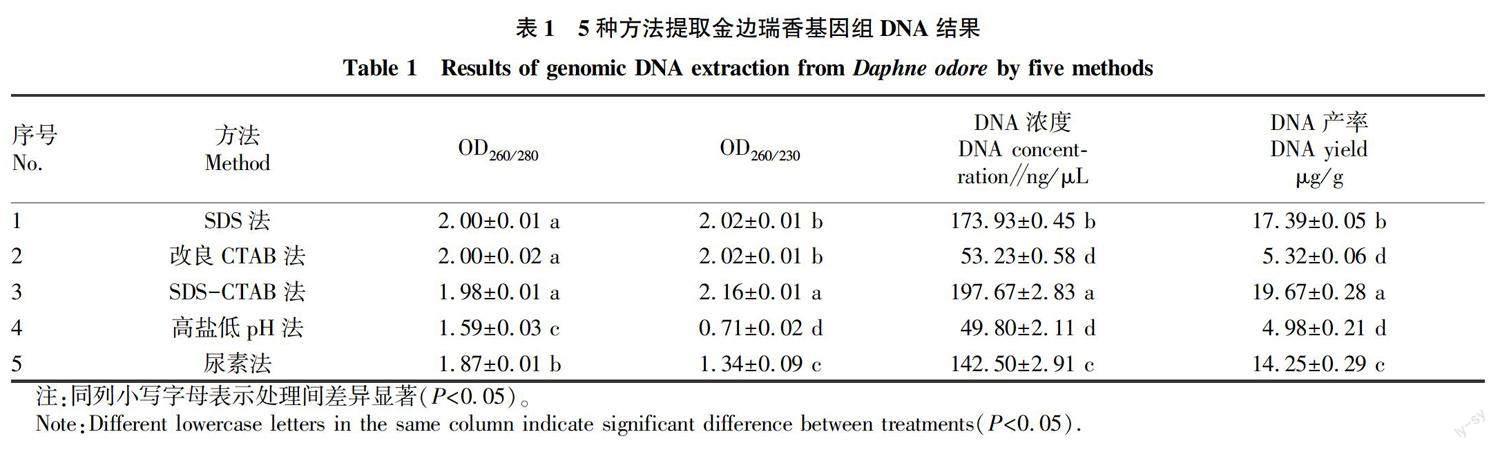
2.1 DNA浓度检测 由表1可知,SDS法、改良CTAB法和SDS-CTAB法提取的金边瑞香基因组DNA OD260/280值分别为2.00、2.00和1.98,都在1.90~2.00,且三者无显著性差异,表明这3种方法对RNA和蛋白质等大分子杂质去除比较干净,DNA纯度较高;高盐低pH法和尿素法提取的DNA OD260/280值分别为1.59和1.87,都小于1.90,表明蛋白质、RNA等大分子没有去除干净,降低了DNA纯度。SDS法、改良CTAB法和SDS-CTAB法提取的DNA OD260/230值大于2.00,且SDS-CTAB法的DNA OD260/230值最高,而高盐低pH法和尿素法提取的DNA OD260/230均小于1.85,说明SDS法、改良CTAB法和SDS-CTAB法去除小分子、酚类物质和盐等杂质的能力比高盐低pH法和尿素法更强。根据DNA浓度和产率结果可知,SDS-CTAB法所提DNA浓度与产率最高,SDS法次之,然后为尿素法,改良CTAB法和高盐低pH法所得到的数值相近且很低。
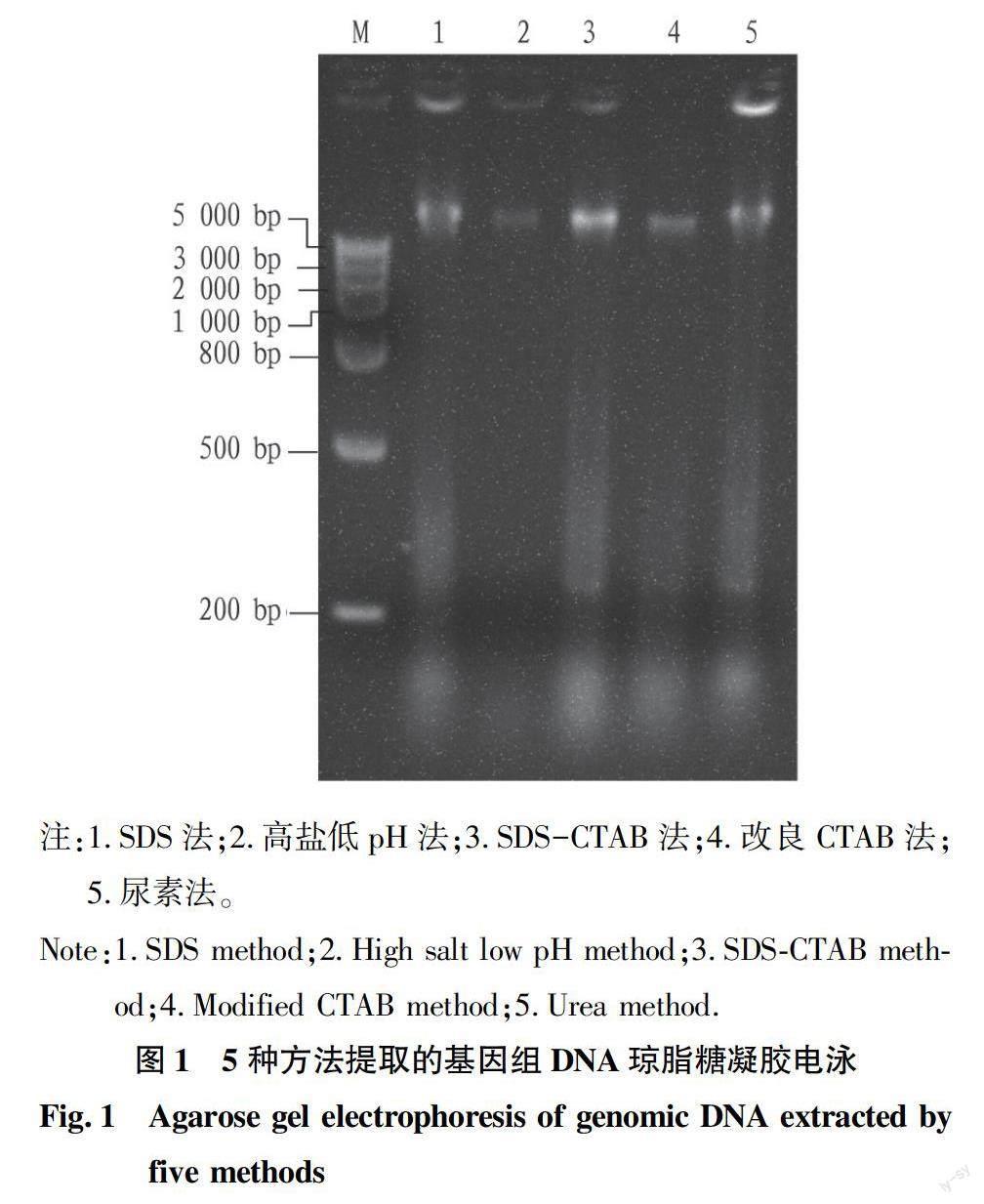
2.2 琼脂糖凝胶电泳检测 对5种方法提取的金边瑞香基因组DNA进行琼脂糖凝胶电泳检测(图1),结果发现,改良CTAB法和SDS-CTAB法提取的DNA点样孔内无显著荧光出现,表明这2种方法已经将大多数蛋白质、糖类和RNA等杂质去除,获得了较纯的DNA;但改良CTAB法提取的DNA样本亮度低,这说明该方法提取的基因组DNA浓度低。SDS法、高盐低pH法和尿素法提取的DNA点样孔中有较显著的荧光,而SDS法和尿素法存在拖尾现象,说明这3种方法去除蛋白质、糖类和RNA等杂质能力较差。这与表1中的结果一致。
2.3 酶切结果分析 对这5种方法提取的金边瑞香基因组DNA分别进行酶切验证(图2),结果发现,SDS-CTAB法提取的金边瑞香基因组DNA酶切电泳后呈弥散状,条带形成清晰完整的连续拖带,条带最宽,且点样孔中无荧光,表明该方法提取的DNA杂质含量少,DNA浓度高,质量最好。SDS法提取的DNA经双酶切电泳后,条带呈弥散状,有完整的连续拖带,点样空内无明显荧光,但条带宽度小于SDS-CTAB法所提,说明SDS法提取的金边瑞香DNA质量次之。尿素法提取的DNA酶切电泳后呈弥散状,有完整的连续拖带,点样空内少量荧光,但条带宽度较小,表明尿素法提取的DNA纯度不高。改良CTAB法提取的DNA酶切电泳后呈弥散状,有完整的连续拖带,但条带亮度暗,表明所提取的DNA浓度低。高盐低pH法提取的DNA酶切电泳后没有完整的连续拖带,条带窄且亮度暗,表明该方法提取的DNA质量最差。
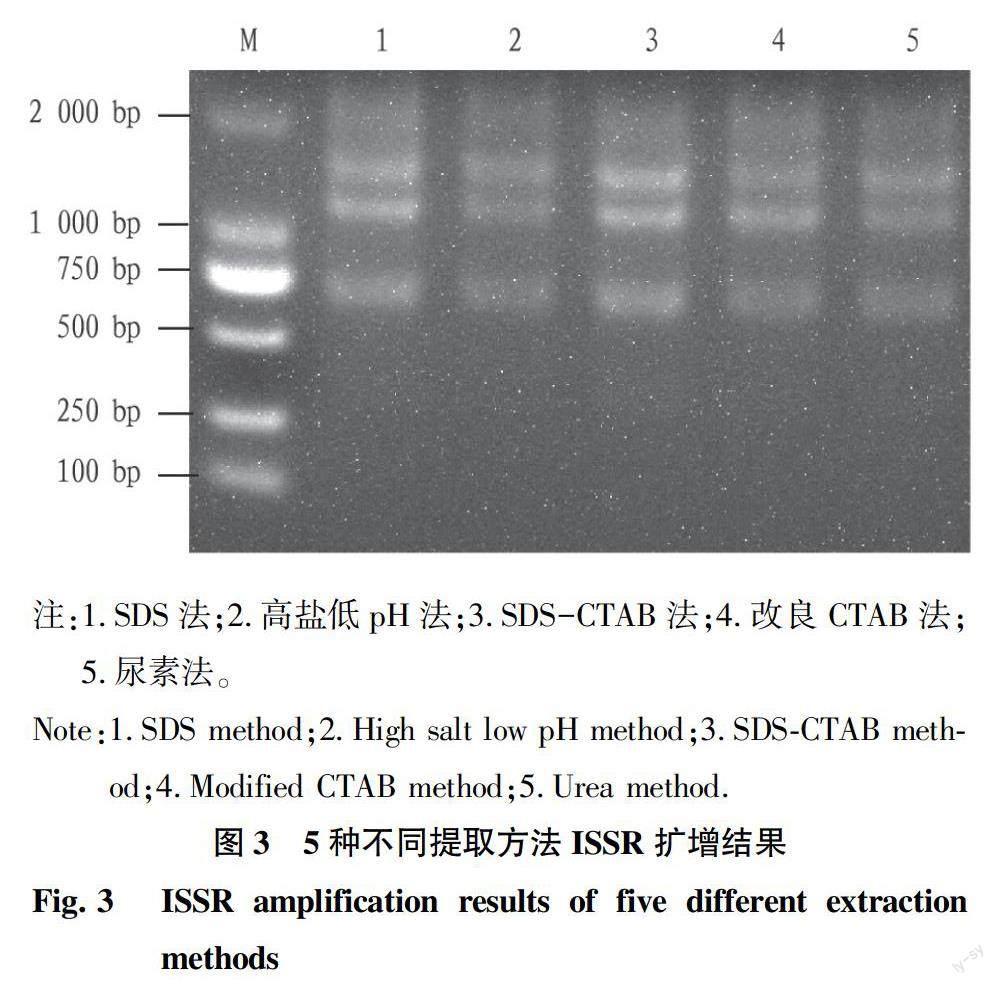
2.4 ISSR-PCR检测 以5种不同方法提取的金边瑞香基因组DNA为模板,采用UBC-842引物进行ISSR-PCR扩增后电泳检测(图3)。结果表明,5种方法提取的DNA经ISSR-PCR扩增、电泳后分别在1 500、1 200和740 bp处产生1个条带,但不同方法所提取DNA的PCR产物电泳后条带亮度存在一定差异。SDS-CTAB法相对另外4种方法的3个条带均为最亮,SDS法次之,改良CTAB法和尿素法条带亮度均较淡且相近,高盐低pH法条带亮度最暗。
3 结论与讨论
该试验采用的5种方法均能提取出金边瑞香基因组DNA,但不同方法的提取质量存在差别。5种方法中SDS法、改良CTAB法和SDS-CTAB法的OD260/280值均在1.98~2.00,尿素法和高盐低pH法OD260/280值都小于1.80,表明前3种方法对蛋白质和RNA等大分子去除较干净,DNA纯度较高,后2种方法所提DNA则仍含有大分子杂质。5种方法中SDS法、改良CTAB法和SDS-CTAB法的OD260/230值都大于2.00,表明这3种方法去除小分子、酚类物质和盐等杂质的效果更好。DNA浓度和产率结果表明,SDS-CTAB法所达到的水平最高,高盐低pH法最低。对不同方法所提DNA进一步进行琼脂糖凝胶电泳检测后也得出了一致的结果。5种方法提取的金边瑞香基因组DNA经过双酶切后均能产生酶切条带、ISSR-PCR检测也都能扩增出条带,但不同方法的酶切和ISSR-PCR电泳检测条带存在差异,其中,以SDS-CTAB法酶切效果及ISSR-PCR电泳结果最佳,这表明5种方法提取的DNA虽然都可以进行分子生物学相关试验,但提取质量存在差异。综上分析表明,不同方法提取金边瑞香基因组DNA质量表现为SDS-CTAB法>SDS法>尿素法>改良CTAB法>高盐低pH法。
获得高纯度、高浓度的基因组DNA是进行观赏植物功能基因研究、分子标记辅助育种和遗传多样性分析等分子生物学研究的基础保障[19-20]。影响植物DNA高效提取的因素有很多,主要包括多糖、色素、酚类物质和蛋白质等杂质[21-22],尤其是金边瑞香的根、莖、叶等组织中都富含多糖、酚类和黄酮类等次生代谢产物[3,8,23],因此提取纯化植物基因组DNA的关键在于高效地除去这些物质。该试验中SDS-CTAB法提取的金边瑞香基因组DNA浓度最高、纯度最好,完全可用于后续相关分子生物学研究。与孙鑫等[16]的方法相比,该研究采用SDS-CTAB法直接将PVP-40与植物样本粉末快速混匀,使PVP立即充分地络合干扰DNA纯度的多酚类物质,防止DNA氧化褐变。在提取缓冲液中适当提高β-巯基乙醇用量,以防止DNA断裂并更有效地破坏蛋白质的肽链[24],从而降解植物蛋白质及抑制细胞中多种酶活性。提取缓冲液中高浓度的NaCl有利于多糖去除,而提取液中依次加入高浓度乙酸钾溶液、CTAB buffer可以更有效地除去多糖[25]。多次去除多糖,有助于高质量DNA的获得[26]。氯仿/异戊醇抽提可以进一步去除样本中的脂类、蛋白质等杂质,从而提高DNA纯度与产率。
该试验对金边瑞香基因组DNA的提取方法进行了比较研究,发现SDS法、改良CTAB法、SDS-CTAB法、高盐低pH法和尿素法对金边瑞香样本中多糖、酚类和蛋白质等杂质均可以不同程度地去除而分离获得DNA,但SDS-CTAB法提取的DNA质量与产率最佳,各项指标都优于其他4种方法。金边瑞香基因组DNA高质量提取方法的构建将为后续相关分子生物学的研究提供参考与借鉴。
参考文献
[1] 江西植物志》编辑委员会.江西植物志:第2卷 瑞香科[M].北京:中国科学技术出版社,2004:591-592.
[2] 袁菊红.外源亚精胺对越冬金边瑞香抗寒性的影响[J].西北农林科技大学学报(自然科学版),2012,40(5):129-135.
[3] 张伟.金边瑞香活性成分提取分离及抗氧化活性研究[D].南昌:南昌大学,2008.
[4] 叶和杨,曾靖,杨敬格,等.金边瑞香的抗炎症作用[J].赣南医学院学报,2002,22(1):7-11.
[5] 周华,刘腾云,高柱,等.中国金边瑞香研究进展[J].江西科学,2007,25(1):51-53,61.
[6] 梁木根,谢余龙.扬优成势,小花朵兴成大产业:大余县花卉苗木产业发展情况调研报告[J].现代园艺,2011(4):8-9.
[7] 罗素梅,周勇辉,张远福,等.不同扦插基质对金边瑞香扦插生根的影响[J].南方林业科学,2020,48(5):41-43,61.
[8] 江洪如,余发新,刘腾云,等.金边瑞香茎尖脱毒及快繁技术[J].南昌大学学报(理科版),2008,32(1):59-61,65.
[9] 周勇辉,罗素梅,郭荣生,等.金边瑞香水培扦插繁殖试验技术研究[J].安徽农业科学,2021,49(4):50-52.
[10] OTSUKI K,LI W,MIURA K,et al.Isolation,structural elucidation,and anti-HIV activity of daphnane diterpenoids from Daphne odora[J].Journal of natural products,2020,83(11):3270-3277.
[11] 钱少娟.瑞香属的叶绿体基因组特征与系统学研究[D].昆明:云南师范大学,2021.
[12] 陈宗游,孔德鑫,蒋运生,等.短序十大功劳基因组总DNA提取方法研究[J].基因组学与应用生物学,2013,32(5):633-638.
[13] ABDEL-LATIF A,OSMAN G.Comparison of three genomic DNA extraction methods to obtain high DNA quality from maize [J].Plant methods,2017,13:1-9.
[14] 余志雄,欧高政,陈清西,等.火龙果总DNA提取方法比较研究[J].中国农学通报,2010,26(4):300-303.
[15] 杨春霞,叶金山,温强,等.枳壳基因组DNA提取方法的比较研究[J].中国农学通报,2009,25(19):32-36.
[16] 孫鑫,崔洪志,胡宝忠,等.SDS-CTAB结合法提取棉花总DNA[J].生物技术通报,2004(5):45-47.
[17] 邵亚林,司俊波,常玮,等.杏黄兜兰基因组DNA提取方法比较[J].园艺学报,2019,46(12):2449-2454.
[18] 白雪嵩,赵昶灵,陈中坚,等.5种提取三七基因组DNA方法的比较[J].江苏农业科学,2014,42(5):54-56.
[19] 胡庆林,江琴,黄钰麟,等.两种虾脊兰属植物DNA提取方法的优化[J].分子植物育种,2019,17(2):494-501.
[20] 曾慧,荣华,罗彩霞,等.枸骨基因组DNA提取方法比较研究[J].长江大学学报 (自然科学版),2019,16(2):78-80.
[21] MARTNEZ-GONZLEZ C R,RAMREZ-MENDOZA R,JIMNEZ-RAMREZ J,et al.Improved method for genomic DNA extraction for Opuntia Mill.(Cactaceae)[J].Plant methods,2017,13:1-10.
[22] 农全东,张明永,张美,等.火龙果茎基因组DNA提取方法改良[J].植物学报,2019,54(3):371-377.
[23] OKUNISHI T,TAKAKU N,WATTANAWIKKIT P,et al.Lignan production in Daphne odora cell cultures[J].The Japan wood research society,2002,48(3):237-241.
[24] 严廷良,许惠秋,张颖,等.改良CTAB法对提取玫瑰DNA质量的影响[J].海南师范大学学报(自然科学版),2014,27(4):412-415.
[25] GREEN M R,SAMBROOK J.Molecular cloning: A laboratory manual[M].Fourth Edition.New York:Cold Spring Harbor Laboratory Press,2017.
[26] 张金丽,张罗霞,杨坤梅,等.改良CTAB法对山茶属植物基因组DNA提取的比较研究[J].江西农业大学学报,2017,39(4):785-791.
