人参总RNA提取方法及反转录酶的比较
2015-09-10张涛韩梅刘翠晶等
张涛+韩梅+刘翠晶等
摘要: 为了探索人参根、叶片总RNA的提取方法,以多年生人参根、叶片为材料,比较7种提取方法的总RNA质量。结果表明:除改良CTAB法对人参根总RNA的提取效果不明显,其余方法均能从人参根、叶片中提取、分离到总RNA,其中 RNAPure 高纯总 RNA 快速提取试剂盒法能提取到完整性较好、纯度较高的总RNA,琼脂糖凝胶电泳显示的条带清晰完整,根中RNA的D260 nm/D280 nm为1.87,RNA浓度为351.8 ng/μL;用Reverse Transcriptase M-MLV(RNase H-)试剂盒、PrimeScript Reverse Transcriptase试剂盒、GoScript TM Reverse Transcription System试剂盒对提取的总RNA进行反转录,其中用GoScript TM Reverse Transcription System试剂盒反转录后进行PCR扩增,琼脂糖凝胶电泳条带较亮,证明转录效果较好。经反转录、PCR证明,提取的总RNA适用于后续的分子试验研究。
关键词: 人参;根;叶片;总RNA;提取方法;反转录酶
中图分类号: S567.5+10.1 文献标志码: A
文章编号:1002-1302(2015)08-0034-04
人参为五加科人参属植物,素有“东北三宝”的美誉,人参皂苷为人参的主要药效成分,具有较好的抗肿瘤、提高机体免疫力、改善心脑血管供血不足、抑制细胞凋亡等药理活性 [1-3],目前人们已经从人参中分离到了约90个人参皂苷单体 [4-5]。人参皂苷的含量是判断人参质量的主要标准,但是目前对人参功能基因和次生代谢生物合成途径的研究相对较少,人参皂苷的产率较低,次生代谢产物人参皂苷尚未实现人工合成,对于一些含量甚微的单体皂苷的新药开发还较为困难 [6]。人参皂苷的生物合成途径与功能基因表达量之间的关系仍处于探究阶段 [7],因此深入了解人参皂苷的生物合成途径及其调控机理,并在分子水平上实现人参皂苷的人工合成,这是利用生物技术手段大量生产人参皂苷的必要前提。
为了探究人参皂苷生物合成途径与功能基因表达量之间的关系,首要的问题是提取完整性好、纯度高的总RNA。由于植物细胞组成成分复杂多样,使得植物组织总RNA的提取难于其他生物材料。成熟的人参组织中含有大量的酚类、糖类,人参组织的研磨过程破坏了酚类物质与多酚氧化酶的平衡分布,酚类极易被氧化成醌,并易与RNA分子发生不可逆结合,产生褐化反应 [8],从而影响RNA的提取,导致RNA的产量、质量较差。本研究比较了7种提取人参根、叶片总RNA的方法,筛选出适合提取人参根、叶片总RNA的提取方法,并用该方法提取出完整性好、纯度高的总RNA。反转录可以检测提取的总RNA质量,反转录酶的不同直接决定反转录效果,本试验比较了3种反转录酶对总RNA的转录情况,筛选出转录效果较好的方法,为人参皂苷合成途径中功能基因的克隆与功能研究奠定了一定的理论基础。
1 材料与方法
1.1 试验材料
五年生人参取自吉林省抚松县抚南林场(42°03′06″N,127°33′21″E,海拔903 m),用刀将根部切成小块,放入冻存管迅速用液氮冷冻,于-80 ℃保存待用,叶片进行同样处理,试验所用部位为人参根、叶片。
1.2 试剂与仪器
1.2.1 试剂 TaKaRa MiniBEST总RNA提取试剂盒(TaKaRa,大连);多糖多酚植物总 RNA快速提取试剂盒、RNAPure高纯总RNA快速提取试剂盒(BioTeke,长春);RNeasy Plant Mini 试剂盒(Qiagen,德国);EASY spin Plus植物RNA快速提取试剂盒(艾德莱,北京);Reverse Transcriptase M-MLV(RNase H-)、PrimeScript Reverse Transcriptase 2个反转录试剂盒(TaKaRa,大连);GoScript TM Reverse Transcription System反转录试剂盒(Promega,北京);异硫氰酸胍;DEPC(焦磷酸二乙酯);CTAB(十六烷基三甲基溴化铵);DL2000 DNA Marker(TaKaRa,大连);生化试剂酚、三氯甲烷、异戊醇等均为国产分析纯。试验中所用的塑料制品如 Eppendorf 管、枪头等均为RNase free制品,玻璃器皿、研钵等于180 ℃干热灭菌8 h。
1.2.2 仪器 ND 2000超微量核酸蛋白测定仪(德国K&A公司);Eppendorf Mastercycler nexus PCR仪(西班牙Cene Amp);DYY-8C琼脂糖凝胶电泳仪(北京市六一仪器厂);GIS-2010凝胶成像系统(上海天能科技有限公司);HC-2518R 高速冷冻离心机(安徽中科中佳科学仪器有限公司);MDF-382E超低温冰箱(日本SANYO)等。
1.3 总RNA提取
1.3.1 改良CTAB法 [9] 取约100 mg材料,加液氮研磨成粉后转移至预冷的1.5 mL离心管中,加入10×质量浓度的 CTAB(临用时加入1% β-巯基乙醇),充分悬浮,于65 ℃水浴10 min;加入等体积三氯甲烷 ∶ 异戊醇(体积比=24 ∶ 1),轻轻混匀,14 000 r/min 离心10 min;取上清,加入等体积三氯甲烷 ∶ 异戊醇(体积比=24 ∶ 1),轻轻混匀,14 000 r/min 离心10 min;取上清,加入1/4体积3 mol/L LiCl,-80 ℃ 放置2 h;从冰箱中取出,[JP2]待液体在冰上溶解,于4 ℃、14 000 r/min 离心10 min;弃上清,加入适量TE,沉淀溶解混匀后,于4 ℃、14 000 r/min离心10 min;取上清,加入等体积饱和酚,充分混匀,于室温、14 000 r/min 下离心10 min;取上清,加入等体积酚 ∶ 三氯甲烷 ∶ 异戊醇(体积比=25 ∶ 24 ∶ 1), 充分混匀,于室温、14 000 r/min下离心10 min;取上清,加入等体积三氯甲烷 ∶ 异戊醇(体积比=24 ∶ 1),充分混匀,于室温、14 000 r/min下离心10 min;取上清,加入1/4体积LiCl,于 -80 ℃ 放置2 h;从冰箱中取出,待液体在冰上溶解,于4 ℃、14 000 r/min 下离心15 min;弃上清,用70%乙醇洗涤沉淀,于4 ℃、14 000 r/min下离心10 min;弃上清,待乙醇挥发后加入40 μL灭菌的DEPC水溶解沉淀,将所得的RNA溶液于 -80 ℃ 保存。
1.3.2 酸性-异硫氰酸胍-三氯甲烷法 取100 mg材料,加液氮研磨成粉,将粉末状组织转移至装有1 mL变性溶液D(在293 mL水中加入250 g异硫氰酸胍、17.6 mL 0.75 mol/L 柠檬酸钠、26.4 mL 10%十二烷基肌氨酸钠溶液,在可加热的磁力搅拌器上于65 ℃下搅拌,直到所有成分溶解后于室温存放)的[JP2]Eppendorf管中,在1 mL溶液D中按顺序加入0.1 mL 2 mol/L 乙酸钠(pH值4.0)、1 mL苯酚、0.2 mL三氯甲烷 ∶ 异戊醇=49 ∶ 1,盖紧离心管,颠倒数次,充分混匀;漩涡振荡器上剧烈振荡10 s,然后将离心管于冰上放置15 min,于 4 ℃、9 000 r/min 下离心20 min;取上清,加入等体积的异丙醇,混匀后于-20 ℃放置至少1 h,于4 ℃、9 000 r/min下离心 30 min;小心将异丙醇倒掉,第1步中每用1 mL溶液D,就用0.3 mL溶液D;将溶液转移到1个离心管中漩涡振荡,加入等体积的异丙醇,于-20 ℃放置至少1 h;于4 ℃、12 000 r/min 下离心10 min,用 75%乙醇洗涤沉淀2次,再次离心,用移液器吸去残留的乙醇,将离心管敞口在工作台上放置数分钟,使乙醇挥发;加入40 μL DEPC处理过的水,将RNA溶液于-80 ℃保存。
1.3.3 相关试剂盒的操作 Takara MiniBEST总RNA提取试剂盒、多糖多酚植物总RNA快速提取试剂盒、RNAPure高纯总RNA快速提取试剂盒、EASY spin Plus植物RNA快速提取试剂盒、RNeasy Plant Mini 试剂盒的操作分别参照相应的说明书进行。
1.4 总RNA质量的检测
1.4.1 总RNA完整性的检测 取5 μL从上述方法中提取的总RNA样品,在1.5%琼脂糖凝胶上进行电泳检测,180 V 恒压 10 min,于凝胶成像仪中成像,在紫外灯下观察RNA条带,并照相记录。
1.4.2 总RNA纯度与产率检测 取2 μL用以上方法提取的总RNA样品,于ND2000超微量核酸蛋白测定仪上检测,记录总RNA浓度值、D260 nm/D280 nm、D260 nm/D230 nm,并计算产率。
1.5 cDNA的合成
Reverse Transcriptase M-MLV(RNase H-)试剂盒、PrimeScript Reverse Transcriptase试剂盒、GoScript TM Reverse Transcription System试剂盒的操作均参照相应的试剂盒说明书进行。
1.6 cDNA的检测
用PrimeScript Reverse Transcriptase试剂盒、Reverse Transcriptase M-MLV(RNase H-)试剂盒、GoScript TM Reverse Transcription System试剂盒对RNAPure高纯总RNA快速提取试剂盒提取的根总RNA进行反转录,得到cDNA [10]。以得到的cDNA为模板进行PCR扩增,反应体系为:7.4 μL 去离子水,10 μL 2×Taq PCR Mix,各0.8 μL上、下游引物,1 μL模板RNA 。反应程序:94 ℃ 预变性3 min;94 ℃ 变性30 s,52 ℃ 退火30 s,72 ℃ 延伸 2 min,35个循环;72 ℃延伸 10 min。取4 μL扩增产物在1.5%琼脂糖凝胶电泳上检测。
2 结果与分析
2.1 琼脂糖凝胶电泳总RNA完整性检测
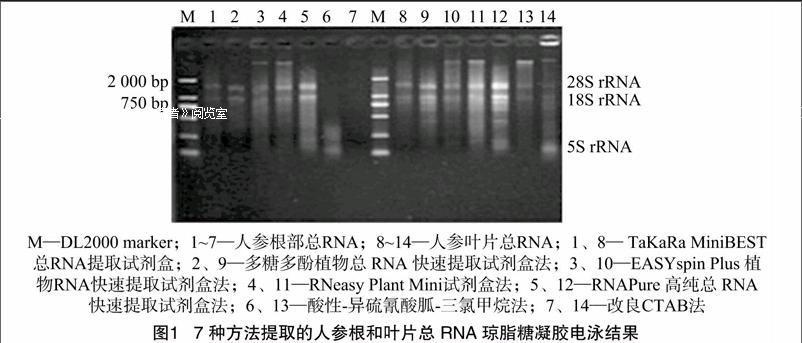
由图1可见,用不同方法从人参根部、叶片提取的总RNA中,除改良CTAB法、酸性-异硫氰酸胍-三氯甲烷法没有清晰的条带,其余方法均可见28S、18S等2条电泳条带。与其他几种方法相比,RNAPure高纯总RNA快速提取试剂盒法提取的根部、叶片总RNA条带清晰明亮、稳定,28S条带的宽度约为18S的2倍,说明该方法提取的总RNA质量较高、完整性较好。酸性-异硫氰酸胍-三氯甲烷法、改良CTAB法提取的根部总RNA电泳结果中基本上没有看到RNA条带,而这2种方法提取的人参叶片总RNA电泳图谱的亮度较弱,获得率较低,有明显的DNA、蛋白污染;Takara MiniBEST总RNA提取试剂盒法图谱条带亮度较弱、获得率低,存在蛋白污染,但是它对DNA的消除较彻底;多糖多酚植物总RNA快[CM(25]速提取试剂盒法图谱较为清晰、明显拖带,有明显的
降解现象,对多酚多糖的消除效果较好;EASY spin Plus 植物RNA快速提取试剂盒法图谱模糊、明显拖带,存在DNA、蛋白污染,有明显的RNA降解现象;RNeasy Plant Mini 试剂盒法图谱较为清晰、明显拖带,存在DNA污染,有明显的RNA降解现象。
2.2 总RNA纯度检测
将用TaKaRa MiniBEST总RNA提取试剂盒、多糖多酚植物总RNA快速提取试剂盒、EASY spin Plus 植物RNA快速提取试剂盒、RNeasy Plant Mini 试剂盒、RNAPure高纯总RNA快速提取试剂盒、酸性-异硫氰酸胍-三氯甲烷法、改良CTAB法提取的总RNA在超微量核酸蛋白检测仪上检测,结果如表1所示。
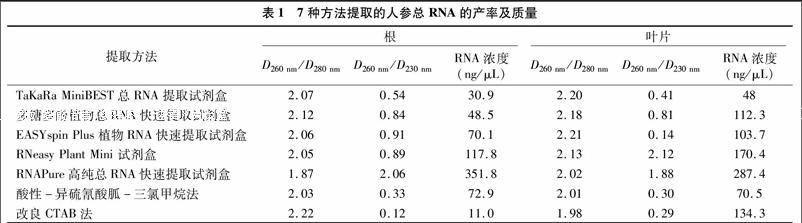
当D260 nm/D280 nm值在1.8~2.0时,D260 nm/D230 nm值接近2.0,表明RNA样品较纯净。由表1可见,用TaKaRa MiniBEST总RNA提取试剂盒、多糖多酚植物总RNA快速提取试剂盒、EASYspin Plus 植物RNA快速提取试剂盒、RNeasy Plant Mini 试剂盒、酸性-异硫氰酸胍-三氯甲烷法、改良CTAB法提取的根或叶片总 RNA D260 nm/D280 nm值都有接近20[JP2]的。TaKaRa MiniBEST总RNA提取试剂盒、EASY spin Plus 植物RNA快速提取试剂盒提取的叶片以及改良CTAB 法提取的根总RNA D260 nm/D280 nm的值≥2.2,说明有核苷酸降解。
RNAPure高纯总RNA快速提取试剂盒提取的根、叶片总RNA D260 nm/D280 nm分别为187、2.02,在1.8~2.0之间,说明可以去除蛋白质和酚类物质的干扰。用 RNAPure高纯总RNA快速提取试剂盒提取的根、叶片总RNA D260 nm/D230 nm分别为2.06、1.88,用RNeasy Plant Mini 试剂盒提取的叶片总RNA D260 nm/D230 nm为212,接近2.0,说明RNA纯度高,不存在多糖、蛋白质、酚类物质等杂质。而其余方法提取的根、叶片总RNA D260 nm/D230 nm均低于2.0,说明受到基因组DNA的干扰,不能有效地去除其中的萜类化合物等次生代谢物,这与电泳结果相符。
TaKaRa MiniBEST总RNA提取试剂盒、多糖多酚植物总RNA快速提取试剂盒、EASY spin Plus 植物RNA快速提取试剂盒、酸性-异硫氰酸胍-三氯甲烷法、改良CTAB法5种方法获得的根、叶片总RNA浓度都较低(表1),RNeasy Plant Mini 试剂盒、RNAPure高纯总RNA快速提取试剂盒获得的根、叶片总RNA浓度相对较高,用RNeasy Plant Mini 试剂盒提取,获得根、叶片的浓度分别为117.8、170.4 ng/μL,而RNAPure高纯总RNA快速提取试剂盒获得的根、叶片产率分别为351.8、287.4 ng/μL(表1)。后者浓度之所以相对较高是因为它独有的裂解液可以有效地消除基因组污染、稳定性好,而且没有异丙醇、乙醇洗涤过程,RNA可以直接从离心柱上洗脱,避免了过去干燥不易溶解的问题,因此其RNA产率相对较高。
2.3 不同反转录酶合成cDNA的检测
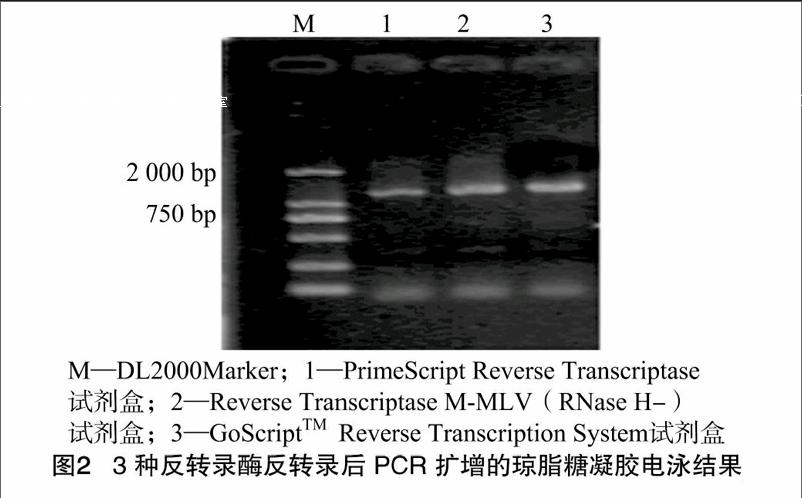
以PrimeScript Reverse Transcriptase试剂盒、Reverse Transcriptase M-MLV(RNase H-)试剂盒、GoScript TM Reverse Transcription System试剂盒对RNAPure高纯总RNA快速提取试剂盒提取的人参根总RNA进行反转录得到的cDNA为模板,采用[WTBX][STBX]PgSS1 [STBZ]基因的引物进行PCR扩增,扩增产物经琼脂糖凝胶电泳检测,结果如图2所示。
经PrimeScript Reverse Transcriptase试剂盒、Reverse Transcriptase M-MLV(RNase H-)试剂盒、GoScript TM Reverse Transcription System试剂盒对人参根总RNA进行反转录得到cDNA,根据已报道的人参[WTBX][STBX]PgSS1 [STBZ]基因设计引物:[WTBX][STBX]PgSS1 [STBZ]F,5′-
AAATGGGAAGTTTGGGGGC-3′;[WTBX][STBX]PgSS1 [STBZ]R,5′-GGGTTCTCACTGTTTGTTCAG-3′;在PgSS1基因的引物下进行的PCR均能得到1条碱基数在1 000~2 000 bp之间的片段,且条带清晰;而经GoScript TM Reverse Transcription System试剂盒反转录的cDNA扩增出的片段亮度明显高于PrimeScript Reverse Transcriptase试剂盒、Reverse Transcriptase M-MLV(RNase H-)试剂盒,而且没有拖带现象,证明其专一性比较强,反转录效率较高,但是3种方法得到的cDNA均可用于后续的分子研究。
3 结论与讨论
提取完整性好、纯度高的RNA是进行Northern杂交分析、基因克隆、逆转录PCR(RT-PCR)、建立cDNA文库、基因功能分析等分子生物学研究的关键。本试验通过对几种不同提取人参根、叶片总RNA的方法进行比较,以期找出1种高效、快速且适合提取人参总RNA的方法,为后续的研究提供一定的理论基础和技术经验。
由于人参中含有多糖、酚类的影响,采用改良CTAB法和酸性-异硫氰酸胍-三氯甲烷法从人参中提取的总RNA质量不好。随着人参的生长和成熟,多糖、多酚的含量也随之提高,这些都会给人参总RNA的提取及后续试验造成很大的障碍,成熟的人参中含有大量的酚类物质,在有氧的条件下,酚类极易被氧化成醌并易与RNA分子产生不可逆的结合,进而干扰RNA的提取过程 [11-12]。RNase 是一种核酸内切酶,对RNA有水解作用,但对DNA不起作用,RNase非常稳定,在试验中研磨破碎细胞的过程中,内源RNase会造成RNA的酶解;试验过程中操作的速度、手法对RNA的降解也较严重。因此,无论是内源RNase还是外源RNase都会使提取的RNA发生降解,它是导致RNA降解最主要的物质,给试验带来很大的困难 [13]。人参中还含有较多的多糖、蛋白质,而多糖的结构与 RNA相近,很难将它们分离开,所以在去除多糖的同时RNA也会被带走,造成RNA产量下降 [14],而在沉淀RNA时,可能形成多糖的凝胶状沉淀,这种含有多糖的RNA很难溶于水,或溶解后产生黏稠状溶液,而且多糖抑制了许多酶的活性,因此人参根的含糖量比叶片高,所以同种方法提取的叶片RNA明显好于根 [15]。蛋白质对RNA的污染也是一个重要因素,因而要获得高质量的 RNA就要尽可能地去除蛋白质,在沉淀蛋白质环节中尽量不要吸附到沉淀,因为污染了多糖、蛋白质的RNA样品很难用于进一步的分子生物学研究。
本试验采用酸性-异硫氰酸胍-三氯甲烷法、改良CTAB法提取人参根、叶片的总RNA质量较差,而TaKaRa MiniBEST总RNA提取试剂盒的提取过程中加有DNase1消化,有效地去除了基因组DNA的干扰,多糖多酚植物总RNA快速提取试剂盒可有效地去除多糖多酚对RNA的影响,EASYspin Plus植物RNA快速提取试剂盒独有的DNA消除柱可有效地去除基因组DNA的干扰,RNeasy Plant Mini 试剂盒使用了硅基质膜,以增强对RNA的吸附能力。以上方法虽然能得到完整性较好的RNA,但含有的杂质较多,并且降解较多,说明其不适用于人参材料总RNA的提取。而 RNAPure高纯总RNA快速提取试剂盒简单、便捷,其独有的裂解液可有效地裂解组织液,使其得到纯度高、完整性好、产率高的总RNA,是提取人参材料总RNA比较理想的方法。本试验比较了PrimeScript Reverse Transcriptase试剂盒、Reverse Transcriptase M-MLV(RNase H-)试剂盒、GoScript TM Reverse Transcription System试剂盒对人参根总RNA反转录得到 cDNA 的效果,结果表明,GoScript TM Reverse Transcription System试剂盒对RNA的反转录效果较好,比较适用于人参根部材料,为后续分子试验奠定了一定的理论基础。
参考文献:
[1] 王海南. 人参皂苷药理研究进展[J]. 中国临床药理学与治疗学,2006(11):1201-1206.
[2]朴英花,朴惠顺. 倍半萜类化合物生物活性研究进展[J]. 职业与健康,2012,28(18):2291-2293.
[3]周建平,王志斌,刘红艳. 慢肝养阴胶囊对肝损伤模型保护作用的实验研究[J]. 中国实验方剂学杂志,2004,10(5):35-37.
[4]黎 阳,张铁军,刘素香,等. 人参化学成分和药理研究进展[J]. 中草药,2009(1):164-166.
[5]郭秀丽,高淑莲. 人参化学成分和药理研究进展[J]. 中医临床研究,2012,4(14):26-27.
[6]杜丽娜,张存莉,朱 玮,等. 植物次生代谢合成途径及生物学意义[J]. 西北林学院学报,2005,20(3):150-155.
[7]侯双利,刘翠晶,杨利民,等. 人参鲨烯环氧酶基因的克隆与序列分析[J]. 吉林农业大学学报,2014(2):149-152,170.
[8]高双成,施 江,王世华,等. 一种牡丹花瓣总RNA的提取方法[J]. 河南农业科学,2007(10):93-94.
[9]刘 洋,何心尧,马红波,等. 用CTAB-PVP法提取棉花各组织总RNA的研究[J]. 中国农业大学学报,2006,11(1):53-56.
[10] 邢朝斌,龙月红,李非非,等. 刺五加鲨烯合酶基因家族两成员的表达及其与皂苷含量的关系[J]. 西南农业学报,2014(3):1252-1255.
[11]胡 薇,白 石,祝涛,等. 人参根组织RNA提取方法的研究与优化[J]. 吉林农业大学学报,2010,32(5):505-508,522.
[12]蔡斌华,张计育,高志红,等. 一种改良的提取草莓属叶片总RNA的方法[J]. 江苏农业学报,2008,24(6):875-877.
[13]谭丽丽,燕正民,徐亚英,等. 番茄叶片总RNA提取方法的比较[J]. 东北农业大学学报,2010,41(4):29-32.
[14]李 宏,王新力. 植物组织RNA提取的难点及对策[J]. 生物技术通报,1999(1):36-39.
[15]葛晓萍,石琰璟. 一种适合富含多糖、多酚植物的RNA提取方法[J]. 青岛科技大学学报:自然科学版,2007(1):6-8.
