载5-氟尿嘧啶细胞囊泡对结直肠癌细胞株HCT116的杀伤作用
2023-07-04孙建海魏武杰马燕凌
孙建海, 晏 菲, 魏武杰, 邓 洁, 李 黎, 刘 莉, 马燕凌
(江汉大学附属湖北省第三人民医院肿瘤科, 湖北 武汉 430000)
结直肠癌(CRC)可导致正常结肠黏膜恶化为浸润性肠黏膜[1],遗传和环境因素等许多风险因素都会导致CRC的发生[2]。手术是早期CRC病例的金标准治疗方法,但绝大多数CRC患者术后生存率较低。细胞外囊泡(EV)是一种球形脂质双层,EV可以将蛋白质、糖蛋白、脂质、核酸和细胞因子从母体细胞转移到受体细胞,以促进受体细胞的表型变化,并在细胞间通讯中发挥重要作用。EV可以携带母体细胞成分以影响各种生物过程,包括:DNA转移、细胞代谢物输出、细胞间通讯等。细胞外囊泡由于其可修饰性、有效的装载能力和天然的肿瘤靶向特性而被广泛用作抗肿瘤药物的递送工具[3,4]。研究发现,5-氟尿嘧啶与结直肠癌患者来源的EV有机结合就形成了载5-氟尿嘧啶细胞囊泡,其具有高效靶向性、特异性高以及副作用小等特点。微小RNA(miRNA)是19-24个核苷酸的小型非编码RNA,已被确定为多种癌症类型的潜在标志物,包括CRC[5]。大量的miRNA与CRC的发展或总体存活率低有关。例如,在转移性CRC患者中,miR-30d-5p血浆水平有所提高。基于miRNA的微阵列显示miR-128是CRC细胞中最显著上调的miRNA之一,miR-128过表达有助于促进细胞迁移和侵袭[6]。本研究拟探讨载5-氟尿嘧啶细胞囊泡对结直肠癌细胞株HCT116的杀伤作用,为结直肠癌的治疗提供依据。
1 材料与方法
1.1试剂及仪器:DMEM-F12(Sigma-Aldrich Chemical Company),FBS(System Biosciences),1×抗生素和抗真菌剂(Life technologies),10%胎牛血清(FBS;Hyclone;GE Healthcare Life Sciences),Dulbecco改良Eagle培养基(DMEM)完全培养基(Sigma),链霉素、青霉素(Gibco;Thermo Fisher Scientific),CCK-8溶液(Yeasen),FITC-膜联蛋白、碘化丙锭(PI)(BioLegend),Transwell室(BD Biosciences)、Matrigel(Corning),TRIzol试剂盒(Invitrogen),miScript 逆转录试剂盒(Qiagen),SYBR Premix EX Taq(TaKaRa Otsu Shiga),逆转录试剂盒(Promega),IQTM SYBR Green Supermix试剂盒(Bio-Rad),Radio Immunoprecipitation Assay裂解缓冲液、二辛可宁酸蛋白质测定试剂盒(Thermo Fisher),一抗PIK3兔多克隆抗体、GAPDH兔铵多克隆抗体(Abcam,Cambridge),辣根过氧化物酶标记的山羊抗兔IgG(Abcam Cambridge)。SpectraMax M5酶标仪(Molecular Devices),流式细胞仪(BD Biosciences),Cell QuestPro软件(BD Biosciences),Applied Biosystems 7500系统(Applied Biosystems)。
1.2细胞外囊泡分离:结直肠癌细胞株HCT116在DMEM-F12中生长,含有10%EV消耗的FBS和1×抗生素和抗真菌剂培养48h后,通过不同的离心方法将EV从培养基中分离出来。将收集的培养基以300g离心10min,然后以2000g离心25min。通过0.22μm过滤器收集上清液。使用获得的培养基在100000g和4℃下离心60min来制造EV。然后弃去上清液。在相同条件下,将培养基超速离心并用磷酸盐缓冲盐水(PBS)重悬用于后续分析。提取的EV由日立JEM-2100透射电子显微镜(日本电子有限公司)鉴定。
1.3细胞培养及分组:结直肠癌细胞株HCT116购自Be Na Culture Collection。细胞系均在含有10%胎牛血清的Dulbecco改良Eagle培养基(DMEM)完全培养基中培养,添加100U/mL链霉素和100U/mL青霉素。所有细胞系均置于37℃、5%CO2恒温培养箱中培养备用。HCT116组、细胞囊泡组、5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组培养方法HCT116组的培养方法如前所述;细胞囊泡组加入EV混悬液5mL(106个/mL);5-氟尿嘧啶组加入5-氟尿嘧啶5mL(30μg/mL);5-氟尿嘧啶载药囊泡组加入载药囊泡混悬液5mL,载药囊泡混悬液的制备方法如下:取5-氟尿嘧啶30μg,溶于1mL EVs混悬液中,在37℃恒温培养箱中孵育1h,9168r/min离心10min,经0.22μm过滤器过滤;30900r/min离心70min,将沉淀溶于PBS,即得载药囊泡混悬液。各组设6个平行样,培养72h。
1.4HCT116细胞活力及单克隆形成数目检测:将细胞接种到96孔板中,每孔1×103个细胞,在5% CO2,37℃ 环境下孵育72h,将10μL CCK-8溶液加入每个孔中。在37℃下孵育1.5h后,使用 SpectraMax M5检测450nm处的光密度值。细胞存活率=(实验组OD-空白组OD)/(HCT116组OD-空白组OD)。将各组结直肠癌细胞株HCT116用0.25%胰蛋白酶消化成单细胞,以4×105细胞/孔的密度接种到6孔培养板中,24h后,将50个细胞接种于6孔组织培养板中,继续培养2周,然后将细胞用结晶紫-福尔马林溶液染色10min并计数。
1.5HCT116细胞凋亡测定:使用FITC-膜联蛋白V和碘化丙锭(PI)通过流式细胞术分析细胞凋亡。将2mL细胞(5×104个细胞/mL)接种到6孔板中,48h后,用PBS洗涤细胞两次,消化并重悬于100μL结合缓冲液中。细胞密度调整为0.5×106个/mL细胞,使用5μL Annexin V/FITC在室温下黑暗染色细胞10min,加入100μL结合缓冲液,将细胞在室温下在黑暗中用5μL PI染色5min。用流式细胞术分析细胞凋亡率,用Cell Quest Pro软件计算凋亡细胞百分比。
1.6HCT116细胞侵袭、迁移测定:通过Transwell小室评估细胞的侵袭能力。Transwell室底部膜的孔径为8μm,底室充满600μL含有10%FBS的DMEM营养液,顶室的大小为200μL,接种5×105个细胞,在37℃、5%CO2的培养箱中培养24h,将Transwell小室取出并固定在由甲醇和冰醋酸(3:1)组成的液体中30min,用PBS洗涤腔室,用0.5%结晶紫染色并最后固定,在显微镜下随机取5个视野观察并计数染色细胞数。迁移水平测定,将约5×104个细胞加入涂有500ng/mL Matrigel的24孔Transwell上室。下室充满10%FBS补充的DMEM培养基,将细胞在37℃、5%CO2的培养箱中培养。24h后,取出Transwell插入物,使用无菌镊子移除插入物以产生均匀的500μm无细胞间隙,用4%多聚甲醛固定30min,在显微镜下计算迁移距离。
1.7HCT116细胞miR-128、PIK3 mRNA水平测定:TRIzol试剂盒提取总RNA。为了量化miR-128的表达,采用miScript逆转录试剂盒(Qiagen)合成互补DNA,并使用SYBRPremixEXTaq以U6作为内标进行qRT-PCR参考miR-128。为了量化PIK3mRNA的表达,使用逆转录试剂盒(Promega)生成cDNA,并应用IQTM SYBR Green Supermix试剂盒以GAPDH作为内源对照进行扩增。结果用2-ΔΔCt值进行量化和归一化。qRT-PCR检测均在Applied Biosystems 7500系统上进行。
1.8结直肠癌细胞株HCT116 PIK3蛋白表达水平测定:不同处理组的细胞转染72h后,用Radio Immunoprecipitation Assay裂解缓冲液在冰上裂解10min,二辛可宁酸蛋白质测定法定量蛋白质,将蛋白质在100 V电压下加载到十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中,转移到聚偏二氟乙烯膜上,用 5% BSA/TBST 封闭 60 min,将膜与一抗PIK3兔多克隆抗体和GAPDH兔铵多克隆抗体在4℃下孵育过夜,在室温下用1×TBST 溶液洗涤每次5min,重复3次。室温下,将膜与辣根过氧化物酶标记的山羊抗兔IgG孵育1h,并用TBST洗涤3次。每20min应用电化学发光检测发光反应,并拍摄蛋白质印记以供观察。
1.9统计学分析:SPSS 24.0软件进行统计分析,定量数据以均值±标准差表示,多组均数比较采用单因素方差分析,两组间比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结 果
2.1各组结直肠癌细胞株HCT116 OD值、存活率比较:细胞囊泡组OD值、存活率与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组OD值、存活率明显低于HCT116组、细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组OD值、存活率明显低于5-氟尿嘧啶组(P<0.05)。见表1。

表1 各组结直肠癌细胞株HCT116 OD值存活率比较
2.2各组结直肠癌细胞株HCT116单克隆形成数目比较:细胞囊泡组单克隆形成数目与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组单克隆形成数目明显低于HCT116组、细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组单克隆形成数目明显低于5-氟尿嘧啶组(P<0.05)。见表2、图1。

图1 各组结直肠癌细胞株HCT116克隆形成数目比较(结晶紫染色,×400)(A:HCT116组 B:细胞囊泡组 C:5-氟尿嘧啶组 C:5-氟尿嘧啶载药囊泡组)
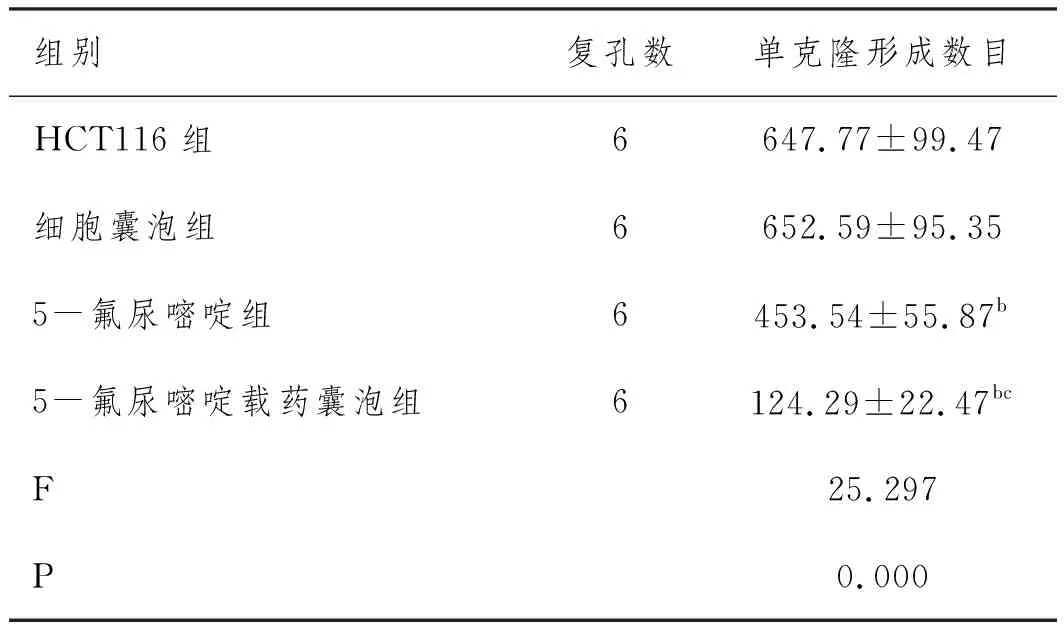
表2 各组结直肠癌细胞株HCT116克隆形成数目比较
2.3各组结直肠癌细胞株HCT116凋亡率比较:细胞囊泡组凋亡率与HCT116组比较无统计学意义(P>0.05);5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组凋亡率明显高于HCT116组、细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组凋亡率明显高于5-氟尿嘧啶组(P<0.05)。见表3、图2。

图2 各组结直肠癌细胞株HCT116凋亡率比较流式细胞图(A:HCT116组 B:细胞囊泡组 C:5-氟尿嘧啶组 C:5-氟尿嘧啶载药囊泡组)

表3 各组结直肠癌细胞株HCT116凋亡率比较
2.4各组结直肠癌细胞株HCT116侵袭能力比较:细胞囊泡组穿膜数与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组穿膜数明显低于HCT116组、细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组穿膜数明显低于5-氟尿嘧啶组(P<0.05)。见表4、图3。

图3 各组结直肠癌细胞株HCT116穿膜数数目比较(结晶紫染色,×400)(A:HCT116组 B:细胞囊泡组 C:5-氟尿嘧啶组 C:5-氟尿嘧啶载药囊泡组)
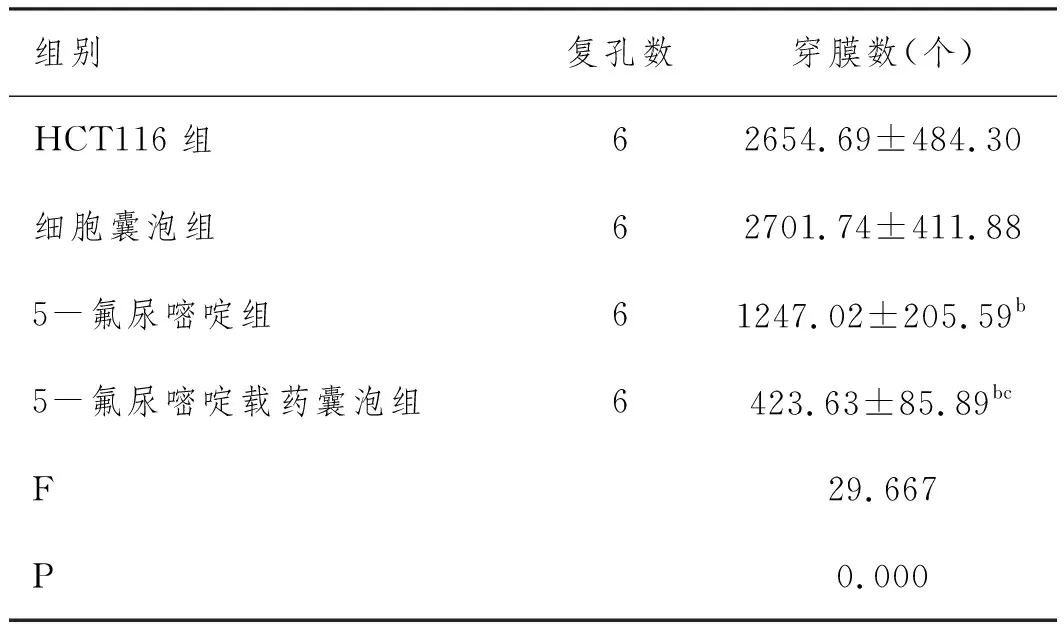
表4 各组结直肠癌细胞株HCT116穿膜数比较
2.5各组结直肠癌细胞株HCT116迁移能力比较:细胞囊泡组迁移距离与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组迁移距离明显低于HCT116组、细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组迁移距离明显低于5-氟尿嘧啶组(P<0.05)。见表5、图4。

图4 各组结直肠癌细胞株HCT116迁移距离比较(×400)(A:HCT116组 B:细胞囊泡组 C:5-氟尿嘧啶组 C:5-氟尿嘧啶载药囊泡组)

表5 各组结直肠癌细胞株HCT116迁移距离比较
2.6各组结直肠癌细胞株HCT116 miR-128、PI3K mRNA和蛋白水平比较:细胞囊泡组miR-128水平与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组miR-128高于HCT116组、细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组miR-128高于5-氟尿嘧啶组(P<0.05)。细胞囊泡组PI3K mRNA和蛋白与HCT116组比较无统计学差异(P>0.05);5-氟尿嘧啶组、5-氟尿嘧啶载药囊泡组PI3K mRNA和蛋白低于HCT116组、细胞囊泡组(P<0.05),5-氟尿嘧啶载药囊泡组PI3KmRNA和蛋白低于5-氟尿嘧啶组(P<0.05)。见表6。
3 讨 论
EV作为一种纳米级的膜结构,主要负责携带各种内容物,通过质膜融合、内吞、与细胞表面受体结合等机制广泛参与肿瘤的生物学过程。EV作为肿瘤侵袭转移的分子基础之一,对肺癌的早期诊断和靶向治疗具有重要意义。研究发现,来源于高转移肺癌细胞和晚期肺癌患者血清的EV诱导波形蛋白表达,诱导HBECs上皮-间质转化,诱导非转移癌细胞的迁移、侵袭和增殖[7];与来自早期非小细胞肺癌(NSCLC)细胞的EV相比,来自转移性SCLC细胞的EV对肿瘤细胞迁移和侵袭的影响更大。特别是在缺氧条件下,转移性小细胞肺癌细胞EV中与肿瘤细胞迁移和侵袭密切相关的转化生长因子-β和白细胞介素-10含量增加[8,9]。EV作为细胞间信息交换的重要物质,通过自分泌或远距离传播的方式将相关信号分子传递给靶细胞,从而产生一系列生物学效应。因此,EV靶向肿瘤治疗方法可能具有广阔的前景。已经确定了EV中常见的三个蛋白质家族,分别是热休克蛋白70(HSP70)、S-腺苷同型半胱氨酸酶和甘油醛3-磷酸脱氢酶。在这项研究中,我们对EV进行了蛋白质组学分析,发现了所有三种蛋白质,进一步证实了EV的纯化。同时,我们在EV中发现了MAP30、MAP30可以增加细胞内Ca2+离子浓度,从而通过细胞凋亡触发ROS介导的癌细胞凋亡。本研究发现5-氟尿嘧啶载药囊泡处理后细胞凋亡的产生,这可能是由EV中的MAP30蛋白介导的。氟尿嘧啶可诱导线粒体ROS,导致癌细胞增殖、侵袭能力下降,ROS的产生增强了5-氟尿嘧啶对癌细胞的抗肿瘤作用。而抗氧化剂降低了5-氟尿嘧啶在结肠癌中的凋亡作用。本研究发现载5-氟尿嘧啶细胞囊泡能明显抑制结直肠癌细胞株HCT116增殖、侵袭水平,增强其凋亡水平。
PI3K蛋白家族是由调节亚基p85和催化亚基p110组成的二聚体,广泛参与调控细胞增殖、分化、凋亡和迁移等表型。有报道[10,11]称PI3K信号的异常激活参与5-氟尿嘧啶耐药的发生发展,而EV通过激活细胞凋亡信号通路和负向调节PI3K/Akt信号通路,抑制5-氟尿嘧啶耐药NSCLC细胞增殖并诱导细胞凋亡,延缓5-氟尿嘧啶耐药NSCLC细胞的增殖和凋亡。此外,炎症是肿瘤进展的重要组成部分。化疗增强炎症可能导致治疗失败和转移。PI3K是先天免疫系统的重要组成部分之一,在癌症中起着重要作用。许多因素可以激活PI3K,包括K+流出、细胞内钙、内质网(ER)应激和ROS[12]。之前的研究结果表明,5-氟尿嘧啶治疗增加了口腔癌(OSCC)中PI3K的表达,从而介导了5-氟尿嘧啶耐药耐药性,而5-氟尿嘧啶耐药可以促进OSCC中的肿瘤生长和转移。
Fer样家族成员4(Ferrostatin-4)是PI3K的下游调控因子,其在肺癌细胞系A549和95D中的过表达抑制集落形成、细胞增殖和迁移,导致细胞中PI3K/Akt表达降低,同时使用小分子抑制剂激活PI3K/Akt信号磷酸酶和张力蛋白同系物逆转了Ferrostatin-4对细胞增殖和转移的抑制作用。同样,miR-128表达在肺癌组织或细胞中下调,miR-128的敲低通过激活PI3K/Akt通路促进A549细胞活力、集落形成和侵袭,加速肿瘤转移和复发。本研究结果与上述研究结果一致,发现细胞外囊泡装载5-氟尿嘧啶能促进结直肠癌细胞株HCT116高表达miR-128,低表达PI3K。本研究未探讨细胞外囊泡装载5-氟尿嘧啶对直肠癌细胞株HCT116 Ferrostatin-4表达的影响,这将在后续研究中进行。
综上所述,细胞外囊泡装载5-氟尿嘧啶能明显抑制结直肠癌细胞株HCT116增殖、侵袭水平,增强其凋亡水平,其机制可能与细胞外囊泡装载5-氟尿嘧啶能促进结直肠癌细胞株HCT116高表达miR-128,低表达PI3K有关。